La reacción de Pictet-Spengler es una reacción química en la que una β-ariletilamina sufre condensación con un aldehído o cetona seguida de cierre de anillo. La reacción fue descubierta por primera vez en 1911 por Amé Pictet y Theodor Spengler (22 de febrero de 1886 - 18 de agosto de 1965). [1] Tradicionalmente, se empleaba un catalizador ácido en un disolvente prótico con calentamiento; [2] sin embargo, se ha demostrado que la reacción funciona en medios apróticos con rendimientos superiores y, a veces, sin catálisis ácida . [3] La reacción de Pictet-Spengler puede considerarse un caso especial de la reacción de Mannich , que sigue una vía de reacción similar. La fuerza impulsora de esta reacción es la electrofilicidad del ion iminio generado a partir de la condensación del aldehído y la amina en condiciones ácidas. Esto explica la necesidad de un catalizador ácido en la mayoría de los casos, ya que la imina no es lo suficientemente electrofílica para el cierre del anillo, pero el ion iminio es capaz de experimentar la reacción.

La reacción de Pictet-Spengler está muy extendida tanto en la industria como en la biosíntesis. Ha seguido siendo una reacción importante en los campos de la síntesis de alcaloides y orgánica desde su inicio, donde se ha empleado en el desarrollo de muchas betacarbolinas . La reacción natural de Pictet-Spengler normalmente emplea una enzima , como la estrictosidina sintasa . Los productos de Pictet-Spengler se pueden aislar de muchos productos derivados inicialmente de la naturaleza, incluidos alimentos como la salsa de soja y el kétchup . En tales casos, es común encontrar el aminoácido triptófano y varias aldosas utilizadas como materia prima biológica .
Los anillos aromáticos nucleofílicos como el indol o el pirrol dan productos con altos rendimientos y condiciones suaves, mientras que los anillos aromáticos menos nucleofílicos como un grupo fenilo dan rendimientos más bajos o requieren temperaturas más altas y un ácido fuerte. La reacción original de Pictet-Spengler fue la reacción de fenetilamina y dimetoximetano , catalizada por ácido clorhídrico formando una tetrahidroisoquinolina .
La reacción de Pictet-Spengler se ha aplicado a la química combinatoria en fase sólida con gran éxito. [4] [5]
Una reacción análoga con un aril-β-etanol se llama reacción oxa-Pictet-Spengler . [6]
El mecanismo de reacción ocurre por la formación inicial de un ion iminio ( 2 ) seguida de adición electrofílica en la posición 3, de acuerdo con la nucleofilia esperada de los indoles , para dar el espirociclo 3. Después de la migración del mejor grupo migratorio , la desprotonación da el producto ( 5 ).

La sustitución de un indol por un grupo 3,4-dimetoxifenilo da lugar a la reacción denominada síntesis de tetrahidroisoquinolina de Pictet-Spengler. Las condiciones de reacción son generalmente más duras que las de la variante indólica y requieren condiciones de reflujo con ácidos fuertes como el ácido clorhídrico , el ácido trifluoroacético o superácidos . [7] [8]

En lugar de catalizar la ciclización de Pictet-Spengler con un ácido fuerte, se puede acilar el ion iminio para formar el ion intermedio N -aciliminio. El ion N -aciliminio es un electrófilo muy potente y la mayoría de los sistemas de anillos aromáticos se ciclarán en condiciones suaves con buenos rendimientos. [9]
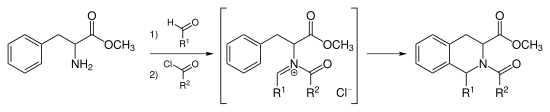
El tadalafilo se sintetiza mediante la reacción de Pictet-Spengler de N -aciliminio. [10] Esta reacción también puede ser catalizada por AuCl 3 y AgOTf . [11]
Cuando la reacción de Pictet-Spengler se realiza con un aldehído distinto del formaldehído , se crea un nuevo centro quiral. Se han desarrollado varias reacciones de Pictet-Spengler diastereoselectivas controladas por sustrato o auxiliares. [12] [13] Además, List et al. han publicado un ácido de Brønsted quiral que cataliza las reacciones de Pictet-Spengler asimétricas. [14]
Triptófanos: reacción diastereocontrolada
La reacción del triptófano enantiopuro o sus ésteres alquílicos de cadena corta conduce a 1,2,3,4-tetrahidro- β -carbolinas en las que un nuevo centro quiral en C-1 adopta una configuración cis o trans hacia el grupo carboxilo C-3 . La conducción cis está controlada cinéticamente , es decir, se realiza a temperaturas más bajas. A temperaturas más altas, la reacción se vuelve reversible y generalmente favorece la racemización . Los productos dominados por 1,3- trans se pueden obtener con triptófanos N b - bencilados , que son accesibles por aminación reductora . El grupo bencilo se puede eliminar hidrogenolíticamente después. Como regla general, las señales de RMN de 13 C para C1 y C3 se desplazan hacia abajo en los productos cis en relación con los productos trans (ver efecto de compresión estérica). [3] [15]