En química orgánica , la reacción Nef es una reacción orgánica que describe la hidrólisis ácida de una sal de un nitroalcano primario o secundario ( R−NO 2 ) a un aldehído ( R−CH=O ) o una cetona ( R 2 C=O ) y óxido nitroso ( N 2 O ). La reacción ha sido objeto de varias revisiones bibliográficas. [1] [2] [3]

La reacción fue descrita en 1894 por el químico John Ulric Nef [4] , quien trató la sal de sodio del nitroetano con ácido sulfúrico , obteniendo un rendimiento del 85-89 % de óxido nitroso y al menos un rendimiento del 70 % de acetaldehído . Sin embargo, la reacción fue iniciada un año antes, en 1893, por Konovalov [5], quien convirtió la sal de potasio del 1-fenilnitroetano con ácido sulfúrico en acetofenona .
El mecanismo de reacción a partir de la sal nitronato como estructuras de resonancia 1a y 1b se representa a continuación:
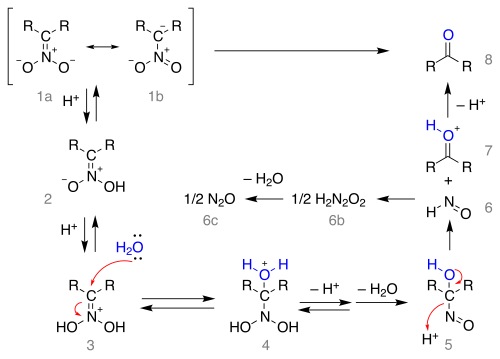
La sal se protona formando el ácido nitroso 2 (en algunos casos se han aislado estos nitronatos) y una vez más el ion iminio 3. Este intermediario es atacado por agua en una adición nucleofílica formando 4 que pierde un protón y luego agua al 1- nitroso -alcanol 5 que se cree que es responsable del color azul oscuro de la mezcla de reacción en muchas reacciones de Nef. Este intermediario se reorganiza al ácido hiponitroso 6 (formando óxido nitroso 6c a 6b ) y al ion oxonio 7 que pierde un protón para formar el compuesto carbonílico .
Tenga en cuenta que la formación de la sal nitronato a partir del compuesto nitro requiere un átomo de hidrógeno alfa y, por lo tanto, la reacción falla con compuestos nitro terciarios.
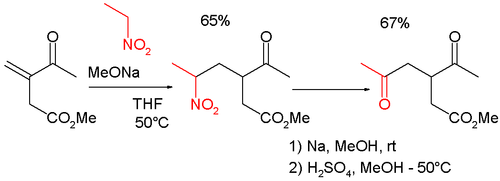
Las reacciones de tipo Nef se encuentran frecuentemente en la síntesis orgánica , porque convierten la reacción de Henry en un método conveniente para la funcionalización en las ubicaciones β y γ. [6] Así, por ejemplo, la reacción se combina con la reacción de Michael en la síntesis del 3-acetil-5-oxohexanoato de metil γ -cetocarbonilo, en sí mismo un intermedio de ciclopentenona : [7] [8]
En la química de los carbohidratos , son un método de extensión de cadena para las aldosas , como en el marcaje isotópico de C 14 - D - manosa y C 14 - D - glucosa a partir de D - arabinosa y C 14 - nitrometano (el primer paso aquí es una reacción de Henry ):

La reacción opuesta es la degradación de Wohl .
El protocolo original de Nef, que utiliza ácido sulfúrico concentrado , ha sido descrito como "violento". [9] La hidrólisis con ácidos fuertes sin la etapa de sal intermedia da como resultado la formación de ácidos carboxílicos y sales de hidroxilamina , [ cita requerida ] pero los ácidos de Lewis como el cloruro de estaño (IV) [10] y el cloruro de hierro (III) [11] dan una hidrólisis limpia. Alternativamente, los agentes oxidantes fuertes , como la oxona , [12] el ozono o los permanganatos , escindirán el tautómero nitronato en el doble enlace para formar un carbonilo y nitrato . Los reductores oxófilos , como las sales de titanio , reducirán el nitronato a una imina susceptible a la hidrólisis , pero los reductores menos selectivos dan la amina en su lugar. [9]