Las reacciones de Friedel-Crafts son un conjunto de reacciones desarrolladas por Charles Friedel y James Crafts en 1877 para unir sustituyentes a un anillo aromático . [1] Las reacciones de Friedel-Crafts son de dos tipos principales: reacciones de alquilación y reacciones de acilación . Ambas se producen por sustitución aromática electrofílica . [2] [3] [4] [5]
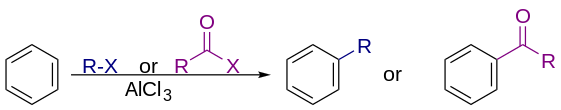
En aplicaciones comerciales, los agentes alquilantes son generalmente alquenos , algunas de las reacciones a mayor escala que se practican en la industria. Estas alquilaciones son de gran importancia industrial, por ejemplo, para la producción de etilbenceno , el precursor del poliestireno, a partir de benceno y etileno, y para la producción de cumeno a partir de benceno y propeno en el proceso de cumeno :
La producción industrial normalmente utiliza ácidos sólidos derivados de una zeolita como catalizador.
La alquilación de Friedel-Crafts implica la alquilación de un anillo aromático . Tradicionalmente, los agentes alquilantes son haluros de alquilo . Se pueden utilizar muchos agentes alquilantes en lugar de haluros de alquilo. Por ejemplo, se pueden utilizar enonas y epóxidos en presencia de protones. La reacción normalmente emplea un ácido de Lewis fuerte , como cloruro de aluminio como catalizador, para aumentar la electrofilicidad del agente alquilante. [6]
Esta reacción tiene la desventaja de que el producto es más nucleófilo que el reactivo porque los grupos alquilo son activadores de la reacción de Friedel–Crafts . En consecuencia, puede ocurrir una sobrealquilación. Sin embargo, el impedimento estérico puede aprovecharse para limitar el número de ciclos de alquilación sucesivos que ocurren, como en la t -butilación del 1,4-dimetoxibenceno que da solo el producto de dos ciclos de alquilación y con solo uno de los tres posibles isómeros del mismo: [7]
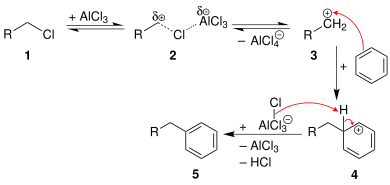
Además, la reacción sólo es útil para haluros de alquilo primarios en un sentido intramolecular cuando se forma un anillo de 5 o 6 miembros. Para el caso intermolecular, la reacción se limita a agentes alquilantes terciarios , algunos agentes alquilantes secundarios (aquellos para los cuales el reordenamiento del carbocatión está degenerado) o agentes alquilantes que producen carbocationes estabilizados (por ejemplo, bencílicos o alílicos). En el caso de haluros de alquilo primarios, el complejo similar al carbocatión (R (+) ---X---Al (-) Cl 3 ) experimentará una reacción de reordenamiento del carbocatión para dar casi exclusivamente el producto reordenado derivado de un carbocatión secundario o terciario. [8]
La protonación de alquenos genera carbocationes , los electrófilos. Un ejemplo a escala de laboratorio es la síntesis de cloruro de neofilo a partir de benceno y cloruro de metalilo utilizando ácido sulfúrico como catalizador. [9]
El mecanismo general de los haluros de alquilo primarios se muestra a continuación. [8]
Las alquilaciones de Friedel-Crafts pueden ser reversibles . Aunque esto suele ser indeseable, se puede aprovechar; por ejemplo, facilitando las reacciones de transalquilación . [10]

También permite que las cadenas de alquilo se añadan de forma reversible como grupos protectores . Este enfoque se utiliza industrialmente en la síntesis de 4,4'-bifenol a través del acoplamiento oxidativo y la posterior desalquilación de 2,6-di-terc-butilfenol . [11] [12]
La acilación de Friedel-Crafts implica la acilación de anillos aromáticos. Los agentes acilantes típicos son los cloruros de acilo . Los anhídridos de ácido, así como los ácidos carboxílicos, también son viables. Un catalizador de ácido de Lewis típico es el tricloruro de aluminio . Sin embargo, debido a que el producto cetona forma un complejo bastante estable con ácidos de Lewis como AlCl3 , generalmente se debe emplear una cantidad estequiométrica o más del "catalizador", a diferencia del caso de la alquilación de Friedel-Crafts, en la que el catalizador se regenera constantemente. [13] Las condiciones de reacción son similares a la alquilación de Friedel-Crafts. Esta reacción tiene varias ventajas sobre la reacción de alquilación. Debido al efecto de atracción de electrones del grupo carbonilo , el producto cetona siempre es menos reactivo que la molécula original, por lo que no ocurren acilaciones múltiples. Además, no hay reordenamientos de carbocatión , ya que el ion acilio está estabilizado por una estructura de resonancia en la que la carga positiva está en el oxígeno.
La viabilidad de la acilación de Friedel-Crafts depende de la estabilidad del reactivo de cloruro de acilo. El cloruro de formilo, por ejemplo, es demasiado inestable para ser aislado. Por lo tanto, la síntesis de benzaldehído a través de la vía de Friedel-Crafts requiere que el cloruro de formilo se sintetice in situ . Esto se logra mediante la reacción de Gattermann-Koch , que se logra tratando el benceno con monóxido de carbono y cloruro de hidrógeno a alta presión, catalizada por una mezcla de cloruro de aluminio y cloruro cuproso . Las cetonas simples que podrían obtenerse mediante la acilación de Friedel-Crafts se producen mediante métodos alternativos, por ejemplo, oxidación, en la industria.
La reacción se lleva a cabo mediante la generación de un centro de acilio. La reacción se completa mediante la desprotonación del ion arenio por AlCl 4 − , regenerando el catalizador AlCl 3 . Sin embargo, a diferencia de la reacción de alquilación verdaderamente catalítica, la cetona formada es una base de Lewis moderada, que forma un complejo con el ácido de Lewis fuerte tricloruro de aluminio. La formación de este complejo es típicamente irreversible en condiciones de reacción. Por lo tanto, se necesita una cantidad estequiométrica de AlCl 3 . El complejo se destruye durante el tratamiento acuoso para dar la cetona deseada. Por ejemplo, la síntesis clásica de desoxibenzoína requiere 1,1 equivalentes de AlCl 3 con respecto al reactivo limitante, cloruro de fenilacetilo. [14] En ciertos casos, generalmente cuando se activa el anillo de benceno, la acilación de Friedel-Crafts también se puede llevar a cabo con cantidades catalíticas de un ácido de Lewis más suave (por ejemplo, sales de Zn(II)) o un catalizador de ácido de Brønsted utilizando el anhídrido o incluso el propio ácido carboxílico como agente de acilación.
Si se desea, la cetona resultante puede reducirse posteriormente al sustituyente alcano correspondiente mediante la reducción de Wolff-Kishner o la reducción de Clemmensen . El resultado neto es el mismo que el de la alquilación de Friedel-Crafts, excepto que no es posible la reorganización. [15]
Los arenos reaccionan con ciertos aldehídos y cetonas para formar productos hidroxialquilados, por ejemplo en la reacción del derivado mesitilo del glioxal con benceno: [16]
Como es habitual, el grupo aldehído es un electrófilo más reactivo que la fenona .

Esta reacción está relacionada con varias reacciones clásicas con nombre:
Las reacciones de Friedel-Crafts se han utilizado en la síntesis de varios colorantes de triarilmetano y xanteno . [26] Algunos ejemplos son la síntesis de timolftaleína (un indicador de pH) a partir de dos equivalentes de timol y anhídrido ftálico :
La reacción del anhídrido ftálico con resorcinol en presencia de cloruro de cinc produce el fluoróforo fluoresceína . La sustitución del resorcinol por N,N-dietilaminofenol en esta reacción produce rodamina B :
La síntesis de Haworth es un método clásico para la síntesis de hidrocarburos aromáticos policíclicos. En esta reacción, un areno se hace reaccionar con anhídrido succínico , el producto resultante se reduce a continuación en una reducción de Clemmensen o una reducción de Wolff-Kishner . Por último, se lleva a cabo una segunda acilación de Friedel-Crafts con adición de ácido. [27]
El producto formado en esta reacción se reduce luego de forma análoga, seguido de una reacción de deshidrogenación (con el reactivo SeO 2 por ejemplo) para extender el sistema de anillo aromático. [28]
La reacción del cloroformo con compuestos aromáticos utilizando un catalizador de cloruro de aluminio produce triarilmetanos, que suelen tener colores brillantes, como es el caso de los tintes de triarilmetanos. Se trata de una prueba de laboratorio para compuestos aromáticos. [29]
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace )