Gen codificador de proteínas en la especie Homo sapiens
La peropsina , un receptor similar al pigmento visual, es una proteína que en los humanos está codificada por el gen RRH . [5] [6] Pertenece como otras opsinas animales a los receptores acoplados a proteína G. [6] Aun así, las primeras peropsinas ya fueron descubiertas en ratones y humanos en 1997, [5] no se sabe mucho sobre ellas. [7]
Fotoquímica
Como la mayoría de las opsinas, las peropsinas tienen en su séptimo dominio transmembrana una lisina correspondiente a la posición del aminoácido 296 en la rodopsina bovina , [5] [7] que es importante para la unión a la retina y la detección de luz. [8]
En el anfioxo , un cefalocordado , una peropsina se une en el estado oscuro al todo-trans- retinal en lugar del 11-cis-retinal, [9] como ocurre en la rodopsina del ganado. [10] [11] [12] [13] [14] Por lo tanto, se ha sugerido que las peropsinas son fotoisomerasas. [9]
Localización de tejidos
En ratones, una peropsina se localiza en las microvellosidades apicales del epitelio pigmentario de la retina (EPR). [5] Allí, regula el almacenamiento o el movimiento de vitamina A desde la retina hasta el EPR. [15] Una peropsina también se expresa en los queratinocitos de la piel humana . En el cultivo de células de queratinocitos , reacciona a la luz ultravioleta si se suministra retinal. [16] En el pollo , una peropsina se expresa con una RGR-opsina en la glándula pineal y la retina. [17]
Localización y estructura de genes
El gen de la peropsina humana se encuentra en la banda 4q25 del cromosoma 4 y tiene seis intrones [6] [18] al igual que las opsinas RGR. Sin embargo, solo dos de estos intrones están insertados en el mismo lugar, lo que indica que las peropsinas y las opsinas RGR están más relacionadas entre sí que con las opsinas ciliares y rabdoméricas. [18] Esta estructura genética compartida también se refleja en las filogenias de las opsinas, donde las peropsinas y las opsinas RGR están en el mismo grupo: las cromopsinas. [18] [7] [19] [20]
Filogenia
Las peropsinas están restringidas a los craneados y los cefalocordados. [7] Los craneados son el taxón que contiene a los mamíferos y con ellos a los humanos. Las peropsinas son uno de los siete subgrupos de las cromopsinas. Los otros grupos son las RGR-opsinas , los retinocromos, las nemopsinas, las astropsinas, las varropsinas y las gluopsinas. [7] Las cromopsinas son uno de los tres subgrupos de las tetraopsinas (también conocidas como RGR/Go o opsinas del grupo 4). Los otros grupos son las neuropsinas y las Go-opsinas. Las tetraopsinas son uno de los cinco grupos principales de las opsinas animales , también conocidas como opsinas tipo 2). Los otros grupos son las opsinas ciliares (c-opsinas, cilopsinas), las opsinas rabdoméricas (r-opsinas, rabopsinas), las xenopsinas y las nessopsinas. Cuatro de estos subclados se encuentran en Bilateria (todos excepto las nessopsinas). [7] [19] Sin embargo, los clados bilaterales constituyen un taxón parafilético sin las opsinas de los cnidarios . [7] [19] [20] [21]
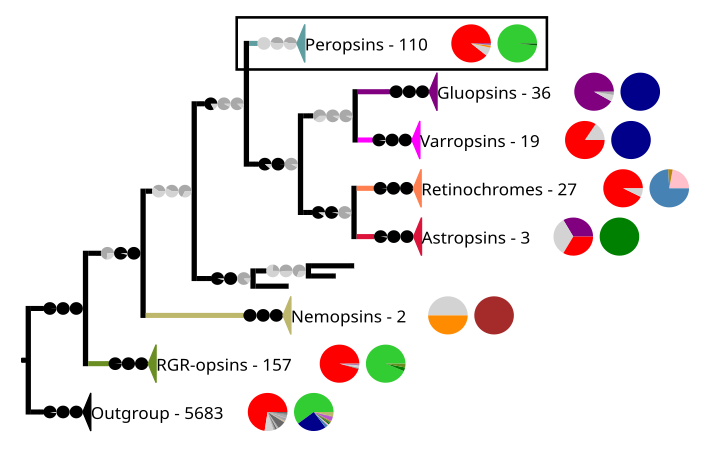
Relación filogenética de las peropsinas con las demás opsinas
Reconstrucción filogenética de las opsinas. El grupo externo contiene otros
receptores acoplados a la proteína G. El recuadro resalta las tetraopsinas, que se expanden en la siguiente imagen.
Reconstrucción filogenética de las tetraopsinas. El grupo externo contiene otros receptores acoplados a la proteína G, incluidas las otras opsinas. El recuadro resalta las cromopsinas, que se expanden en la siguiente imagen.
Reconstrucción filogenética de las cromopsinas. El grupo externo contiene otros receptores acoplados a proteína G, incluidas las otras opsinas. El recuadro resalta las peropsinas.
En la filogenia anterior, cada clado contiene secuencias de opsinas y otros receptores acoplados a proteína G. El número de secuencias y dos gráficos circulares se muestran al lado del clado. El primer gráfico circular muestra el porcentaje de un determinado aminoácido en la posición en las secuencias correspondientes a la posición 296 en la rodopsina del ganado. Los aminoácidos están codificados por colores. Los colores son rojo para la lisina (K), morado para el ácido glutámico (E), naranja para la arginina (R), gris oscuro y medio para otros aminoácidos y gris claro para las secuencias que no tienen datos en esa posición. El segundo gráfico circular da la composición taxonómica de cada clado, el verde representa a los craneados , el verde oscuro a los cefalocordados , el verde medio a los equinodermos , el marrón a los nematodos , el rosa pálido a los anélidos , el azul oscuro a los artrópodos , el azul claro a los moluscos y el morado a los cnidarios . Las ramas de los clados tienen gráficos circulares que dan valores de soporte para las ramas. Los valores van de derecha a izquierda SH-aLRT/aBayes/UFBoot. Las ramas se consideran soportadas cuando SH-aLRT ≥ 80%, aBayes ≥ 0,95 y UFBoot ≥ 95%. Si un valor de soporte está por encima de su umbral, el gráfico circular es negro; de lo contrario, es gris. [7]
Importancia clínica
Dado que la RGR-opsina puede estar asociada con la retinitis pigmentosa , [22] que, al igual que la peropsina, también se expresa en el epitelio pigmentario de la retina, se examinó la peropsina para determinar si tenía un vínculo con la retinitis pigmentosa. [23] Sin embargo, no se pudo establecer ningún vínculo. [23] [24]
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000180245 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000028012 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ abcd Sun H, Gilbert DJ, Copeland NG, Jenkins NA, Nathans J (septiembre de 1997). "Peropsina, una nueva proteína similar a un pigmento visual ubicada en las microvellosidades apicales del epitelio pigmentario de la retina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (18): 9893–9898. Bibcode :1997PNAS...94.9893S. doi : 10.1073/pnas.94.18.9893 . PMC 23288 . PMID 9275222.
- ^ abc "Gen Entrez: homólogo de rodopsina derivado del epitelio pigmentario de la retina RRH".
- ^ abcdefgh Gühmann M, Porter ML, Bok MJ (agosto de 2022). "Las gluopsinas: opsinas sin la lisina de unión a la retina". Cells . 11 (15): 2441. doi : 10.3390/cells11152441 . PMC 9368030 . PMID 35954284.
 El material fue copiado y adaptado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado y adaptado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Leung NY, Thakur DP, Gurav AS, Kim SH, Di Pizio A, Niv MY, et al. (abril de 2020). "Funciones de las opsinas en el gusto de la Drosophila". Current Biology . 30 (8): 1367–1379.e6. Código Bibliográfico :2020CBio...30E1367L. doi :10.1016/j.cub.2020.01.068. PMC 7252503 . PMID 32243853.
- ^ ab Koyanagi M, Terakita A, Kubokawa K, Shichida Y (noviembre de 2002). "Homólogos de anfioxo de rodopsina y peropsina acopladas a Go que tienen 11-cis- y todo-trans-retinianos como cromóforos". Cartas FEBS . 531 (3): 525–528. doi : 10.1016/s0014-5793(02)03616-5 . PMID 12435605. S2CID 11669142.
- ^ Wald G (julio de 1934). "Carotenoides y el ciclo de la vitamina A en la visión". Nature . 134 (3376): 65. Bibcode :1934Natur.134...65W. doi : 10.1038/134065a0 . S2CID 4022911.
- ^ Wald G, Brown PK, Hubbard R, Oroshnik W (julio de 1955). "Isómeros cis impedidos de la vitamina A y el retineno: la estructura del isómero neo-B". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 41 (7): 438–451. Bibcode :1955PNAS...41..438W. doi : 10.1073/pnas.41.7.438 . PMC 528115 . PMID 16589696.
- ^ Brown PK, Wald G (octubre de 1956). "El isómero neo-b de la vitamina A y el retineno". The Journal of Biological Chemistry . 222 (2): 865–877. doi : 10.1016/S0021-9258(20)89944-X . PMID 13367054.
- ^ Oroshnik W (junio de 1956). "La síntesis y configuración de la vitamina A neo-B y la neorretinina b". Revista de la Sociedad Química Americana . 78 (11): 2651–2652. doi :10.1021/ja01592a095.
- ^ Oroshnik W, Brown PK, Hubbard R, Wald G (septiembre de 1956). "Isómeros cis impedidos de la vitamina A y el retineno: la estructura del isómero neo-B". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 42 (9): 578–580. Bibcode :1956PNAS...42..578O. doi : 10.1073/pnas.42.9.578 . PMC 534254 . PMID 16589909.
- ^ Cook JD, Ng SY, Lloyd M, Eddington S, Sun H, Nathans J, et al. (diciembre de 2017). "La peropsina modula el tránsito de vitamina A desde la retina hasta el epitelio pigmentario de la retina". The Journal of Biological Chemistry . 292 (52): 21407–21416. doi : 10.1074/jbc.M117.812701 . PMC 5766940 . PMID 29109151.
- ^ Toh PP, Bigliardi-Qi M, Yap AM, Sriram G, Stelmashenko O, Bigliardi P (diciembre de 2016). "La expresión de peropsina en la piel humana está relacionada con la fototransducción de luz violeta en los queratinocitos". Dermatología experimental . 25 (12): 1002–1005. doi : 10.1111/exd.13226 . PMID 27676658. S2CID 1373924.
- ^ Bailey MJ, Cassone VM (marzo de 2004). "Fotoisomerasas de opsina en la retina y la glándula pineal del pollo: caracterización, localización y regulación circadiana". Oftalmología y ciencia visual investigativas . 45 (3): 769–775. doi :10.1167/iovs.03-1125. PMID 14985289.
- ^ abc Bellingham J, Wells DJ, Foster RG (enero de 2003). "Caracterización in silico y localización cromosómica de RRH humana (peropsina): implicaciones para la evolución de la opsina". BMC Genomics . 4 (1): 3. doi : 10.1186/1471-2164-4-3 . PMC 149353 . PMID 12542842.
- ^ abc Ramirez MD, Pairett AN, Pankey MS, Serb JM, Speiser DI, Swafford AJ, et al. (26 de octubre de 2016). "El último ancestro común de la mayoría de los animales bilaterales poseía al menos 9 opsinas". Genome Biology and Evolution : evw248. doi : 10.1093/gbe/evw248 . PMC 5521729 . PMID 27797948.
- ^ ab Porter ML, Blasic JR, Bok MJ, Cameron EG, Pringle T, Cronin TW, et al. (enero de 2012). "Arrojando nueva luz sobre la evolución de la opsina". Actas. Ciencias biológicas . 279 (1726): 3–14. doi :10.1098/rspb.2011.1819. PMC 3223661. PMID 22012981 .
- ^ Liegertová M, Pergner J, Kozmiková I, Fabian P, Pombinho AR, Strnad H, et al. (julio de 2015). "El genoma del cubozoo ilumina la diversificación funcional de las opsinas y la evolución de los fotorreceptores". Scientific Reports . 5 : 11885. Bibcode :2015NatSR...511885L. doi :10.1038/srep11885. PMC 5155618 . PMID 26154478.
- ^ Morimura H, Saindelle-Ribeaudeau F, Berson EL, Dryja TP (diciembre de 1999). "Mutaciones en RGR, que codifican un homólogo de opsina sensible a la luz, en pacientes con retinosis pigmentaria". Genética de la Naturaleza . 23 (4): 393–394. doi :10.1038/70496. PMID 10581022. S2CID 35176366.
- ^ ab Ksantini M, Sénéchal A, Humbert G, Arnaud B, Hamel CP (marzo de 2007). "RRH, que codifica la peropsina similar a la opsina expresada en el epitelio pigmentario de la retina, no está mutada en la retinitis pigmentosa y enfermedades relacionadas" (PDF) . Genética oftálmica . 28 (1): 31–37. doi :10.1080/13816810701202052. PMID 17454745. S2CID 225451.
- ^ Rivolta C, Berson EL, Dryja TP (diciembre de 2006). "Examen de mutación del gen de la peropsina, un homólogo de la rodopsina específico del epitelio pigmentario de la retina, en pacientes con retinitis pigmentosa y enfermedades relacionadas". Molecular Vision . 12 : 1511–1515. PMID 17167409.
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .