
Las betalactamasas ( β-lactamasas ) son enzimas ( EC 3.5.2.6) producidas por bacterias que proporcionan multirresistencia a los antibióticos betalactámicos como penicilinas , cefalosporinas , cefamicinas , monobactámicos y carbapenémicos ( ertapenem ), aunque los carbapenémicos son relativamente resistentes a la betalactamasa. La betalactamasa proporciona resistencia a los antibióticos rompiendo la estructura de los antibióticos . Todos estos antibióticos tienen un elemento común en su estructura molecular: un anillo de cuatro átomos conocido como anillo betalactámico (β-lactámico). A través de la hidrólisis , la enzima lactamasa rompe el anillo betalactámico, desactivando las propiedades antibacterianas de la molécula.
Las betalactamasas producidas por bacterias gramnegativas suelen secretarse, especialmente cuando hay antibióticos presentes en el ambiente. [1]
La estructura de una serina β-lactamasa (SBL) de Streptomyces se da mediante 1BSG. El pliegue alfa-beta ( InterPro : IPR012338 ) se asemeja al de una DD -transpeptidasa , a partir de la cual se cree que evolucionó la enzima. Los antibióticos β-lactámicos se unen a las DD -transpeptidasas para inhibir la biosíntesis de la pared celular bacteriana. Las serina β-lactamasas se agrupan por similitud de secuencia en los tipos A, C y D.
El otro tipo de beta-lactamasa es del tipo metalo ("tipo B"). Las metalo-beta-lactamasas (MBL) necesitan iones metálicos (1 o 2 iones Zn 2+ [2] ) en su sitio activo para sus actividades catalíticas. [3] La estructura de la metalo-beta-lactamasa 1 de Nueva Delhi está dada por 6C89. Se asemeja a una ARNasa Z , de la que se cree que ha evolucionado.
Los dos tipos de betalactamasas funcionan sobre la base de los dos mecanismos básicos de apertura del anillo β-lactámico. [2]
Las SBL son similares en estructura y mecanismo a las proteínas de unión a penicilina (PBP), que son necesarias para la construcción y modificación de la pared celular. Las SBL y las PBP cambian covalentemente un residuo de serina del sitio activo. La diferencia entre las PBP y las SBL es que las últimas generan enzima libre y antibiótico inactivo mediante la hidrólisis muy rápida del intermediario acil-enzima. [ cita requerida ]
Los MBL utilizan los iones Zn 2+ para activar un sitio de unión de la molécula de agua para la hidrólisis del anillo β-lactámico. Los quelantes de zinc se han investigado recientemente como inhibidores de la metalo-β-lactamasa, ya que a menudo pueden restaurar la susceptibilidad a los carbapenémicos. [4]
La penicilinasa es un tipo específico de β-lactamasa, que muestra especificidad para las penicilinas , nuevamente al hidrolizar el anillo β-lactámico . Los pesos moleculares de las diversas penicilinasas tienden a agruparse cerca de los 50 kilodaltons.
La penicilinasa fue la primera β-lactamasa que se identificó. Fue aislada por primera vez por Abraham y Chain en 1940 a partir de E. coli (que son bacterias gramnegativas) incluso antes de que la penicilina entrara en uso clínico, [5] pero la producción de penicilina se extendió rápidamente a bacterias que anteriormente no la producían o que la producían solo en raras ocasiones. Se desarrollaron betalactámicos resistentes a la penicilinasa, como la meticilina , pero ahora existe una resistencia generalizada incluso a estas.
Entre las bacterias gramnegativas, la aparición de resistencia a las cefalosporinas de espectro extendido ha sido una preocupación importante. Apareció inicialmente en un número limitado de especies bacterianas ( E. cloacae , C. freundii , S. marcescens y P. aeruginosa ) que podían mutar para hiperproducir su β-lactamasa de clase C cromosómica. Unos años más tarde, la resistencia apareció en especies bacterianas que no producían naturalmente enzimas AmpC ( K. pneumoniae , Salmonella spp., P. mirabilis ) debido a la producción de ESBL de tipo TEM o SHV (beta lactamasas de espectro extendido). Característicamente, tal resistencia ha incluido oxiimino- (por ejemplo ceftizoxima , cefotaxima , ceftriaxona y ceftazidima , así como el oxiimino-monobactam aztreonam ), pero no 7-alfa-metoxi-cefalosporinas ( cefamicinas ; en otras palabras, cefoxitina y cefotetán ); ha sido bloqueada por inhibidores como clavulanato , sulbactam o tazobactam y no implicó carbapenémicos ni temocilina . Las β-lactamasas AmpC mediadas por cromosomas representan una nueva amenaza, ya que confieren resistencia a 7-alfa-metoxi-cefalosporinas ( cefamicinas ) como cefoxitina o cefotetán , pero no se ven afectadas por inhibidores de β-lactamasa disponibles comercialmente y pueden, en cepas con pérdida de porinas de membrana externa, proporcionar resistencia a carbapenémicos. [6]
Los miembros de esta familia expresan comúnmente β-lactamasas (p. ej., TEM-3, TEM-4, [7] y SHV-2 [8] ) que confieren resistencia a las cefalosporinas de espectro expandido (espectro extendido). A mediados de la década de 1980, se detectó este nuevo grupo de enzimas, las β-lactamasas de espectro extendido (ESBL), (detectadas por primera vez en 1979). [9] La prevalencia de bacterias productoras de ESBL ha aumentado gradualmente en los hospitales de cuidados agudos. [10] La prevalencia en la población general varía entre países, p. ej. aproximadamente el 6% en Alemania [11] y Francia, [12] el 13% en Arabia Saudita, [13] y el 63% en Egipto. [14] Las ESBL son beta-lactamasas que hidrolizan las cefalosporinas de espectro extendido con una cadena lateral oxiimino. Estas cefalosporinas incluyen cefotaxima , ceftriaxona y ceftazidima , así como el oxiimino-monobactam aztreonam . Por lo tanto, las ESBL confieren multirresistencia a estos antibióticos y oxiimino-beta lactámicos relacionados. En circunstancias típicas, derivan de genes para TEM-1, TEM-2 o SHV-1 por mutaciones que alteran la configuración de aminoácidos alrededor del sitio activo de estas β-lactamasas. Un conjunto más amplio de antibióticos β-lactámicos son susceptibles a la hidrólisis por estas enzimas. Recientemente se ha descrito un número cada vez mayor de ESBL que no son del linaje TEM o SHV. [15] Las ESBL con frecuencia están codificadas por plásmidos. Los plásmidos responsables de la producción de ESBL con frecuencia llevan genes que codifican resistencia a otras clases de fármacos (por ejemplo, aminoglucósidos). Por lo tanto, las opciones de antibióticos en el tratamiento de organismos productores de ESBL son extremadamente limitadas. Los carbapenémicos son el tratamiento de elección para infecciones graves causadas por microorganismos productores de BLEE, aunque recientemente se han descrito aislados resistentes a los carbapenémicos (principalmente resistentes al ertapenémico ). [16] Los microorganismos productores de BLEE pueden parecer susceptibles a algunas cefalosporinas de espectro extendido . Sin embargo, el tratamiento con estos antibióticos se ha asociado con altas tasas de fracaso. [ cita requerida ]
TEM-1 es la beta-lactamasa más comúnmente encontrada en bacterias gram-negativas . Hasta el 90% de la resistencia a la ampicilina en E. coli se debe a la producción de TEM-1. [17] También responsable de la resistencia a la ampicilina y penicilina que se observa en H. influenzae y N. gonorrhoeae en números cada vez mayores. Aunque las beta-lactamasas de tipo TEM se encuentran con mayor frecuencia en E. coli y K. pneumoniae , también se encuentran en otras especies de bacterias gram-negativas con una frecuencia cada vez mayor. Las sustituciones de aminoácidos responsables del fenotipo de beta-lactamasa de espectro extendido (ESBL) se agrupan alrededor del sitio activo de la enzima y cambian su configuración, lo que permite el acceso a sustratos oxiimino-beta-lactámicos. Abrir el sitio activo a sustratos betalactámicos también mejora típicamente la susceptibilidad de la enzima a inhibidores de β-lactamasa, como el ácido clavulánico. Las sustituciones de un solo aminoácido en las posiciones 104, 164, 238 y 240 producen el fenotipo ESBL, pero las ESBL con el espectro más amplio suelen tener más de una sustitución de un solo aminoácido. En función de diferentes combinaciones de cambios, actualmente se han descrito 140 enzimas de tipo TEM. TEM-10, TEM-12 y TEM-26 se encuentran entre las más comunes en los Estados Unidos. [18] [19] [20] El término TEM proviene del nombre del paciente ateniense (Temoniera) del que se recuperó el aislado en 1963. [21]
El SHV-1 comparte el 68 por ciento de sus aminoácidos con el TEM-1 y tiene una estructura general similar. La beta-lactamasa del SHV-1 se encuentra con mayor frecuencia en K. pneumoniae y es responsable de hasta el 20% de la resistencia a la ampicilina mediada por plásmidos en esta especie. Las ESBL de esta familia también presentan cambios de aminoácidos alrededor del sitio activo, más comúnmente en las posiciones 238 o 238 y 240. Se conocen más de 60 variedades de SHV. El SHV-5 y el SHV-12 se encuentran entre los más comunes. [18] Las iniciales significan "variable del reactivo de sulfhidrilo". [22]
Estas enzimas fueron nombradas por su mayor actividad contra cefotaxima que otros sustratos oxiimino-beta-lactámicos (p. ej., ceftazidima , ceftriaxona o cefepima ). En lugar de surgir por mutación, representan ejemplos de adquisición de plásmidos de genes de betalactamasa que normalmente se encuentran en el cromosoma de especies de Kluyvera , un grupo de organismos comensales raramente patógenos. Estas enzimas no están muy relacionadas con las betalactamasas TEM o SHV, ya que muestran solo aproximadamente un 40% de identidad con estas dos betalactamasas comúnmente aisladas. Actualmente se conocen más de 172 [23] enzimas CTX-M. A pesar de su nombre, algunas son más activas en ceftazidima que en cefotaxima . Están ampliamente descritas entre especies de Enterobacteriaceae , principalmente E. coli y K. pneumoniae . Detectadas en la década de 1980, se han extendido desde principios de la década de 2000 y ahora son el tipo de BLEE predominante en el mundo. Generalmente se agrupan en cinco grupos según las homologías de secuenciación: CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 y CTX-M-25. CTX-M-15 (que pertenece al grupo CTX-M-1) es el gen CTX-M más prevalente. [24] Se ha descubierto que un ejemplo de beta-lactamasa CTX-M-15, junto con IS Ecp1 , se ha transpuesto al cromosoma de Klebsiella pneumoniae ATCC BAA-2146. [25] Las iniciales significan "Cefotaxime-Munich". [26]
Las betalactamasas OXA se reconocieron durante mucho tiempo como una variedad de betalactamasa menos común pero también mediada por plásmidos que podía hidrolizar la oxacilina y las penicilinas antiestafilocócicas relacionadas. Estas betalactamasas se diferencian de las enzimas TEM y SHV en que pertenecen a la clase molecular D y al grupo funcional 2d. Las betalactamasas de tipo OXA confieren resistencia a la ampicilina y la cefalotina y se caracterizan por su alta actividad hidrolítica contra la oxacilina y la cloxacilina y el hecho de que son poco inhibidas por el ácido clavulánico . Las sustituciones de aminoácidos en las enzimas OXA también pueden dar el fenotipo ESBL. Mientras que la mayoría de las ESBL se han encontrado en E. coli , K. pneumoniae y otras Enterobacteriaceae , las ESBL de tipo OXA se han encontrado principalmente en P. aeruginosa . Las BLEE de tipo OXA se han encontrado principalmente en aislamientos de Pseudomonas aeruginosa de Turquía y Francia. La familia de betalactamasas OXA se creó originalmente como un grupo fenotípico en lugar de genotípico para unas pocas betalactamasas que tenían un perfil de hidrólisis específico. Por lo tanto, hay tan solo un 20% de homología de secuencia entre algunos de los miembros de esta familia. Sin embargo, las incorporaciones recientes a esta familia muestran cierto grado de homología con uno o más de los miembros existentes de la familia de betalactamasas OXA. Algunas confieren resistencia predominantemente a la ceftazidima, pero la OXA-17 confiere mayor resistencia a la cefotaxima y la cefepima que a la ceftazidima.
Se han descrito otras ESBL mediadas por plásmidos, como las betalactamasas PER, VEB, GES e IBC, pero son poco comunes y se han encontrado principalmente en P. aeruginosa y en un número limitado de sitios geográficos. PER-1 en aislamientos en Turquía, Francia e Italia; VEB-1 y VEB-2 en cepas del sudeste asiático; y GES-1, GES-2 e IBC-2 en aislamientos de Sudáfrica, Francia y Grecia. PER-1 también es común en especies de Acinetobacter multirresistentes en Corea y Turquía. Algunas de estas enzimas también se encuentran en Enterobacteriaceae, mientras que otras ESBL poco comunes (como BES-1, IBC-1, SFO-1 y TLA-1) se han encontrado solo en Enterobacteriaceae.
Si bien los organismos productores de ESBL se asociaban anteriormente con hospitales y atención institucional, ahora se encuentran cada vez más en la comunidad. E. coli CTX-M-15-positiva es una causa de infecciones urinarias adquiridas en la comunidad en el Reino Unido, [27] y tiende a ser resistente a todos los antibióticos β-lactámicos orales, así como a las quinolonas y sulfonamidas . Las opciones de tratamiento pueden incluir nitrofurantoína , fosfomicina , mecilinam y cloranfenicol . En caso de desesperación, también se pueden utilizar inyecciones de ertapenem o gentamicina una vez al día .
Aunque las β-lactamasas resistentes a inhibidores no son ESBL, a menudo se las menciona junto con ESBL porque también son derivadas de las enzimas clásicas de tipo TEM o SHV. Estas enzimas recibieron en un principio la designación IRT para β-lactamasa TEM resistente a inhibidores; sin embargo, todas han sido renombradas posteriormente con designaciones numéricas TEM. Existen al menos 19 β-lactamasas TEM resistentes a inhibidores distintas. Se han encontrado β-lactamasas TEM resistentes a inhibidores principalmente en aislados clínicos de E. coli , pero también en algunas cepas de K. pneumoniae , Klebsiella oxytoca , P. mirabilis y Citrobacter freundii . Aunque las variantes de TEM resistentes a inhibidores son resistentes a la inhibición por ácido clavulánico y sulbactam , mostrando así resistencia clínica a las combinaciones de inhibidores de beta-lactama-lactamasa de amoxicilina - clavulanato ( co-amoxiclav ), ticarcilina - clavulanato ( co-ticarclav ) y ampicilina/sulbactam , normalmente siguen siendo susceptibles a la inhibición por tazobactam y posteriormente a la combinación de piperacilina/tazobactam , [ cita requerida ] aunque se ha descrito resistencia. Esta ya no es una epidemiología principalmente europea, se encuentra a menudo en partes del norte de América y debe analizarse en caso de ITU complejas. [19]
Las β-lactamasas de tipo AmpC se aíslan comúnmente de bacterias gramnegativas resistentes a las cefalosporinas de espectro extendido. Las β-lactamasas AmpC (también denominadas clase C o grupo 1) suelen estar codificadas en el cromosoma de muchas bacterias gramnegativas, incluidas las especies Citrobacter , Serratia y Enterobacter, donde su expresión suele ser inducible ; también puede aparecer en Escherichia coli , pero no suele ser inducible, aunque puede hiperexpresarse. Las β-lactamasas de tipo AmpC también pueden estar presentes en plásmidos. [6] Las β-lactamasas AmpC, a diferencia de las ESBL, hidrolizan cefalosporinas de espectro amplio y extendido (cefamicinas así como oxiimino-β-lactámicos) pero no son inhibidas típicamente por los inhibidores de β-lactamasa ácido clavulánico y tazobactam , mientras que avibactam puede mantener la actividad inhibidora contra esta clase de β-lactamasas. [28] Los organismos de β-lactamasa de tipo AmpC a menudo se agrupan clínicamente a través del acrónimo "SPACE": Serratia , Pseudomonas o Proteus , Acinetobacter , Citrobacter y Enterobacter .
Los carbapenémicos son notoriamente estables a las β-lactamasas AmpC y a las β-lactamasas de espectro extendido. Las carbapenemasas son un grupo diverso de β-lactamasas que son activas no solo contra las oxiiminocefalosporinas y las cefamicinas, sino también contra los carbapenémicos. El aztreonam es estable a las metalo-β-lactamasas, pero muchos productores de IMP y VIM son resistentes debido a otros mecanismos. Anteriormente se creía que las carbapenemasas derivaban solo de las clases A, B y D, pero se ha descrito una carbapenemasa de clase C.
Las carbapenemasas de tipo IMP mediadas por plásmidos (IMP significa activas en imipenem), de las que se conocen actualmente 19 variedades, se establecieron en Japón en la década de 1990 tanto en organismos gramnegativos entéricos como en especies de Pseudomonas y Acinetobacter . Las enzimas IMP se extendieron lentamente a otros países del Lejano Oriente, se informó de su presencia en Europa en 1997 y se han encontrado en Canadá y Brasil.
En 1999 se informó de una segunda familia de carbapenemasas en crecimiento, la familia VIM, que ahora incluye 10 miembros, que tienen una amplia distribución geográfica en Europa, Sudamérica y el Lejano Oriente y se han encontrado en los Estados Unidos. VIM-1 se descubrió en P. aeruginosa en Italia en 1996; desde entonces, VIM-2, ahora la variante predominante, se encontró repetidamente en Europa y el Lejano Oriente; VIM-3 y -4 son variantes menores de VIM-2 y -1, respectivamente.
La diversidad de secuencias de aminoácidos es de hasta un 10% en la familia VIM, un 15% en la familia IMP y un 70% entre VIM e IMP. Sin embargo, las enzimas de ambas familias son similares. Ambas están asociadas a integrones, a veces dentro de plásmidos. Ambas hidrolizan todas las β-lactámicas excepto las monobactámicas y evaden todos los inhibidores de β-lactámicas. Las enzimas VIM se encuentran entre las MBL más ampliamente distribuidas, habiéndose informado de más de 40 variantes de VIM. Los estudios bioquímicos y biofísicos revelaron que las variantes de VIM tienen solo pequeñas variaciones en sus parámetros cinéticos, pero diferencias sustanciales en sus estabilidades térmicas y perfiles de inhibición. [29]
El grupo OXA de β-lactamasas se presenta principalmente en especies de Acinetobacter y se divide en dos grupos. Las carbapenemasas OXA hidrolizan los carbapenémicos muy lentamente in vitro , y las altas CMI observadas para algunos hospedadores de Acinetobacter (>64 mg/L) pueden reflejar mecanismos secundarios. A veces se aumentan en aislados clínicos por mecanismos de resistencia adicionales, como la impermeabilidad o el eflujo. Las carbapenemasas OXA también tienden a tener una eficiencia hidrolítica reducida hacia las penicilinas y las cefalosporinas. [30]
Algunas enzimas de clase A, las más conocidas son las enzimas KPC mediadas por plásmidos, que también son carbapenemasas eficaces. Se conocen diez variantes, KPC-2 a KPC-11, y se distinguen por una o dos sustituciones de aminoácidos (KPC-1 se volvió a secuenciar en 2008 y se descubrió que era 100% homóloga a las secuencias publicadas de KPC-2). KPC-1 se encontró en Carolina del Norte, KPC-2 en Baltimore y KPC-3 en Nueva York. Tienen solo un 45% de homología con las enzimas SME y NMC/IMI y, a diferencia de ellas, pueden ser codificadas por plásmidos autotransmisibles.
A partir de febrero de 2009 [actualizar], la carbapenemasa de clase A de Klebsiella pneumoniae ( KPC ) ha sido la carbapenemasa más común a nivel mundial y se detectó por primera vez en 1996 en Carolina del Norte , EE. UU. [31] Una publicación de 2010 indicó que las Enterobacteriaceae productoras de KPC se estaban volviendo comunes en los Estados Unidos. [32]
La primera carbapenemasa de clase C se describió en 2006 y se aisló de una cepa virulenta de Enterobacter aerogenes . [33] Se transporta en un plásmido, pYMG-1, y por lo tanto es transmisible a otras cepas bacterianas. [34]
En general, estos tienen poca importancia clínica.
CcrA (CfiA). Su gen se encuentra en aproximadamente el 1-3% de los aislados de B. fragilis , pero menos producen la enzima ya que su expresión exige la migración adecuada de una secuencia de inserción. CcrA se conocía antes de la introducción del imipenem y los productores han mostrado un pequeño aumento posterior.
Este gen, descrito originalmente en Nueva Delhi en 2009, está ahora muy extendido en Escherichia coli y Klebsiella pneumoniae de la India y Pakistán. A mediados de 2010, las bacterias portadoras de NDM-1 se han introducido en otros países (incluidos Estados Unidos y el Reino Unido), probablemente debido a la gran cantidad de turistas que viajan por el mundo, quienes pueden haber recogido la cepa del medio ambiente, ya que se han encontrado cepas que contienen el gen NDM-1 en muestras ambientales en la India. [35] NDM tiene varias variantes que comparten diferentes propiedades. [29]
En general, se sospecha que un aislado es productor de ESBL cuando muestra susceptibilidad in vitro a las cefamicinas ( cefoxitina , cefotetan ) pero resistencia a las cefalosporinas de tercera generación y al aztreonam . Además, se debe sospechar de estas cepas cuando el tratamiento con estos agentes para infecciones gramnegativas falla a pesar de la susceptibilidad in vitro informada . Una vez que se detecta una cepa productora de ESBL, el laboratorio debe informarla como "resistente" a todas las penicilinas, cefalosporinas y aztreonam, incluso si se prueba (in vitro) como susceptible. [ cita requerida ] La resistencia asociada a aminoglucósidos y trimetoprima - sulfametoxazol , así como la alta frecuencia de coexistencia de resistencia a fluoroquinolonas , crea problemas. Los inhibidores de beta-lactamasa como clavulanato , sulbactam y tazobactam inhiben in vitro la mayoría de las ESBL, pero no se puede confiar en la eficacia clínica de las combinaciones de beta-lactámicos/inhibidores de beta-lactamasa de manera constante para el tratamiento. Las cefamicinas ( cefoxitina y cefotetán ) no son hidrolizadas por la mayoría de las ESBL, pero sí lo son por la β-lactamasa de tipo AmpC asociada. Además, las combinaciones de β-lactámicos/inhibidores de β-lactamasa pueden no ser efectivas contra los organismos que producen β-lactamasa de tipo AmpC. A veces, estas cepas disminuyen la expresión de las proteínas de la membrana externa, volviéndolas resistentes a las cefamicinas. Los estudios in vivo han arrojado resultados mixtos contra K. pneumoniae productora de ESBL . ( La cefepima , una cefalosporina de cuarta generación, ha demostrado estabilidad in vitro en presencia de muchas cepas ESBL/AmpC). Actualmente, los carbapenémicos se consideran, en general, el agente preferido para el tratamiento de infecciones debidas a organismos productores de ESBL. Los carbapenémicos son resistentes a la hidrólisis mediada por ESBL y exhiben una excelente actividad in vitro contra cepas de Enterobacteriaceae que expresan ESBL. [ cita requerida ]
Las cepas que producen únicamente ESBL son susceptibles a las cefamicinas y carbapenémicos in vitro y muestran poco o ningún efecto de inóculo con estos agentes.
En los organismos productores de ESBL de tipo TEM y SHV , es común una aparente sensibilidad in vitro a la cefepima y a la piperacilina/tazobactam , pero ambos fármacos muestran un efecto de inóculo, con una susceptibilidad disminuida a medida que el tamaño del inóculo aumenta de 105 a 107 organismos .
Las cepas con algunas ESBL de tipo CTX-M y de tipo OXA son resistentes a la cefepima en las pruebas, a pesar del uso de un inóculo estándar.
Aunque las variantes de TEM resistentes a los inhibidores son resistentes a la inhibición por ácido clavulánico y sulbactam , mostrando así resistencia clínica a las combinaciones de beta-lactámicos e inhibidores de beta lactamasa de amoxicilina - clavulanato ( Co-amoxiclav ), ticarcilina - clavulanato y ampicilina/sulbactam , siguen siendo susceptibles a la inhibición por tazobactam y posteriormente a la combinación de piperacilina/tazobactam .
Las cepas productoras de AmpC suelen ser resistentes a las oximino-beta lactamas y a las cefamicinas y son susceptibles a los carbapenémicos ; sin embargo, la expresión disminuida de porinas puede hacer que una cepa de este tipo también sea resistente a los carbapenémicos.
Las cepas con carbapenemasas de tipo IMP, VIM y OXA suelen seguir siendo susceptibles. La resistencia a los antibióticos no betalactámicos es común en las cepas que producen cualquiera de estas enzimas, de modo que las opciones alternativas para la terapia no betalactámica deben determinarse mediante pruebas de sensibilidad directa. La resistencia a las fluoroquinolonas y los aminoglucósidos es especialmente alta.
En el caso de infecciones causadas por especies de Escherichia coli o Klebsiella productoras de BLEE , el tratamiento con imipenem o meropenem se ha asociado con los mejores resultados en términos de supervivencia y eliminación bacteriológica. La cefepima y la piperacilina/tazobactam han tenido menos éxito. La ceftriaxona , la cefotaxima y la ceftazidima han fracasado incluso con mayor frecuencia, a pesar de la susceptibilidad del organismo al antibiótico in vitro . Varios informes han documentado el fracaso de la terapia con cefamicina como resultado de la resistencia debido a la pérdida de porinas. Algunos pacientes han respondido a la terapia con aminoglucósidos o quinolonas , pero, en una comparación reciente de ciprofloxacino e imipenem para la bacteriemia que involucra a una K. pneumoniae productora de BLEE , el imipenem produjo el mejor resultado.
Se han realizado pocos estudios clínicos para definir la terapia óptima para las infecciones causadas por cepas de Pseudomonas aeruginosa productoras de ESBL .
En 1957, en medio de la preocupación por las reacciones alérgicas a los antibióticos que contenían penicilina, se vendió una beta-lactamasa como antídoto bajo la marca neutrapen. [36] Se teorizó que la descomposición de la penicilina por la enzima trataría la reacción alérgica. [37] Si bien no fue útil en el shock anafiláctico agudo, mostró resultados positivos en casos de urticaria y dolor en las articulaciones que se sospechaba que eran causados por alergia a la penicilina. [38] [39] Se propuso su uso en casos pediátricos en los que se descubrió alergia a la penicilina tras la administración de la vacuna contra la polio, que utilizaba penicilina como conservante. [40] Sin embargo, algunos pacientes desarrollaron alergias al neutrapen. [41] [42] El Hospital de Albany lo eliminó de su formulario en 1960, solo dos años después de agregarlo, citando la falta de uso. [43] Algunos investigadores continuaron utilizándolo en experimentos sobre resistencia a la penicilina hasta 1972. [44] Fue retirado voluntariamente del mercado estadounidense por 3M Pharmaceuticals en 1997. [45]
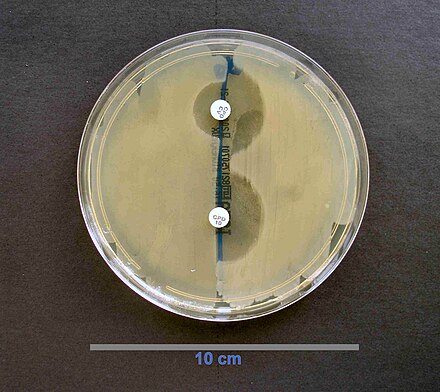
La actividad enzimática de la betalactamasa se puede detectar utilizando nitrocefina , un sustrato de cefalosporina cromogénico que cambia de color de amarillo a rojo tras la hidrólisis mediada por betalactamasa. [46]
La detección de beta lactamasa de espectro extendido (BLEE) se puede realizar mediante difusión en disco. Se utilizan discos de cefpodoxima, ceftazidima, aztreonam, cefotaxima y/o ceftriaxona. [47]
Las beta-lactamasas son enzimas bacterianas antiguas. Las metalo-β-lactamasas ("clase B") son todas estructuralmente similares a la ARNasa Z y pueden haber evolucionado a partir de ella. De las tres subclases B1, B2 y B3, se teoriza que B1 y B2 evolucionaron hace aproximadamente mil millones de años , mientras que B3 parece haber surgido de forma independiente, posiblemente antes de la divergencia de las eubacterias grampositivas y gramnegativas hace aproximadamente dos mil millones de años. [48] PNGM-1 (metalo-β-lactamasa-1 de Papúa Nueva Guinea) tiene actividades tanto de metalo-β-lactamasa (MBL) como de ARNt Z, lo que sugiere que se piensa que PNGM-1 evolucionó a partir de una ARNt Z, y que la actividad de MBL B3 de PNGM-1 es una actividad promiscua y se piensa que las MBL de la subclase B3 evolucionaron a través de la actividad de PNGM-1. [49] Las subclases B1 y B3 se han subdividido aún más. [50]
Las betalactamasas de serina (clases A, C y D) parecen haber evolucionado a partir de las DD -transpeptidasas , que son proteínas que se unen a la penicilina implicadas en la biosíntesis de la pared celular y, como tales, son uno de los principales objetivos de los antibióticos betalactámicos. [51] Estas tres clases muestran una similitud de secuencia indetectable entre sí, pero aún pueden compararse utilizando homología estructural. Los grupos A y D son taxones hermanos y el grupo C divergió antes que A y D. [52] Estas enzimas basadas en serina, como las betalactamasas del grupo B, son de origen antiguo y se teoriza que evolucionaron hace unos dos mil millones de años. [53]
Se cree que en particular el grupo OXA (en la clase D) evolucionó en los cromosomas y se trasladó a los plásmidos en al menos dos ocasiones distintas. [54]
La "β" ( beta ) se refiere a la posición del nitrógeno en el segundo carbono del anillo. La lactama es una mezcla de lactona (del latín lactis , leche , ya que el ácido láctico se aisló de la leche agria) y amida . El sufijo -asa , que indica una enzima, se deriva de diastasa (del griego diastasis , "separación"), la primera enzima descubierta en 1833 por Payen y Persoz. [55]