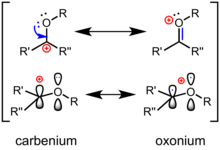
Un ion oxocarbenio (o ion oxacarbenio ) es una especie química caracterizada por un carbono sp2-hibridado central , un sustituyente de oxígeno y una carga positiva general que está deslocalizada entre los átomos de carbono y oxígeno centrales. [1] Un ion oxocarbenio está representado por dos estructuras de resonancia limitantes, una en forma de ion carbenio con la carga positiva en el carbono y la otra en forma de una especie de oxonio con la carga formal en el oxígeno. Como híbrido de resonancia, la estructura verdadera se encuentra entre las dos. En comparación con los compuestos carbonílicos neutros como las cetonas o los ésteres, la forma de ion carbenio es un contribuyente mayor a la estructura. Son intermediarios reactivos comunes en la hidrólisis de enlaces glucosídicos y son una estrategia comúnmente utilizada para la glicosilación química . Desde entonces, estos iones se han propuesto como intermediarios reactivos en una amplia gama de transformaciones químicas y se han utilizado en la síntesis total de varios productos naturales. Además, aparecen comúnmente en mecanismos de biosíntesis e hidrólisis de carbohidratos catalizada por enzimas en la naturaleza. Las antocianinas son colorantes naturales de flavilio , que son compuestos de oxocarbenio estabilizados. Las antocianinas son responsables de los colores de una amplia variedad de flores comunes como los pensamientos y plantas comestibles como la berenjena y el arándano .
La mejor estructura de Lewis para un ion oxocarbenio contiene un doble enlace oxígeno-carbono , con el átomo de oxígeno unido a un grupo adicional y, en consecuencia, adquiriendo una carga positiva formal. En el lenguaje de las estructuras canónicas (o "resonancia"), la polarización del enlace π se describe mediante una forma de resonancia carbocatiónica secundaria, con una carga positiva formal en el carbono (ver arriba). En términos de la teoría de orbitales moleculares de frontera , el orbital molecular desocupado más bajo (LUMO) del ion oxocarbenio es un orbital π* que tiene el lóbulo grande en el átomo de carbono; el oxígeno más electronegativo contribuye menos al LUMO. En consecuencia, en caso de un ataque nucleofílico , el carbono es el sitio electrofílico . En comparación con una cetona , la polarización de un ion oxocarbenio se acentúa: se parecen más a un carbocatión "verdadero" y son más reactivos hacia los nucleófilos. En las reacciones orgánicas, las cetonas se activan comúnmente mediante la coordinación de un ácido de Lewis o un ácido de Brønsted con el oxígeno para generar un ion oxocarbenio como intermedio.
Numéricamente, una carga parcial típica (derivada de los cálculos de Hartree-Fock) para el carbono carbonílico de una cetona R 2 C=O (como la acetona) es δ+ = 0,51. Con la adición de un hidrógeno ácido al átomo de oxígeno para producir [R 2 C=OH] + , la carga parcial aumenta a δ+ = 0,61. En comparación, los análogos nitrogenados de las cetonas y los iones oxocarbenio, iminas (R 2 C=NR) e iones iminio ([R 2 C=NRH] + ), respectivamente, tienen cargas parciales de δ+ = 0,33 y δ+ = 0,54, respectivamente. Por lo tanto, el orden de la carga parcial positiva en el carbono carbonílico es imina < cetona < iminio < oxocarbenio.

Este es también el orden de electrofilicidad para especies que contienen enlaces C=X (X = O, NR). Este orden es sintético y explica, por ejemplo, por qué las aminaciones reductoras a menudo se llevan a cabo mejor a pH = 5 a 6 utilizando cianoborohidruro de sodio (Na + [H 3 B(CN)] − ) o triacetoxiborohidruro de sodio (Na + [HB(OAc) 3 ] − ) como reactivo. Al tener un grupo atractor de electrones, el cianoborohidruro de sodio y el triacetoxiborohidruro de sodio son agentes reductores más pobres que el borohidruro de sodio, y su reacción directa con cetonas es generalmente un proceso lento e ineficiente. Sin embargo, el ion iminio (pero no la imina en sí) formado in situ durante una reacción de aminación reductora es un electrófilo más fuerte que el material de partida de la cetona y reaccionará con la fuente de hidruro a una velocidad sintéticamente útil. Es importante destacar que la reacción se lleva a cabo en condiciones ligeramente ácidas que protonan el intermedio imina en un grado significativo, formando el ion iminio, mientras que no es lo suficientemente ácida como para protonar la cetona, que formaría el ion oxocarbenio, aún más electrofílico. Por lo tanto, las condiciones de reacción y el reactivo garantizan que la amina se forme selectivamente a partir de la reducción del iminio, en lugar de la reducción directa del grupo carbonilo (o su forma protonada) para formar un alcohol.
La formación de iones oxocarbenio puede realizarse a través de varias vías diferentes. Lo más común es que el oxígeno de una cetona se una a un ácido de Lewis , que activa la cetona y la convierte en un electrófilo más eficaz. El ácido de Lewis puede ser una amplia gama de moléculas, desde un simple átomo de hidrógeno hasta complejos metálicos. Sin embargo, el resto de este artículo se centrará en los iones de alquilo oxocarbenio, donde el átomo agregado al oxígeno es un carbono. Una forma en que se formará este tipo de ion es la eliminación de un grupo saliente . En la química de los carbohidratos, este grupo saliente suele ser un éter o un éster . Una alternativa a la eliminación es la desprotonación directa de la molécula para formar el ion, sin embargo, esto puede ser difícil y requerir bases fuertes para lograrlo.

La estereoquímica involucrada en las reacciones de los anillos de cinco miembros se puede predecir mediante un modelo de estado de transición de la envoltura. Los nucleófilos prefieren la adición desde el "interior" de la envoltura, o desde la parte superior de la figura de la derecha. La adición "interior" produce una conformación escalonada , en lugar de la conformación eclipsada que resulta de la adición "exterior". [2]


El modelo de estado de transición para un anillo de oxocarbenio de seis miembros fue propuesto anteriormente en 1992 por Woods et al. [3] La estrategia general para determinar la estereoquímica de una adición nucleofílica a un anillo de seis miembros sigue un procedimiento similar al caso del anillo de cinco miembros. La suposición que se hace para este análisis es que el anillo está en la misma conformación que el ciclohexeno , con tres carbonos y el oxígeno en un plano con los otros dos átomos de carbono fruncidos fuera del plano, con uno arriba y otro abajo (ver la figura a la derecha). Con base en los sustituyentes presentes en el anillo, se determina la conformación de energía más baja, teniendo en cuenta los efectos estéricos y estereoelectrónicos (ver la sección a continuación para una discusión de los efectos estereoelectrónicos en anillos de oxocarbenio). Una vez que se establece esta conformación, se puede considerar la adición nucleofílica. La adición procederá a través del estado de transición de silla de baja energía, en lugar del estado de transición de bote giratorio de energía relativamente alta. Un ejemplo de este tipo de reacción se puede ver a continuación. El ejemplo también resalta cómo el efecto estereoelectrónico ejercido por un sustituyente electronegativo invierte la conformación de energía más baja y conduce a una selectividad opuesta. [4]

En un anillo de alqueno que no contiene un átomo de oxígeno, cualquier sustituyente grande prefiere estar en una posición ecuatorial, con el fin de minimizar los efectos estéricos . Se ha observado en anillos que contienen iones de oxocarbenio que los sustituyentes electronegativos prefieren las posiciones axiales o pseudoaxiales. Cuando el átomo electronegativo está en la posición axial, su densidad electrónica puede ser donada a través del espacio al átomo de oxígeno cargado positivamente en el anillo. [5] Esta interacción electrónica estabiliza la conformación axial. Los grupos hidroxilo , los éteres y los halógenos son ejemplos de sustituyentes que exhiben este fenómeno. Los efectos estereoelectrónicos deben tenerse en cuenta al determinar la conformación de energía más baja en el análisis de adición nucleofílica a un ion de oxocarbenio. [4] [6]

En síntesis orgánica, los iones de oxocarbenio de vinilo (estructura a la derecha) se pueden utilizar en una amplia gama de reacciones de cicloadición . Se emplean comúnmente como dienófilos en la reacción de Diels-Alder . A menudo se agrega una cetona que atrae electrones al dienófilo para aumentar la velocidad de la reacción, [7] y estas cetonas a menudo se convierten en iones de oxocarbenio de vinilo durante la reacción [8]. No está claro que necesariamente se formará un ion de oxocarbenio, pero Roush y sus colaboradores demostraron el intermedio de oxocarbenio en la ciclización que se muestra a continuación. Se observaron dos productos en esta reacción, que solo podrían formarse si el anillo de oxocarbenio está presente como intermedio. [9] También se han informado cicloadiciones [4+3], [2+2], [3+2] y [5+2] con intermedios de oxocarbenio. [8]

Los iones oxocarbenio quirales se han utilizado para llevar a cabo reacciones de adición aldólica de acetato altamente diastereoselectivas y enantioselectivas. [10] El ion oxocarbenio se utiliza como electrófilo en la reacción. Cuando el grupo metilo aumenta de tamaño, aumenta la diastereoselectividad.

Los iones de oxocarbenio se han utilizado en síntesis total en varias ocasiones. Se sintetizó una subunidad principal de (+)-clavosolida con una reducción de un anillo de oxocarbenio de seis miembros. Todos los sustituyentes grandes se encontraron en una posición ecuatorial y la transformación pasó por el estado de transición de silla, como se predijo. [11]

Un segundo ejemplo se ve en el paso clave de la síntesis de (−)-neopeltolida, que utiliza otra reducción de anillo de oxocarbenio de seis miembros para una adición de hidruro diastereoselectiva. [12]

En los sistemas biológicos, los iones de oxocarbenio se ven principalmente durante las reacciones de los carbohidratos . Dado que los azúcares están presentes en la estructura de los ácidos nucleicos , con un azúcar ribosa presente en el ARN y una desoxirribosa presente en la estructura del ADN , su química juega un papel importante en una amplia gama de funciones celulares de los ácidos nucleicos. Además de sus funciones en los nucleótidos, los azúcares también se utilizan para los componentes estructurales de los organismos, como moléculas de almacenamiento de energía, moléculas de señalización celular, modificación de proteínas y juegan un papel clave en el sistema inmunológico , la fertilización , la prevención de la patogénesis , la coagulación sanguínea y el desarrollo . [13] La abundancia de la química del azúcar en los procesos biológicos hace que muchos mecanismos de reacción procedan a través de iones de oxocarbenio. En esta sección se describen varias reacciones biológicas importantes que utilizan iones de oxocarbenio.
Los nucleótidos pueden sufrir una ciclización intramolecular catalizada por enzimas para producir varias moléculas biológicas importantes. Estas ciclizaciones suelen realizarse a través de un intermediario oxocarbenio. Un ejemplo de esta reacción se puede ver en la ciclización de la ADP ribosa cíclica , que es una molécula importante para la señalización intracelular del calcio . [14]
Una glicosidasa es una enzima que cataliza la ruptura de un enlace glicosídico para producir dos azúcares más pequeños. Este proceso tiene implicaciones importantes en la utilización de la energía almacenada, como el glucógeno en los animales, así como en la descomposición de la celulosa por parte de los organismos que se alimentan de plantas. En general, los residuos de ácido aspártico o glutámico en el sitio activo de la enzima catalizan la hidrólisis del enlace glicosídico. El mecanismo de estas enzimas implica un intermediario de ion oxocarbenio, del cual se muestra un ejemplo general a continuación. [15]
