En química , principalmente química orgánica y computacional , un efecto estereoelectrónico [1] es un efecto sobre la geometría molecular , la reactividad o las propiedades físicas debido a las relaciones espaciales en la estructura electrónica de las moléculas , en particular la interacción entre orbitales atómicos y/o moleculares . [2] Dicho de otra manera, los efectos estereoelectrónicos también se pueden definir como las restricciones geométricas impuestas al suelo y/o los estados de transición de las moléculas que surgen de consideraciones de superposición orbital. [3] Por lo tanto, un efecto estereoelectrónico explica una propiedad o reactividad molecular particular invocando interacciones estabilizadoras o desestabilizadoras que dependen de las orientaciones relativas de los electrones (enlazantes o no enlazantes) en el espacio. [4]
Los efectos estereoelectrónicos se presentan en otras interacciones bien conocidas. Estos incluyen fenómenos importantes como el efecto anomérico y la hiperconjugación . Es importante señalar que los efectos estereoelectrónicos no deben malinterpretarse como una simple combinación de efectos estéricos y efectos electrónicos .
Fundado en unos pocos principios generales que gobiernan cómo interactúan los orbitales, el efecto estereoelectrónico, junto con el efecto estérico, el efecto inductivo , el efecto disolvente , el efecto mesomérico y la aromaticidad , es un tipo importante de explicación de los patrones observados de selectividad, reactividad y estabilidad. química Inorgánica . A pesar de las premisas relativamente sencillas, los efectos estereoelectrónicos a menudo proporcionan explicaciones para observaciones contraintuitivas o sorprendentes. Como resultado, los factores estereoelectrónicos ahora se consideran y explotan comúnmente en el desarrollo de nuevas metodologías orgánicas y en la síntesis de objetivos complejos. El escrutinio de los efectos estereoelectrónicos también ha entrado en los ámbitos de la bioquímica y la química farmacéutica en los últimos años.
Un efecto estereoelectrónico generalmente implica una interacción donante-aceptor estabilizadora (es decir, enlace lleno-antienlace vacío, 2 electrones y 2 orbitales). El donante suele ser un orbital enlazante o no enlazante superior y el aceptor suele ser un orbital antienlazante bajo, como se muestra en el siguiente esquema. Siempre que sea posible, para favorecer este efecto estereoelectrónico, los orbitales donante-aceptor deben tener (1) una pequeña brecha de energía y (2) estar geométricamente bien dispuestos para la interacción. En particular, esto significa que las formas de los orbitales donante y aceptor (incluida la simetría π o σ y el tamaño de los lóbulos que interactúan) deben coincidir bien para la interacción; una orientación antiperiplanar es especialmente favorable. Algunos autores exigen que los efectos estereoelectrónicos sean estabilizadores. [1] Sin embargo, las interacciones desestabilizadoras donante-donante (es decir, enlace lleno-antienlazante lleno, 4 electrones 2 orbitales) se invocan ocasionalmente y a veces también se denominan efectos estereoelectrónicos, aunque tales efectos son difíciles de distinguir de la repulsión estérica genérica. . [3] [5]
Tomemos como ejemplo el sistema CH 2 X – CH 3 más simple; el orbital donante es el orbital σ (C – H) y el aceptor es σ * (C – X). Al pasar del flúor al cloro y luego al bromo , la electronegatividad del halógeno y el nivel de energía de los orbitales σ*(C–X) disminuyen. [6] En consecuencia, la tendencia general de los aceptores se puede resumir como: π*(C=O)>σ*(C–Hal)>σ*(C–O)>σ*(C–N)>σ*( C – C), σ*(C – H). Para los orbitales donadores, los orbitales no enlazantes, o los pares libres, son generalmente más efectivos que los orbitales enlazantes debido a los altos niveles de energía. Además, a diferencia de los aceptores, los orbitales donantes requieren enlaces menos polarizados. Por lo tanto, las tendencias generales para los orbitales donantes serían: n(N)>n(O)>σ(C–C), σ(C–H)>σ(C–N)>σ(C–O)>σ (C–S)>σ(C–Hal). [5]
El efecto estereoelectrónico puede ser direccional en casos específicos. El radio del azufre es mucho mayor que el radio del carbono y el oxígeno . Por lo tanto, las diferencias en las distancias de los enlaces C-S generan una diferencia mucho amplificada en los dos efectos estereoelectrónicos en el 1,3- ditiano (σ(C-H) → σ*(C-S)) que en el 1,3- dioxano ( σ(C–H) → σ*(C–O)). [6] Las diferencias entre los enlaces C – C y C – S que se muestran a continuación provocan una diferencia significativa en las distancias entre los enlaces C – S y dos enlaces C – H. Cuanto más corta sea la diferencia, mejor será la interacción y más fuerte será el efecto estereoelectrónico. [6]
Si hay un sustituyente electropositivo (por ejemplo, –SiR 3 , –SnR 3 , –HgR, etc.) en la posición β del carbocatión , la carga positiva podría estabilizarse, lo que también se debe en gran medida al efecto estereoelectrónico (ilustrado a continuación usando – SiR3 como ejemplo). La orientación de los dos orbitales que interactúan puede tener un efecto significativo en el efecto de estabilización (σ (C – Si) → orbital p vacío), donde antiperiplanar (180 °) > perpendicular (90 °) > syn (0 °). [7]
Una consecuencia estructural de los sistemas acíclicos debido al efecto estereoelectrónico es el efecto gauche . [8] En 1,2-difluoroetano , a pesar del choque estérico, la conformación preferida es la gauche porque σ(C–H) es un buen donante y σ*(C–F) es un buen aceptor y el efecto estereoelectrónico ( σ(C – H) → σ*(C – F)) requiere que el mínimo de energía sea torpe en lugar de anti. [9]
Este efecto torpe y su impacto en la conformación son importantes en bioquímica. Por ejemplo, en fragmentos de la subunidad HIF-α que contienen ( 2S,4R )-4-hidroxiprolina, la interacción torpe favorece al confórmero que puede unirse al sitio activo de pVHL. [10] pVHL media la degradación proteasomal de HIF1A y con ella la respuesta fisiológica a la hipoxia.
Los efectos estereoelectrónicos pueden tener una influencia significativa en la investigación farmacéutica . En general, la sustitución de hidrógeno por flúor podría considerarse como una forma de ajustar tanto la hidrofobicidad como la estabilidad metabólica de un fármaco candidato. Además, puede tener una profunda influencia en las conformaciones, a menudo debido a efectos estereoelectrónicos, además de los efectos estéricos normales resultantes del mayor tamaño del átomo de flúor. Por ejemplo, las geometrías del estado fundamental del anisol (metoxibenceno) y (trifluorometoxi)benceno difieren dramáticamente. En el anisol , el grupo metilo prefiere ser coplanar con el grupo fenilo , mientras que el (trifluorometoxi)benceno favorece una geometría en la que el ángulo diédrico [C(aril)–C(aril)–O–C(F 3 )] es de alrededor de 90°. °. En otras palabras, el enlace O-CF 3 es perpendicular al plano del grupo fenilo. [11]
Estudios adicionales ilustran que incluso si solo uno o dos átomos de hidrógeno en un grupo metilo son reemplazados por un átomo de flúor, la distorsión en la estructura también puede ser significativa, con el [C(aril)–C(aril)–O–C( H 2 F)] ángulo diédrico en la estructura de energía minimizada es de alrededor de 24° y el ángulo diédrico [C(aril)–C(aril)–O–C(HF 2 )] es de 33°. [11]
Aunque la diferencia de energía entre el anisol coplanar y su isómero es bastante grande, la rotación entre el enlace O-CH 3 se vuelve favorable cuando es necesario alterar las propiedades electrónicas del grupo metoxi en los anillos aromáticos para estabilizar un intermedio inusual o un estado de transición. En la siguiente reacción, la regioselectividad podría racionalizarse como la rotación fuera del plano del enlace O-C que cambia el grupo metoxi de un grupo donante en el plano a un grupo aceptor fuera del plano. [12]
El intermedio de la reacción anterior es el dianión y el efecto estereoelectrónico que estabiliza este intermedio sobre el otro es el hecho de que la carga aniónica en la posición para podría deslocalizarse al átomo de oxígeno mediante interacción orbital: π(benceno) → σ *(O–CH3 ) . [12]
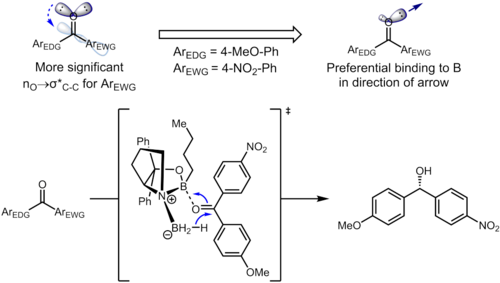
Incluso los sustituyentes remotos en el anillo de benceno pueden afectar la densidad electrónica en el anillo aromático y, a su vez, influir en la selectividad. En la hidrogenación de cetonas utilizando catalizadores CBS , la cetona se coordina con el átomo de boro con el par solitario del átomo de oxígeno. En el siguiente ejemplo, la influencia inductiva de los sustituyentes puede conducir a la diferenciación de los dos pares libres sp 2 en el átomo de oxígeno. [13]
La interacción estereoelectrónica relevante en el material de partida es la interacción n O → σ*(C carbonilo –C arilo ). El sustituyente aceptor de electrones en el anillo de benceno agota la densidad electrónica en el anillo aromático y, por lo tanto, hace que el orbital σ*( carbonilo C –arilo C (nitro) ) sea mejor aceptor que σ*( carbonilo C –arilo C (metoxi) ) . Estas dos interacciones estereoelectrónicas utilizan diferentes pares libres en el átomo de oxígeno (el antiperiplanar del σ* en cuestión para cada uno), lo que lleva a pares libres con diferentes densidades de electrones. En particular, el mayor agotamiento de la densidad electrónica del par solitario antiperiplanar al grupo 4-nitrofenilo conduce a una capacidad debilitada de ese par solitario para coordinarse con el boro. Esto, a su vez, da como resultado que el par antiperiplanar solitario del 4-metoxifenilo se una preferentemente al catalizador, lo que conduce a una selectividad facial bien definida. En condiciones optimizadas, el producto se forma con excelentes niveles de enantioselectividad (95% ee). [13]
El efecto estereoelectrónico influye en la termodinámica del equilibrio. Por ejemplo, el siguiente equilibrio podría lograrse mediante una cascada de reacciones pericíclicas .
A pesar de estructuras muy similares, uno de los dos isómeros se ve fuertemente favorecido sobre el otro debido a un efecto estereoelectrónico. Dado que el orbital σ* CC adyacente al grupo carbonilo aceptor de electrones tiene menor energía y, por lo tanto, es un mejor aceptor que el orbital σ* CC adyacente al metoxi, el isómero en el que el par solitario n O (σ) es capaz de donado a este orbital antienlazante de menor energía se estabilizará (se ilustra la interacción orbital). [14]
A continuación se muestra otro ejemplo de la preferencia en el equilibrio dentro del área de reacción pericíclica. El efecto estereoelectrónico que afecta el equilibrio es la interacción entre los “enlaces banana” deslocalizados y el orbital p vacío del átomo de boro. [15]
En otro caso, el efecto estereoelectrónico puede dar lugar a una mayor contribución de una estructura de resonancia sobre otra, lo que conlleva mayores consecuencias en la reactividad . Para la 1,4- benzoquinona monoxima, existen diferencias significativas en las propiedades físicas y reactividades entre el doble enlace C2-C3 y el doble enlace C5-C6. Por ejemplo, en la RMN 1 H, 3 J 23 es mayor que 3 J 56. [16] El doble enlace C2-C3 también sufre selectivamente una reacción de Diels-Alder con ciclopentadieno , a pesar del mayor impedimento estérico en ese lado de la molécula. [17] Estos datos ilustran una mayor contribución de la estructura de resonancia B sobre la estructura A. Los autores argumentan que la donación de n N al orbital σ* C4-C3 alarga el enlace C4-C3 (C4 es el carbono que lleva el sustituyente nitrógeno), lo que reduce la superposición de pp entre estos dos átomos. Esto a su vez disminuye la importancia relativa de la estructura A que tiene un doble enlace entre C4 y C3. [18]
En las reacciones asimétricas de Diels-Alder, en lugar de utilizar ligandos quirales o auxiliares quirales para diferenciar la selectividad lateral de los dienolfilos, Woodward ha informado desde 1955 de la diferenciación de la selectividad facial de los dienos (especialmente para los derivados de ciclopentadieno ) utilizando efectos estereoelectrónicos. [19] Se ha realizado una investigación sistemática de la selectividad facial utilizando ciclopentadieno sustituido o derivados de permetilciclopentadieno y los resultados se enumeran a continuación. [20]
El efecto estereoelectrónico que afecta el resultado de la selectividad facial del dieno en la reacción de Diels-Alder es la interacción entre σ(C(sp 2 )–CH 3 ) (cuando σ(C(sp 2 )–X) es una mejor aceptor que un donante) o σ(C(sp 2 )–X) (cuando σ(C(sp 2 )–X) es un mejor donante que un aceptor) y el orbital σ* del enlace que se forma entre el dieno y el dienófilo. [20]
Si los dos sustituyentes geminales son anillos aromáticos con sustituyentes diferentes que sintonizan la densidad electrónica, la diferenciación de la selectividad facial también es fácil cuando el dienófilo se acerca al dieno anti al enlace C-C más rico en electrones donde se produce el efecto estereoelectrónico, en este caso. caso, es similar al anterior. [21]
La apertura del anillo de ciclobuteno en condiciones de calentamiento puede tener dos productos: rotación hacia adentro y hacia afuera.
El estado de transición de rotación hacia adentro de la estructura que se muestra a continuación es relativamente favorecido por los sustituyentes R aceptores (por ejemplo, NO 2 ), pero está especialmente desfavorecido por los sustituyentes R donantes (por ejemplo, NMe 2 ). [22]
A veces, los efectos estereoelectrónicos pueden superar un choque estérico extremo. En una reacción similar de apertura del anillo de ciclobuteno, el grupo trimetilsililo , que es muy voluminoso, todavía favorece la rotación hacia adentro. El efecto estereoelectrónico, que es la interacción mostrada arriba cuando el orbital aceptor es el σ*(Si–CH 3 ), parece ser un factor más predominante en la determinación de la selectividad de la reacción contra el impedimento estérico e incluso supera la penalización de la perturbación. sistema de conjugación del producto debido al choque estérico. [23]
Además, los orbitales aceptores no se limitan a los orbitales antienlazantes de los enlaces carbono-heteroátomo ni a los orbitales vacíos; en el siguiente caso, el orbital aceptor es el orbital σ*(B – O). En el estado de transición del anillo de seis miembros, la interacción estereoelectrónica es σ (C – X) → σ * (B – O). [24]
Los eventos de reconocimiento molecular mediados por interacciones orbitales son críticos en varios procesos biológicos, como la catálisis enzimática. [25] Las interacciones estabilizadoras entre proteínas y carbohidratos en proteínas glicosiladas también ejemplifican el papel de los efectos estereoelectrónicos en las biomoléculas. [26]