El 1,4-dioxano ( / d aɪ ˈ ɒ k s eɪ n / ) es un compuesto orgánico heterocíclico , clasificado como un éter . Es un líquido incoloro con un leve olor dulce similar al del éter dietílico . El compuesto a menudo se llama simplemente dioxano porque los otros isómeros de dioxano ( 1,2- y 1,3- ) rara vez se encuentran.
El dioxano se utiliza como disolvente para diversas aplicaciones prácticas, así como en el laboratorio, y también como estabilizador para el transporte de hidrocarburos clorados en contenedores de aluminio. [3]
El dioxano se produce mediante la deshidratación catalizada por ácido del dietilenglicol , que a su vez se obtiene de la hidrólisis del óxido de etileno .
En 1985, la capacidad de producción mundial de dioxano estaba entre 11.000 y 14.000 toneladas. [4] En 1990, el volumen total de producción estadounidense de dioxano estuvo entre 5.250 y 9.150 toneladas. [5]
La molécula de dioxano es centrosimétrica, es decir que adopta una conformación en silla , típica de los parientes del ciclohexano . Sin embargo, la molécula es conformacionalmente flexible y la conformación de barco se adopta fácilmente, por ejemplo en la quelación de cationes metálicos. El dioxano se parece a un éter corona más pequeño con sólo dos unidades de etilenoxilo.
En la década de 1980, la mayor parte del dioxano producido se utilizaba como estabilizador del 1,1,1-tricloroetano para su almacenamiento y transporte en contenedores de aluminio . Normalmente el aluminio está protegido por una capa de óxido pasivante, pero cuando estas capas se alteran, el aluminio metálico reacciona con tricloroetano para dar tricloruro de aluminio , que a su vez cataliza la deshidrohalogenación del tricloroetano restante a cloruro de vinilideno y cloruro de hidrógeno . El dioxano "envenena" esta reacción de catálisis formando un aducto con tricloruro de aluminio. [4]
El dioxano se utiliza en una variedad de aplicaciones como disolvente aprótico versátil , por ejemplo, para tintas, adhesivos y ésteres de celulosa. En algunos procesos sustituye al tetrahidrofurano (THF) debido a su menor toxicidad y su mayor punto de ebullición (101 °C, frente a 66 °C del THF). [6]
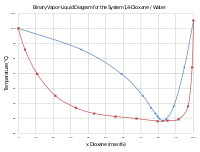
Mientras que el éter dietílico es bastante insoluble en agua, el dioxano es miscible y, de hecho, higroscópico . A presión estándar, la mezcla de agua y dioxano en una proporción de 17,9:82,1 en masa es un azeótropo positivo que hierve a 87,6 C. [7]
Los átomos de oxígeno son débilmente básicos de Lewis . Forma aductos con una variedad de ácidos de Lewis. Se clasifica como base dura y sus parámetros base en el modelo ECW son E B =1,86 y C B = 1,29.
El dioxano produce polímeros de coordinación uniendo centros metálicos. [8] De esta manera, se utiliza para impulsar el equilibrio de Schlenk , permitiendo la síntesis de compuestos de dialquilmagnesio. [4] El dimetilmagnesio se prepara de esta manera: [9] [10]
El dioxano se utiliza como estándar interno para la espectroscopia de resonancia magnética nuclear en óxido de deuterio . [11]
El dioxano tiene una LD 50 de 5170 mg/kg en ratas. [4] Es irritante para los ojos y el tracto respiratorio. La exposición puede causar daños al sistema nervioso central, al hígado y a los riñones. [12] En un estudio de mortalidad de 1978 realizado en trabajadores expuestos al 1,4-dioxano, el número observado de muertes por cáncer no fue significativamente diferente del número esperado. [13] El Dioxano está clasificado por el Programa Nacional de Toxicología como "razonablemente previsto que sea un carcinógeno humano". [14] También está clasificado por la IARC como carcinógeno del Grupo 2B : posiblemente cancerígeno para los seres humanos porque es un carcinógeno conocido en otros animales. [15] La Agencia de Protección Ambiental de los Estados Unidos clasifica al dioxano como un probable carcinógeno humano (habiendo observado una mayor incidencia de cáncer en estudios controlados con animales, pero no en estudios epidemiológicos de trabajadores que usan el compuesto) y un irritante conocido (sin efecto negativo). nivel de efectos adversos observados de 400 miligramos por metro cúbico) en concentraciones significativamente más altas que las encontradas en productos comerciales. [16] Según la Proposición 65 de California , el dioxano está clasificado en el estado estadounidense de California como causante de cáncer. [17] Los estudios en animales en ratas sugieren que el mayor riesgo para la salud está asociado con la inhalación de vapores en forma pura. [18] [19] [20] El estado de Nueva York ha adoptado un estándar de agua potable, el primero en el país, para 1,4-dioxano y ha establecido el nivel máximo de contaminante de 1 parte por mil millones. [21]
Tiende a concentrarse en el agua y tiene poca afinidad por el suelo. Es resistente a la degradación abiótica en el medio ambiente y anteriormente se pensaba que también resistía la biodegradación . Sin embargo, estudios más recientes desde la década de 2000 han descubierto que se puede biodegradar a través de varias vías, lo que sugiere que la biorremediación se puede utilizar para tratar el agua contaminada con 1,4-dioxano. [22] [23]
Como algunos otros éteres, el dioxano se combina con el oxígeno atmosférico tras una exposición prolongada al aire para formar peróxidos potencialmente explosivos . La destilación de estas mezclas es peligrosa. El almacenamiento sobre sodio metálico podría limitar el riesgo de acumulación de peróxido.
El dioxano ha afectado el suministro de aguas subterráneas en varias zonas. Se ha detectado dioxano en niveles de 1 μg/L (~1 ppb) en muchos lugares de EE. UU. [5] En el estado estadounidense de New Hampshire, se encontró en 67 sitios en 2010, con concentraciones que oscilaban entre 2 ppb y más de 11.000 ppb. Treinta de estos sitios son vertederos de residuos sólidos, la mayoría de los cuales han estado cerrados durante años. En 2019, el Southern Environmental Law Center demandó con éxito al tratamiento de aguas residuales de Greensboro, Carolina del Norte, después de que se encontrara 1,4-dioxano 20 veces por encima de los niveles seguros de la EPA en el río Haw. [24]
Como subproducto del proceso de etoxilación , una ruta hacia algunos ingredientes que se encuentran en productos de limpieza e hidratación, el dioxano puede contaminar cosméticos y productos de cuidado personal como desodorantes, perfumes, champús, pastas de dientes y enjuagues bucales. [25] [26] El proceso de etoxilación hace que los agentes de limpieza, como el laureth sulfato de sodio y el laureth sulfato de amonio, sean menos abrasivos y ofrezcan características de formación de espuma mejoradas. El 1,4-dioxano se encuentra en pequeñas cantidades en algunos cosméticos, una sustancia aún no regulada que se utiliza en cosméticos tanto en China como en los EE. UU. [27] La investigación ha encontrado el químico en ingredientes crudos etoxilados y en productos cosméticos disponibles en el mercado. El Grupo de Trabajo Ambiental (EWG) encontró que el 97% de los alisadores para el cabello, el 57% de los jabones para bebés y el 22 por ciento de todos los productos en Skin Deep, su base de datos de productos cosméticos, están contaminados con 1,4-dioxano. [28]
Desde 1979, la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) ha realizado pruebas en materias primas cosméticas y productos terminados para determinar los niveles de 1,4-dioxano. [29] El 1,4-dioxano estaba presente en ingredientes crudos etoxilados en niveles de hasta 1410 ppm (~0,14% en peso) y en niveles de hasta 279 ppm (~0,03% en peso) en productos cosméticos disponibles en el mercado. [29] Los niveles de 1,4-dioxano que exceden las 85 ppm (~0,01% en peso) en los champús para niños indican que se justifica una estrecha vigilancia de las materias primas y los productos terminados. [29] Si bien la FDA alienta a los fabricantes a eliminar el 1,4-dioxano, la ley federal no lo exige. [30]
El 9 de diciembre de 2019, Nueva York aprobó un proyecto de ley para prohibir la venta de cosméticos con más de 10 ppm de 1,4-dioxano a partir de finales de 2022. La ley también impedirá la venta de productos de limpieza doméstica y de cuidado personal que contengan más de 2 ppm de 1,4-dioxano a finales de 2022. [31]
1,4-Dioxano CAS#123-91-1 (Listado el 1 de enero de 1988)