La neurofarmacología es el estudio de cómo las drogas afectan la función del sistema nervioso y los mecanismos neuronales a través de los cuales influyen en el comportamiento. [1] Hay dos ramas principales de la neurofarmacología: conductual y molecular. La neurofarmacología conductual se centra en el estudio de cómo las drogas afectan el comportamiento humano ( neuropsicofarmacología ), incluido el estudio de cómo la dependencia y la adicción a las drogas afectan el cerebro humano . [2] La neurofarmacología molecular implica el estudio de las neuronas y sus interacciones neuroquímicas , con el objetivo general de desarrollar fármacos que tengan efectos beneficiosos sobre la función neurológica. Ambos campos están estrechamente relacionados, ya que ambos se ocupan de las interacciones de neurotransmisores , neuropéptidos , neurohormonas , neuromoduladores , enzimas , segundos mensajeros , cotransportadores , canales iónicos y proteínas receptoras en los sistemas nerviosos central y periférico . Al estudiar estas interacciones, los investigadores están desarrollando medicamentos para tratar muchos trastornos neurológicos diferentes, incluido el dolor , enfermedades neurodegenerativas como la enfermedad de Parkinson y la enfermedad de Alzheimer , trastornos psicológicos, adicciones y muchas otras.
La neurofarmacología no apareció en el campo científico hasta que, a principios del siglo XX, los científicos pudieron lograr una comprensión básica del sistema nervioso y cómo los nervios se comunican entre sí. Antes de este descubrimiento, se habían encontrado fármacos que demostraban algún tipo de influencia sobre el sistema nervioso. En la década de 1930, los científicos franceses comenzaron a trabajar con un compuesto llamado fenotiazina con la esperanza de sintetizar un fármaco que pudiera combatir la malaria. Aunque este fármaco mostró muy pocas esperanzas de uso contra personas infectadas con malaria, se descubrió que tenía efectos sedantes junto con lo que parecían ser efectos beneficiosos para los pacientes con enfermedad de Parkinson. Este método de caja negra, en el que un investigador administraba un fármaco y examinaba la respuesta sin saber cómo relacionar la acción del fármaco con la respuesta del paciente, fue el enfoque principal en este campo, hasta que, a finales de los años cuarenta y principios de los cincuenta, los científicos pudieron identificar neurotransmisores específicos, como la noradrenalina (implicada en la constricción de los vasos sanguíneos y el aumento de la frecuencia cardíaca y la presión arterial), la dopamina (la sustancia química cuya escasez está implicada en la enfermedad de Parkinson) y la serotonina (que pronto se reconocerá como profundamente relacionada con la depresión). [ cita requerida ] ). En la década de 1950, los científicos también lograron medir mejor los niveles de neuroquímicos específicos en el cuerpo y así correlacionar estos niveles con el comportamiento. [3] La invención de la pinza de voltaje en 1949 permitió el estudio de los canales iónicos y el potencial de acción de los nervios . Estos dos importantes acontecimientos históricos de la neurofarmacología permitieron a los científicos no sólo estudiar cómo se transfiere la información de una neurona a otra, sino también cómo una neurona procesa esta información dentro de sí misma. [ cita necesaria ]
La neurofarmacología es una región de la ciencia muy amplia que abarca muchos aspectos del sistema nervioso, desde la manipulación de una sola neurona hasta áreas enteras del cerebro, la médula espinal y los nervios periféricos. Para comprender mejor la base detrás del desarrollo de fármacos , primero hay que comprender cómo se comunican las neuronas entre sí. [ cita necesaria ]

Para comprender los posibles avances en medicina que puede aportar la neurofarmacología, es importante comprender cómo el comportamiento humano y los procesos de pensamiento se transfieren de una neurona a otra y cómo los medicamentos pueden alterar las bases químicas de estos procesos. [ cita necesaria ]
Las neuronas se conocen como células excitables porque en su membrana superficial hay una gran cantidad de proteínas conocidas como canales iónicos que permiten que pequeñas partículas cargadas entren y salgan de la célula. La estructura de la neurona permite que sus dendritas reciban información química , la propague a través del pericarión (cuerpo celular) y baje por su axón , y finalmente pase a otras neuronas a través de su terminal axónica . Estos canales iónicos dependientes de voltaje permiten una rápida despolarización en toda la célula. Esta despolarización, si alcanza un determinado umbral, provocará un potencial de acción . Una vez que el potencial de acción llega al terminal del axón, provocará una entrada de iones de calcio al interior de la célula. Luego, los iones de calcio provocarán que las vesículas, pequeños paquetes llenos de neurotransmisores , se unan a la membrana celular y liberen su contenido en la sinapsis. Esta célula se conoce como neurona presináptica y la célula que interactúa con los neurotransmisores liberados se conoce como neurona postsináptica. Una vez que el neurotransmisor se libera en la sinapsis, puede unirse a los receptores de la célula postsináptica, la célula presináptica puede recaptarlo y guardarlo para su transmisión posterior, o puede ser descompuesto por enzimas en la sinapsis. específico de ese determinado neurotransmisor. Estas tres acciones diferentes son áreas importantes donde la acción de los fármacos puede afectar la comunicación entre las neuronas. [3]
Hay dos tipos de receptores con los que interactúan los neurotransmisores en una neurona postsináptica. Los primeros tipos de receptores son los canales iónicos activados por ligando o LGIC. Los receptores LGIC son los tipos más rápidos de transducción de una señal química a una señal eléctrica. Una vez que el neurotransmisor se une al receptor, provocará un cambio conformacional que permitirá que los iones fluyan directamente hacia la célula. Los segundos tipos se conocen como receptores acoplados a proteína G o GPCR. Estos son mucho más lentos que los LGIC debido a un aumento en la cantidad de reacciones bioquímicas que deben tener lugar intracelularmente. Una vez que el neurotransmisor se une a la proteína GPCR, provoca una cascada de interacciones intracelulares que pueden conducir a muchos tipos diferentes de cambios en la bioquímica, fisiología y expresión genética celular. Las interacciones neurotransmisor/receptor en el campo de la neurofarmacología son extremadamente importantes porque muchos fármacos que se desarrollan hoy en día tienen que ver con interrumpir este proceso de unión. [4]
La neurofarmacología molecular implica el estudio de las neuronas y sus interacciones neuroquímicas y de los receptores de las neuronas, con el objetivo de desarrollar nuevos fármacos que traten trastornos neurológicos como el dolor, las enfermedades neurodegenerativas y los trastornos psicológicos (también conocido en este caso como neuropsicofarmacología ). Hay algunas palabras técnicas que deben definirse al relacionar la neurotransmisión con la acción del receptor: [ cita necesaria ]
Las siguientes interacciones neurotransmisor/receptor pueden verse afectadas por compuestos sintéticos que actúan como uno de los tres anteriores. Los canales iónicos de sodio/potasio también pueden manipularse a lo largo de una neurona para inducir efectos inhibidores de los potenciales de acción. [ cita necesaria ]
El neurotransmisor GABA media la rápida inhibición sináptica en el sistema nervioso central. Cuando el GABA se libera de su célula presináptica, se unirá a un receptor (probablemente el receptor GABA A ) que hace que la célula postsináptica se hiperpolarice (se mantenga por debajo de su umbral de potencial de acción). Esto contrarrestará el efecto de cualquier manipulación excitadora de otras interacciones neurotransmisor/receptor. [ cita necesaria ]
Este receptor GABA A contiene muchos sitios de unión que permiten cambios conformacionales y son el objetivo principal para el desarrollo de fármacos. El más común de estos sitios de unión, la benzodiazepina, permite efectos tanto agonistas como antagonistas sobre el receptor. Un fármaco común, el diazepam , actúa como potenciador alostérico en este sitio de unión. [5] Otro receptor de GABA, conocido como GABA B , puede potenciarse mediante una molécula llamada baclofeno. Esta molécula actúa como agonista, activando así el receptor, y se sabe que ayuda a controlar y disminuir el movimiento espástico. [ cita necesaria ]
El neurotransmisor dopamina media la transmisión sináptica uniéndose a cinco GPCR específicos. Estas cinco proteínas receptoras se separan en dos clases dependiendo de si la respuesta provoca una respuesta excitatoria o inhibidora en la célula postsináptica. Existen muchos tipos de drogas, legales e ilegales, que afectan la dopamina y sus interacciones en el cerebro. En la enfermedad de Parkinson, una enfermedad que disminuye la cantidad de dopamina en el cerebro, se administra al paciente el precursor de la dopamina, Levodopa, debido a que la dopamina no puede cruzar la barrera hematoencefálica y la L-dopa sí. Algunos agonistas de la dopamina también se administran a pacientes de Parkinson que padecen un trastorno conocido como síndrome de piernas inquietas o SPI. Algunos ejemplos de estos son el ropinirol y el pramipexol . [6]
Los trastornos psicológicos como el trastorno por déficit de atención con hiperactividad (TDAH) se pueden tratar con fármacos como el metilfenidato (también conocido como Ritalin ), que bloquea la recaptación de dopamina por las células presinápticas, proporcionando así un aumento de la dopamina que queda en el brecha sináptica. Este aumento de dopamina sináptica aumentará la unión a los receptores de la célula postsináptica. Este mismo mecanismo también lo utilizan otras drogas ilegales y estimulantes más potentes como la cocaína .
El neurotransmisor serotonina tiene la capacidad de mediar en la transmisión sináptica a través de receptores GPCR o LGIC. Los efectos postsinápticos excitadores o inhibidores de la serotonina están determinados por el tipo de receptor expresado en una región determinada del cerebro. Los fármacos más populares y utilizados para la regulación de la serotonina durante la depresión se conocen como ISRS o inhibidores selectivos de la recaptación de serotonina . Estos medicamentos inhiben el transporte de serotonina de regreso a la neurona presináptica, dejando más serotonina en la brecha sináptica. [ cita necesaria ]
Antes del descubrimiento de los ISRS, también existían fármacos que inhibían la enzima que descompone la serotonina. Los IMAO o inhibidores de la monoaminooxidasa aumentaron la cantidad de serotonina en la sinapsis, pero tuvieron muchos efectos secundarios, como migrañas intensas y presión arterial alta. Esto finalmente se relacionó con las drogas que interactúan con una sustancia química común conocida como tiramina que se encuentra en muchos tipos de alimentos. [7]
Los canales iónicos ubicados en la membrana superficial de la neurona permiten la entrada de iones de sodio y el movimiento hacia afuera de iones de potasio durante un potencial de acción. El bloqueo selectivo de estos canales iónicos disminuirá la probabilidad de que se produzca un potencial de acción. El fármaco riluzol es un fármaco neuroprotector que bloquea los canales iónicos de sodio. Dado que estos canales no pueden activarse, no hay potencial de acción y la neurona no realiza ninguna transducción de señales químicas en señales eléctricas y la señal no avanza. Este medicamento se utiliza como anestésico y sedante. [8]
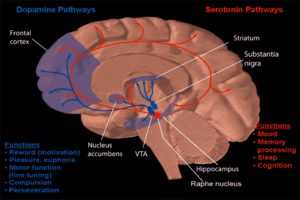
Una forma de neurofarmacología conductual se centra en el estudio de la drogodependencia y cómo la drogadicción afecta la mente humana. La mayoría de las investigaciones han demostrado que la mayor parte del cerebro que refuerza la adicción a través de la recompensa neuroquímica es el núcleo accumbens . La imagen de la derecha muestra cómo se proyecta la dopamina en esta zona. El consumo excesivo de alcohol a largo plazo puede provocar dependencia y adicción . A continuación se describe cómo se produce esta adicción. [ cita necesaria ]
Las propiedades gratificantes y reforzadoras (es decir, adictivas ) del alcohol están mediadas por sus efectos sobre las neuronas de dopamina en la vía de recompensa mesolímbica , que conecta el área tegmental ventral con el núcleo accumbens (NAcc). [9] [10] Uno de los efectos principales del alcohol es la inhibición alostérica de los receptores NMDA y la facilitación de los receptores GABA A (p. ej., aumento del flujo de cloruro mediado por el receptor GABA A a través de la regulación alostérica del receptor). [11] En dosis altas, el etanol inhibe la mayoría de los canales iónicos activados por ligando y también los canales iónicos activados por voltaje en las neuronas. [11] El alcohol inhibe las bombas de sodio-potasio en el cerebelo y es probable que así sea como afecta el cálculo cerebeloso y la coordinación corporal. [12] [13]
Con el consumo agudo de alcohol, se libera dopamina en las sinapsis de la vía mesolímbica, lo que a su vez aumenta la activación de los receptores postsinápticos D1 . [9] [10] La activación de estos receptores desencadena eventos de señalización interna postsináptica a través de la proteína quinasa A que finalmente fosforila la proteína de unión al elemento de respuesta al AMPc (CREB), induciendo cambios mediados por CREB en la expresión génica . [9] [10]
Con la ingesta crónica de alcohol, el consumo de etanol induce de manera similar la fosforilación de CREB a través de la vía del receptor D1, pero también altera la función del receptor NMDA a través de mecanismos de fosforilación; [9] [10] también se produce una regulación negativa adaptativa de la vía del receptor D1 y de la función CREB. [9] [10] El consumo crónico también se asocia con un efecto sobre la fosforilación y función de CREB a través de cascadas de señalización del receptor postsináptico NMDA a través de una vía MAPK/ERK y una vía mediada por CAMK . [10] Estas modificaciones a la función CREB en la vía mesolímbica inducen la expresión (es decir, aumentan la expresión génica) de ΔFosB en la NAcc , [10] donde ΔFosB es la "proteína de control maestro" que, cuando se sobreexpresa en la NAcc, es necesaria y suficiente para el desarrollo y mantenimiento de un estado adictivo (es decir, su sobreexpresión en el núcleo accumbens produce y luego modula directamente el consumo compulsivo de alcohol). [10] [14] [15] [16]
La enfermedad de Parkinson es una enfermedad neurodegenerativa descrita por la pérdida selectiva de neuronas dopaminérgicas ubicadas en la sustancia negra . Hoy en día, el fármaco más utilizado para combatir esta enfermedad es la levodopa o L-DOPA . Este precursor de la dopamina puede atravesar la barrera hematoencefálica , mientras que el neurotransmisor dopamina no puede. Se han realizado extensas investigaciones para determinar si la L-dopa es un mejor tratamiento para la enfermedad de Parkinson que otros agonistas de la dopamina. Algunos creen que el uso prolongado de L-dopa comprometerá la neuroprotección y, por lo tanto, eventualmente conducirá a la muerte de las células dopaminérgicas. Aunque no ha habido pruebas, ni in vivo ni in vitro , algunos todavía creen que el uso prolongado de agonistas de la dopamina es mejor para el paciente. [17]
Si bien se han propuesto una variedad de hipótesis sobre la causa de la enfermedad de Alzheimer , el conocimiento de esta enfermedad está lejos de ser completo para explicar, lo que dificulta el desarrollo de métodos de tratamiento. En el cerebro de los pacientes con Alzheimer, se sabe que tanto los receptores neuronales nicotínicos de acetilcolina (nACh) como los receptores NMDA están regulados negativamente. Así, la Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha desarrollado y aprobado cuatro anticolinesterasas para el tratamiento en EE.UU. Sin embargo, no son fármacos ideales, teniendo en cuenta sus efectos secundarios y su eficacia limitada. Se está desarrollando un fármaco prometedor, el nefiracetam , para el tratamiento del Alzheimer y otros pacientes con demencia, y tiene acciones únicas para potenciar la actividad de los receptores nACh y NMDA. [18]
Con los avances en la tecnología y nuestra comprensión del sistema nervioso, el desarrollo de fármacos continuará con una sensibilidad y especificidad cada vez mayores . Las relaciones estructura-actividad son un área importante de investigación dentro de la neurofarmacología; un intento de modificar el efecto o la potencia (es decir, la actividad) de compuestos químicos bioactivos modificando sus estructuras químicas. [8]
Como uno de los principales mediadores de los efectos gratificantes del alcohol, se han identificado proyecciones dopaminérgicas del área tegmental ventral (VTA) al núcleo accumbens (NAc). La exposición aguda al alcohol estimula la liberación de dopamina en la NAc, que activa los receptores D1, estimulando la señalización de PKA y la posterior expresión génica mediada por CREB, mientras que la exposición crónica al alcohol conduce a una regulación negativa adaptativa de esta vía, en particular de la función CREB. La función CREB disminuida en la NAc puede promover la ingesta de drogas de abuso para lograr un aumento en la recompensa y, por lo tanto, puede estar involucrada en la regulación de los estados afectivos positivos de adicción. La señalización de PKA también afecta la actividad del receptor NMDA y puede desempeñar un papel importante en la neuroadaptación en respuesta a la exposición crónica al alcohol.
A pesar de las altas concentraciones necesarias para sus efectos psicoactivos, el etanol ejerce acciones específicas sobre el cerebro. Los efectos iniciales del etanol resultan principalmente de la facilitación de los receptores GABAA y la inhibición de los receptores de glutamato NMDA. En dosis más altas, el etanol también inhibe el funcionamiento de la mayoría de los canales iónicos dependientes de ligandos y voltaje. No se sabe si el etanol afecta selectivamente a estos canales a través de una unión directa de baja afinidad o mediante una alteración no específica de las membranas plasmáticas que luego influye selectivamente en estas proteínas transmembrana multiméricas y altamente complejas. El etanol regula alostéricamente el receptor GABAA para mejorar el flujo de Cl- activado por GABA. Los efectos ansiolíticos y sedantes del etanol, así como los de los barbitúricos y las benzodiazepinas, se deben a la mejora de la función GABAérgica. También se cree que la facilitación de la función del receptor GABAA contribuye a los efectos reforzadores de estos fármacos. No todos los receptores GABAA son sensibles al etanol. ... El etanol también actúa como antagonista de NMDA al inhibir alostéricamente el paso de las corrientes de Na+ y Ca2+ activadas por glutamato a través del receptor de NMDA. ... Los efectos reforzantes del etanol se explican en parte por su capacidad para activar los circuitos de dopamina mesolímbicos, aunque no se sabe si este efecto está mediado a nivel de VTA o NAc. Tampoco se sabe si esta activación de los sistemas de dopamina es causada principalmente por la facilitación de los receptores GABAA o la inhibición de los receptores NMDA, o ambos. El refuerzo con etanol también está mediado en parte por la liberación inducida por etanol de péptidos opioides endógenos dentro del sistema dopaminérgico mesolímbico, aunque aún no se sabe si el VTA o el NAc son el sitio predominante de dicha acción. En consecuencia, el antagonista de los receptores opioides naltrexona reduce la autoadministración de etanol en animales y se utiliza con efectos modestos para tratar el alcoholismo en humanos.
ΔFosB como biomarcador terapéutico
La fuerte correlación entre la exposición crónica a drogas y ΔFosB brinda nuevas oportunidades para terapias dirigidas en adicciones (118) y sugiere métodos para analizar su eficacia (119). Durante las últimas dos décadas, la investigación ha avanzado desde la identificación de la inducción de ΔFosB hasta la investigación de su acción posterior (38). Es probable que la investigación sobre ΔFosB avance hacia una nueva era: el uso de ΔFosB como biomarcador. Si la detección de ΔFosB es indicativa de exposición crónica al fármaco (y es, al menos en parte, responsable de la dependencia de la sustancia), entonces su seguimiento de la eficacia terapéutica en estudios intervencionistas es un biomarcador adecuado (Figura 2). En el presente documento se analizan ejemplos de vías terapéuticas. ...
Conclusiones
ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción tras la exposición repetida a drogas. Se comprende bien la formación de ΔFosB en múltiples regiones del cerebro y la vía molecular que conduce a la formación de complejos AP-1. El establecimiento de un propósito funcional para ΔFosB ha permitido una mayor determinación de algunos de los aspectos clave de sus cascadas moleculares, que involucran efectores como GluR2 (87,88), Cdk5 (93) y NFkB (100). Además, muchos de estos cambios moleculares identificados ahora están directamente relacionados con los cambios estructurales, fisiológicos y de comportamiento observados después de la exposición crónica a las drogas (60,95,97,102). Los estudios epigenéticos han abierto nuevas fronteras en la investigación de las funciones moleculares de ΔFosB, y los avances recientes han ilustrado el papel de ΔFosB que actúa sobre el ADN y las histonas, verdaderamente como un
interruptor molecular
(34). Como consecuencia de nuestra mejor comprensión de ΔFosB en la adicción, es posible evaluar el potencial adictivo de los medicamentos actuales (119), así como utilizarlo como biomarcador para evaluar la eficacia de las intervenciones terapéuticas (121,122,124). Algunas de estas intervenciones propuestas tienen limitaciones (125) o están en su infancia (75). Sin embargo, se espera que algunos de estos hallazgos preliminares puedan conducir a tratamientos innovadores, muy necesarios en la adicción.
A PESAR DE LA IMPORTANCIA DE NUMEROSOS FACTORES PSICOSOCIALES, EN ESENCIA, LA ADICCIÓN A LAS DROGAS IMPLICA UN PROCESO BIOLÓGICO: la capacidad de la exposición repetida a una droga de abuso para inducir cambios en un cerebro vulnerable que impulsan la búsqueda y el consumo compulsivo de drogas, y pérdida de control sobre el consumo de drogas, que definen un estado de adicción. ... Una gran cantidad de literatura ha demostrado que dicha inducción de ΔFosB en las neuronas NAc de tipo D1 aumenta la sensibilidad de un animal a las drogas, así como las recompensas naturales y promueve la autoadministración de drogas, presumiblemente a través de un proceso de refuerzo positivo.
ΔFosB se ha relacionado directamente con varios comportamientos relacionados con la adicción... Es importante destacar que la sobreexpresión genética o viral de ΔJunD, un mutante negativo dominante de JunD que antagoniza ΔFosB y otras actividades transcripcionales mediadas por AP-1, en la NAc o La OFC bloquea estos efectos clave de la exposición a las drogas
14,22–24
. Esto indica que ΔFosB es necesario y suficiente para muchos de los cambios provocados en el cerebro por la exposición crónica a drogas. ΔFosB también se induce en NAc MSN de tipo D1 mediante el consumo crónico de varias recompensas naturales, incluida la sacarosa, los alimentos ricos en grasas, el sexo y correr ruedas, donde promueve ese consumo
14,26–30
. Esto implica a ΔFosB en la regulación de las recompensas naturales en condiciones normales y quizás durante estados patológicos adictivos. ... ΔFosB sirve como una de las proteínas de control maestro que gobiernan esta plasticidad estructural.