En química orgánica , la ecuación de Hammett describe una relación de energía libre lineal que relaciona las velocidades de reacción y las constantes de equilibrio para muchas reacciones que involucran derivados del ácido benzoico con sustituyentes meta y para entre sí con solo dos parámetros: una constante de sustituyente y una constante de reacción. [1] [2] Esta ecuación fue desarrollada y publicada por Louis Plack Hammett en 1937 [3] como seguimiento de las observaciones cualitativas en su publicación de 1935. [4]
La idea básica es que para dos reacciones cualesquiera con dos reactivos aromáticos que sólo difieren en el tipo de sustituyente, el cambio en la energía libre de activación es proporcional al cambio en la energía libre de Gibbs . [5] Esta noción no se desprende de la termoquímica elemental o la cinética química y fue introducida por Hammett intuitivamente. [a]
La ecuación básica es:
dónde
relacionando la constante de equilibrio , , para una reacción de equilibrio dada con sustituyente R y la constante de referencia cuando R es un átomo de hidrógeno con la constante de sustituyente σ que depende sólo del sustituyente específico R y la constante de velocidad de reacción ρ que depende sólo del tipo de reacción pero no del sustituyente utilizado. [4] [3]
La ecuación también es válida para las velocidades de reacción k de una serie de reacciones con derivados de benceno sustituidos:
En esta ecuación está la velocidad de reacción de referencia del reactivo no sustituido, y k la de un reactivo sustituido.
Una gráfica de un equilibrio dado versus una velocidad de reacción dada con muchos reactivos sustituidos de forma diferente dará una línea recta.
El punto de partida para la recopilación de las constantes sustituyentes es un equilibrio químico para el que la constante sustituyente se establece arbitrariamente en 0 y la constante de reacción se establece en 1: la desprotonación del ácido benzoico o del ácido bencenocarboxílico (R y R' ambos H) en agua a 25 °C.

Habiendo obtenido un valor para K 0 , ahora se determinan una serie de constantes de equilibrio (K) basadas en el mismo proceso, pero ahora con variación del sustituyente para—por ejemplo, ácido p-hidroxibenzoico (R=OH, R'=H) o ácido p-aminobenzoico (R=NH 2 , R'=H) . Estos valores, combinados en la ecuación de Hammett con K 0 y recordando que ρ = 1, dan las constantes de sustituyentes para compiladas en la tabla 1 para los sustituyentes amina , metoxi , etoxi , dimetilamino , metilo , flúor , bromo , cloro , yodo , nitro y ciano . Repitiendo el proceso con sustituyentes meta se obtienen las constantes de sustituyentes meta . Este tratamiento no incluye sustituyentes orto , que introducirían efectos estéricos .
Los valores σ que se muestran en la tabla anterior revelan ciertos efectos de los sustituyentes. Con ρ = 1, el grupo de sustituyentes con valores positivos crecientes (en particular, ciano y nitro) hacen que la constante de equilibrio aumente en comparación con la referencia de hidrógeno , lo que significa que la acidez del ácido carboxílico (representado a la izquierda de la ecuación) ha aumentado. Estos sustituyentes estabilizan la carga negativa del átomo de oxígeno del carboxilato mediante un efecto inductivo de atracción de electrones (-I) y también mediante un efecto mesomérico negativo (-M).
El siguiente grupo de sustituyentes son los halógenos , para los cuales el efecto sustituyente sigue siendo positivo, pero mucho más modesto. La razón de esto es que, si bien el efecto inductivo sigue siendo negativo, el efecto mesomérico es positivo, lo que provoca una cancelación parcial. Los datos también muestran que, para estos sustituyentes, el efecto meta es mucho mayor que el efecto para, debido al hecho de que el efecto mesomérico se reduce en gran medida en un sustituyente meta. Con sustituyentes meta, un átomo de carbono que lleva la carga negativa está más alejado del grupo de ácido carboxílico (estructura 2b).
Este efecto se representa en el esquema 3 , donde, en un areno para sustituido 1a , una estructura de resonancia 1b es un quinoide con carga positiva en el sustituyente X, liberando electrones y desestabilizando así el sustituyente Y. Este efecto desestabilizador no es posible cuando X tiene una orientación meta.

Otros sustituyentes, como el metoxi y el etoxi , pueden incluso tener signos opuestos para la constante del sustituyente como resultado de un efecto inductivo y mesomérico opuesto. Solo los sustituyentes alquilo y arilo, como el metilo, liberan electrones en ambos aspectos.
Por supuesto, cuando el signo de la constante de reacción es negativo (siguiente sección), sólo los sustituyentes con una constante de sustituyente igualmente negativa aumentarán las constantes de equilibrio.
Debido a que el grupo carbonilo no puede servir como fuente de electrones para los grupos -M (a diferencia de los donantes de pares solitarios como el OH), para las reacciones que involucran materiales de partida de fenol y anilina, los valores de σ p para los grupos atractores de electrones parecerán demasiado pequeños. Para las reacciones en las que se espera que los efectos de resonancia tengan un impacto importante, un parámetro modificado y un conjunto modificado de constantes σ p – pueden dar un mejor ajuste. Este parámetro se define utilizando las constantes de ionización de fenoles para -sustituidos, a través de un factor de escala para hacer coincidir los valores de σ p – con los de σ p para sustituyentes "no anómalos", a fin de mantener valores ρ comparables: para ArOH ⇄ ArO – + H + , definimos .
De la misma manera, el carbono carbonílico de un ácido benzoico está en una posición nodal y no puede servir como sumidero para grupos +M (en contraste con un carbocatión en la posición bencílica). Por lo tanto, para las reacciones que involucran carbocationes en la posición α, los valores de σ p para los grupos donadores de electrones parecerán insuficientemente negativos. Con base en consideraciones similares, un conjunto de constantes σ p + se ajusta mejor a las reacciones que involucran grupos donadores de electrones en la posición para y la formación de un carbocatión en el sitio bencílico. Los σ p + se basan en las constantes de velocidad de la reacción S N 1 de los cloruros de cumilo en acetona/agua al 90 %: para ArCMe 2 Cl + H 2 O → ArCMe 2 OH + HCl , definimos . Nótese que el factor de escala es negativo, ya que un grupo donador de electrones acelera la reacción. En el caso de una reacción cuyo diagrama de Hammett se está construyendo, puede ser necesario probar estas constantes de Hammett alternativas para ver si se puede obtener una mejor linealidad.
Conociendo las constantes de los sustituyentes, ahora es posible obtener constantes de reacción para una amplia gama de reacciones orgánicas . La reacción arquetípica es la hidrólisis alcalina del benzoato de etilo (R=R'=H) en una mezcla de agua y etanol a 30 °C. La medición de la velocidad de reacción k 0 combinada con la de muchos benzoatos de etilo sustituidos finalmente da como resultado una constante de reacción de +2,498. [3] [ necesita actualización ] [ se necesita fuente no primaria ]

Las constantes de reacción se conocen para muchas otras reacciones y equilibrios. A continuación se incluye una selección de las proporcionadas por el propio Hammett (con sus valores entre paréntesis):
La constante de reacción, o constante de sensibilidad, ρ , describe la susceptibilidad de la reacción a los sustituyentes, en comparación con la ionización del ácido benzoico. Es equivalente a la pendiente del diagrama de Hammett. La información sobre la reacción y el mecanismo asociado se puede obtener en función del valor obtenido para ρ . Si el valor de:
Estas relaciones se pueden aprovechar para dilucidar el mecanismo de una reacción. Como el valor de ρ está relacionado con la carga durante el paso de determinación de la velocidad, se pueden idear mecanismos basados en esta información. Si se piensa que el mecanismo de la reacción de un compuesto aromático ocurre a través de uno de dos mecanismos, el compuesto se puede modificar con sustituyentes con diferentes valores de σ y se pueden tomar mediciones cinéticas. Una vez que se han realizado estas mediciones, se puede construir un diagrama de Hammett para determinar el valor de ρ . Si uno de estos mecanismos implica la formación de carga, esto se puede verificar en función del valor de ρ. Por el contrario, si el diagrama de Hammett muestra que no se desarrolla carga, es decir, una pendiente cero, se puede descartar el mecanismo que implica la formación de carga.
Los diagramas de Hammett no siempre son perfectamente lineales. Por ejemplo, una curva puede mostrar un cambio repentino en la pendiente o en el valor de ρ . En tal caso, es probable que el mecanismo de la reacción cambie al agregar un sustituyente diferente. Otras desviaciones de la linealidad pueden deberse a un cambio en la posición del estado de transición. En tal situación, ciertos sustituyentes pueden hacer que el estado de transición aparezca antes (o después) en el mecanismo de reacción. [7] [ página necesaria ]
Predominan 3 tipos de influencias eléctricas estáticas o de estado fundamental :
Las dos últimas influencias suelen tratarse juntas como un efecto compuesto, pero aquí se tratan por separado. Westheimer demostró que los efectos eléctricos de los grupos dipolares π-sustituidos sobre las acideces de los ácidos benzoico y fenilacético pueden correlacionarse cuantitativamente, suponiendo solo la acción electrostática directa del sustituyente sobre el protón ionizable del grupo carboxilo . El tratamiento de Westheimer funcionó bien excepto para aquellos ácidos con sustituyentes que tienen pares de electrones no compartidos como –OH y –OCH3, ya que estos sustituyentes interactúan fuertemente con el anillo de benceno. [8] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ] [9] [ fuente no primaria necesaria ] [ necesita actualización ] [ fuente no primaria necesaria ]
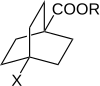
Roberts y Moreland estudiaron las reactividades de los ácidos y ésteres biciclo[2.2.2]octano-1-carboxílicos 4-sustituidos. En una molécula de este tipo, la transmisión de los efectos eléctricos de los sustituyentes a través del anillo por resonancia no es posible. Por lo tanto, esto sugiere el papel de los electrones π en la transmisión de los efectos de los sustituyentes a través de los sistemas aromáticos . [10] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]
La reactividad de los ácidos y ésteres biciclo[2.2.2.]octano-1-carboxílicos 4-sustituidos se midió en 3 procesos diferentes, cada uno de los cuales se había utilizado previamente con los derivados del ácido benzoico. Una gráfica de log(k) contra log(K A ) mostró una relación lineal. Tales relaciones lineales corresponden a relaciones de energía libre lineal, que implican fuertemente que el efecto de los sustituyentes se ejerce a través de cambios de energía potencial y que los términos estéricos y de entropía permanecen casi constantes a lo largo de la serie. La relación lineal se ajustó bien en la ecuación de Hammett. Para los derivados del ácido biciclo[2.2.2.]octano-1-carboxílico 4-sustituido, las constantes de sustituyente y de reacción se designan σ' y ρ'.
Los datos de reactividad indican que los efectos de los grupos sustituyentes en la determinación de las reactividades de los ácidos benzoico y biciclo[2.2.2.]-octano-1-carboxílico sustituidos son comparables. Esto implica que los electrones π aromáticos no juegan un papel dominante en la transmisión de los efectos eléctricos de los grupos dipolares al grupo carboxilo ionizable. La diferencia entre ρ y ρ' para las reacciones de los ácidos con difenilazometano se debe probablemente a una relación inversa con la constante dieléctrica del disolvente D e
Para los grupos directores meta ( grupos atractores de electrones o EWG ), σ meta y σ para son más positivos que σ'. (El superíndice, c, en la tabla denota datos de Hammett, 1940. [11] [ página necesaria ] ) Para los grupos directores orto-para ( grupos donantes de electrones o EDG ), σ' más positivo que σ meta y σ para . La diferencia entre σ para y σ' (σ para – σ') es mayor que la que existe entre σ meta y σ'(σ meta − σ'). Esto es de esperar ya que los efectos de resonancia electrónica se sienten con más fuerza en las posiciones p. Los valores (σ – σ') pueden tomarse como una medida razonable de los efectos de resonancia.
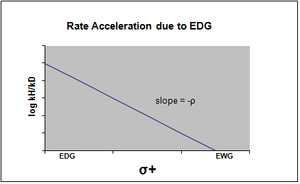
La gráfica de la ecuación de Hammett se considera típicamente lineal, con una pendiente positiva o negativa que se correlaciona con el valor de rho. Sin embargo, la no linealidad emerge en la gráfica de Hammett cuando un sustituyente afecta la velocidad de reacción o cambia el paso que determina la velocidad o el mecanismo de reacción de la reacción. Por la razón del primer caso, se han introducido nuevas constantes sigma para acomodar la desviación de la linealidad que de otro modo se vería como resultado del efecto del sustituyente. σ+ tiene en cuenta la acumulación de carga positiva que ocurre en el estado de transición de la reacción. Por lo tanto, un grupo donador de electrones (EDG) acelerará la velocidad de la reacción por estabilización de resonancia y dará la siguiente gráfica sigma con un valor rho negativo. [12] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]
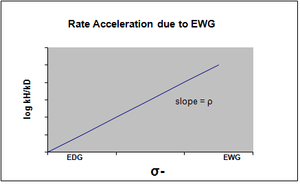
σ- se designa en el caso en que se produce una acumulación de carga negativa en el estado de transición y, en consecuencia, la velocidad de la reacción se acelera por los grupos atractores de electrones (EWG). Los EWG atraen la densidad electrónica por resonancia y estabilizan eficazmente la carga negativa que se genera. El gráfico correspondiente mostrará un valor rho positivo.
En el caso de una sustitución nucleofílica de acilo, el efecto del sustituyente, X, del grupo no saliente puede, de hecho, acelerar la velocidad de la reacción de adición nucleofílica cuando X es un EWG. Esto se atribuye a la contribución de resonancia del EWG para retirar la densidad electrónica, aumentando así la susceptibilidad al ataque nucleofílico sobre el carbono carbonílico. Se produce un cambio en la velocidad cuando X es EDG, como se evidencia al comparar las velocidades entre X = Me y X = OMe, y se observa no linealidad en el diagrama de Hammett. [13] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]
El efecto del sustituyente puede cambiar el paso determinante de la velocidad (rds) en el mecanismo de la reacción. Un determinado efecto electrónico puede acelerar un determinado paso de modo que ya no sea el rds. [14] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]

Un cambio en el mecanismo de una reacción también da como resultado una no linealidad en el diagrama de Hammett. Normalmente, el modelo utilizado para medir los cambios en la velocidad en este caso es el de la reacción SN2. [15] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ] Sin embargo, se ha observado que en algunos casos de una reacción SN2 , un EWG no acelera la reacción como se esperaría [16] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ] y que la velocidad varía con el sustituyente. De hecho, el signo de la carga y el grado en que se desarrolla se verán afectados por el sustituyente en el caso del sistema bencílico. [15] [ fuente no primaria necesaria ]

Por ejemplo, el sustituyente puede determinar que el mecanismo sea una reacción de tipo SN1 en lugar de una reacción de tipo SN2 , en cuyo caso el diagrama de Hammett resultante indicará una aceleración de la velocidad debido a una EDG, lo que dilucidará el mecanismo de la reacción.
Otra desviación de la ecuación regular de Hammett se explica por la carga del nucleófilo. [15] [ fuente no primaria necesaria ] A pesar de la no linealidad en las reacciones SN2 bencílico, los grupos aceptores de electrones podrían acelerar o retardar la reacción. Si el nucleófilo está cargado negativamente (por ejemplo, cianuro), el grupo aceptor de electrones aumentará la velocidad debido a la estabilización de la carga adicional que se coloca en el carbono en el estado de transición. Por otro lado, si el nucleófilo no está cargado (por ejemplo, trifenilfosfina), el grupo aceptor de electrones ralentizará la reacción al disminuir la densidad electrónica en el orbital antienlazante del grupo saliente en el estado de transición.
Existen ahora otras ecuaciones que refinan la ecuación original de Hammett: la ecuación de Swain-Lupton , [ cita requerida ] la ecuación de Taft , [ cita requerida ] la ecuación de Grunwald-Winstein , [ cita requerida ] y la ecuación de Yukawa-Tsuno . [ cita requerida ] También se ha desarrollado una ecuación que aborda la estereoquímica en sistemas alifáticos. [ vago ] [17] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]

Los cambios en la energía de enlace de los electrones centrales (CEBE) se correlacionan linealmente con las constantes de sustituyentes de Hammett ( σ ) en los derivados de benceno sustituidos . [18] [ se necesita una fuente no primaria ]
Considere el benceno para-disustituido pFC 6 H 4 -Z, donde Z es un sustituyente como NH 2 , NO 2 , etc. El átomo de flúor es para con respecto al sustituyente Z en el anillo de benceno. La imagen de la derecha muestra cuatro átomos de carbono del anillo distinguidos, C1( ipso ), C2( orto ), C3( meta ), C4( para ) en la molécula pFC 6 H 4 -Z. El carbono con Z se define como C1(ipso) y el carbono fluorado como C4(para). Esta definición se sigue incluso para Z = H. El lado izquierdo de ( 1 ) se llama desplazamiento CEBE o ΔCEBE, y se define como la diferencia entre el CEBE del átomo de carbono fluorado en pFC 6 H 4 -Z y el del carbono fluorado en la molécula de referencia FC 6 H 5 .
El lado derecho de la ecuación 1 es el producto de un parámetro κ y una constante de sustituyente de Hammett en la posición para, σp . El parámetro κ se define mediante la ecuación 3 :
donde ρ y ρ * son las constantes de reacción de Hammett para la reacción de la molécula neutra y la molécula ionizada del núcleo, respectivamente. Los ΔCEBE de los carbonos del anillo en pFC 6 H 4 -Z se calcularon con la teoría del funcional de la densidad para ver cómo se correlacionan con las constantes σ de Hammett. Se obtuvieron gráficos lineales cuando los cambios de CEBE calculados en el carbono orto, meta y para se graficaron contra las constantes σ o , σ m y σ p de Hammett respectivamente.
De ahí la concordancia aproximada en valor numérico y en signo entre los desplazamientos CEBE y su constante σ de Hammett correspondiente. [19] [ fuente no primaria necesaria ] [ fuente no primaria necesaria ]