La uroquinasa , también conocida como activador del plasminógeno de tipo uroquinasa ( uPA ), es una serina proteasa presente en humanos y otros animales. La proteína uroquinasa humana fue descubierta, pero no nombrada, por McFarlane y Pilling en 1947. [5] La uroquinasa se aisló originalmente de la orina humana , y también está presente en la sangre y en la matriz extracelular de muchos tejidos. El sustrato fisiológico primario de esta enzima es el plasminógeno , que es una forma inactiva ( zimógeno ) de la serina proteasa plasmina . La activación de la plasmina desencadena una cascada proteolítica que, dependiendo del entorno fisiológico, participa en la trombolisis o degradación de la matriz extracelular. Esta cascada había estado involucrada en enfermedades vasculares y progresión del cáncer. [6]
La uroquinasa está codificada en los seres humanos por el gen PLAU , que significa "activador del plasminógeno, uroquinasa". [7] El mismo símbolo representa el gen en otras especies animales.
El gen PLAU codifica una serina proteasa ( EC 3.4.21.73) que participa en la degradación de la matriz extracelular y posiblemente en la migración y proliferación de células tumorales. Un polimorfismo específico de este gen puede estar asociado con la enfermedad de Alzheimer de aparición tardía y también con una menor afinidad por la unión a la fibrina. La proteína codificada por este gen convierte el plasminógeno en plasmina mediante la escisión específica de un enlace Arg-Val en el plasminógeno. La proproteína de este gen es escindida en un enlace Lys-Ile por la plasmina para formar un derivado de dos cadenas en el que un solo enlace disulfuro conecta la cadena A amino-terminal con la cadena B carboxi-terminal catalíticamente activa. Este derivado de dos cadenas también se denomina HMW-uPA (uPA de alto peso molecular). El HMW-uPA puede procesarse posteriormente para convertirse en LMW-uPA (uPA de bajo peso molecular) mediante la escisión de la cadena A en una cadena corta A (A1) y un fragmento amino-terminal. El LMW-uPA es proteolíticamente activo pero no se une al receptor de uPA. [8]
La uroquinasa es una proteína de 411 residuos , que consta de tres dominios : el dominio de la serina proteasa (que consta de los residuos 159-411), el dominio kringle (que consta de los residuos 50-131) y el dominio similar al EGF (que consta de los residuos 1-49). El dominio kringle y el dominio de la serina proteasa están conectados por un enlace interdominio o péptido conector (que consta de los residuos 132-158). La uroquinasa se sintetiza como una forma de zimógeno (prouroquinasa o uroquinasa de cadena única), y se activa por escisión proteolítica entre Lys158 e Ile159. Las dos cadenas resultantes se mantienen juntas por un enlace disulfuro entre Cys148 y Cys279. [9]
En comparación con el sistema de los mamíferos, el pez cebra (Danio rerio) contiene dos ortólogos de la uroquinasa que se han caracterizado como zfuPA-a y zfuPA-b. zfuPA-a se diferencia de la uPA de los mamíferos por carecer de una secuencia de exones que codifique el dominio de unión del uPAR (receptor de la uroquinasa); mientras que la zfuPA-b carece de dos cisteínas del dominio similar al factor de crecimiento epidérmico. La zfuPA-b tampoco tiene actividad de unión en los glóbulos blancos de los peces o en las líneas celulares de peces. La unión del uPAR en el sistema de los mamíferos es esencial para la actividad de la uroquinasa y del uPAR, ya que también funciona como un receptor de adhesión debido a su afinidad por la vitronectina , las integrinas y otras proteasas como la PAI-1 . La falta de la región de unión del uPAR en la uPA del pez cebra sugiere que la uPA del pez cebra funciona sin la unión del uPAR. [10]
Los inhibidores más importantes de la uroquinasa son las serpinas inhibidora del activador del plasminógeno-1 (PAI-1) e inhibidora del activador del plasminógeno-2 (PAI-2), que inhiben la actividad de la proteasa de forma irreversible. En la matriz extracelular, la uroquinasa está unida a la membrana celular por su interacción con el receptor de uroquinasa .
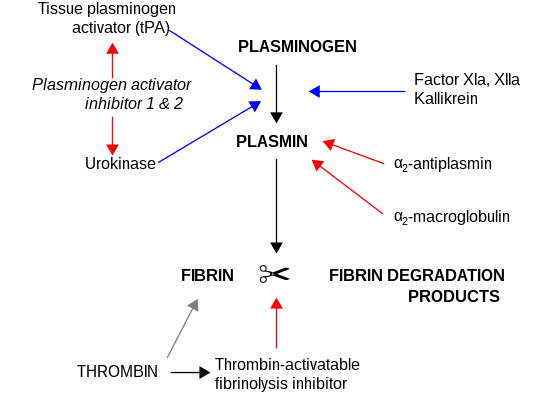
uPa también interactúa con el inhibidor de la proteína C. [11] [12]
El zfuPA-a y el zfuPA-b son activadores deficientes del plasminógeno humano , mientras que el uPA humano es un activador deficiente del plasminógeno del salmón . La principal diferencia entre el uPA del pez cebra y el uPA humano es el dominio EGF. [10]
Se ha descubierto que los niveles elevados de expresión de uroquinasa y varios otros componentes del sistema de activación del plasminógeno están correlacionados con la malignidad tumoral . Se cree que la degradación tisular después de la activación del plasminógeno facilita la invasión tisular y, por lo tanto, contribuye a la metástasis . [13] El activador del plasminógeno de tipo uroquinasa (uPA) se asocia más comúnmente con la progresión del cáncer que el activador tisular del plasminógeno (tPA). [14] Esto hace que el uPA sea un objetivo farmacológico atractivo y, por lo tanto, se han buscado inhibidores para su uso como agentes anticancerígenos. [15] [16] Sin embargo, las incompatibilidades entre los sistemas humano y murino dificultan la evaluación clínica de estos agentes. Además, las células normales utilizan la uroquinasa para la remodelación tisular y el crecimiento vascular, lo que requiere distinguir las características de la uroquinasa asociadas al cáncer para una orientación específica. [13]
La degradación de uPA de la matriz extracelular es crucial para iniciar la angiogénesis que está asociada con el crecimiento del cáncer. [14]
El antígeno uPA está elevado en el tejido del cáncer de mama, lo que se correlaciona con un mal pronóstico en pacientes con cáncer de mama. [14] Por este motivo, el uPA se puede utilizar como un biomarcador de diagnóstico en el cáncer de mama. [14]
A través de su interacción con el receptor de uroquinasa , la uroquinasa afecta varios otros aspectos de la biología del cáncer, como la adhesión celular, la migración y las vías mitóticas celulares .
A partir del 7 de diciembre de 2012, Mesupron ( upamostat ), un inhibidor de la serina proteasa de molécula pequeña desarrollado por la compañía farmacéutica WILEX, ha completado los ensayos de fase II. [17] Mesupron parece ser seguro cuando se combina con el fármaco quimioterapéutico capecitabina para la supervivencia libre de progresión en el cáncer de mama humano. [18]
La uroquinasa es eficaz para restablecer el flujo a los catéteres intravenosos bloqueados por sangre coagulada o fibrina (limpieza del catéter). Los catéteres se utilizan ampliamente para administrar tratamientos a pacientes con fines tales como diálisis, nutrición, tratamiento con antibióticos y tratamiento del cáncer. Aproximadamente el 25% de los catéteres se bloquean, lo que significa que los pacientes afectados no pueden recibir tratamiento hasta que el catéter se haya despejado o reemplazado. La uroquinasa también se utiliza clínicamente como agente trombolítico en el tratamiento de la trombosis venosa profunda grave o masiva , la enfermedad oclusiva arterial periférica, la embolia pulmonar , el infarto agudo de miocardio (IAM, ataque cardíaco) y las cánulas de diálisis ocluidas (limpieza del catéter). También se administra por vía intrapleural para mejorar el drenaje de los derrames pleurales complicados y los empiemas. La uroquinasa se comercializa como Kinlytic (anteriormente Abbokinase) y compite con el activador tisular del plasminógeno recombinante (p. ej., alteplasa) como fármaco trombolítico.
Todos los activadores del plasminógeno (uroquinasa, tPA) catalizan la producción de plasmina, que a su vez conduce a la descomposición de la estructura de la malla de fibrina en los coágulos sanguíneos. Si bien existen puntos en común en el modo de acción de la uroquinasa y el tPA, la uroquinasa tiene algunas ventajas para el tratamiento de los coágulos periféricos (embolia pulmonar, trombosis venosa profunda, enfermedad oclusiva arterial periférica).
A diferencia del tPA, que se activa al unirse a la fibrina dentro de los coágulos, la uroquinasa no es secuestrada por la fibrina y, por lo tanto, no ataca específicamente a los coágulos hemostáticos. Esto hace que la uroquinasa tenga menos probabilidades de descomponer dichos coágulos hemostáticos que son esenciales para la reparación continua de los vasos sanguíneos en todo el cuerpo. La disolución de estos coágulos "buenos" puede provocar eventos adversos graves a través de sangrado hemorrágico. Años de estudio clínico han confirmado la ventaja de seguridad del uso de uroquinasa. [19] [20] En consecuencia, la uroquinasa se ha utilizado preferentemente en la trombosis venosa profunda y la enfermedad oclusiva arterial periférica donde se administra directamente al sitio del coágulo, mientras que el tPA se prefiere en el IAM donde el sangrado periférico es una consideración secundaria.
En 1976, Evelyn Nicol patentó un método revolucionario para la producción de uroquinasa (patente estadounidense n.° 3.930.944). Se cree que Nicol fue la primera mujer afroamericana en recibir una patente de biología molecular. [21]
En 1947 se informó de la presencia de una enzima fibrinolítica en la orina humana, pero no se dio un nombre para dicha enzima que se encontraba detrás de su efecto. [22] En 1952, se extrajo una forma purificada de la enzima de la orina humana y se la denominó "uroquinasa" por "quinasa urinaria". [23] El texto completo de este artículo se ha perdido, y la única cita apunta al resumen de una lista de artículos leídos en una conferencia en la misma revista. [24] Se publicaron algunos otros artículos sobre la purificación de forma independiente en la misma época. En 1960, todavía no estaba claro si la activación del plasminógeno tiene algo que ver con una proteasa, pero se cree que una quinasa desempeña un papel de todos modos. [25]
La orina normal humana y canina contiene fibrinolisina (plasmina) y un potente activador de la profibrinolisina (plasminógeno). El activador, al que hemos denominado uroquinasa, se puede concentrar y purificar parcialmente mediante métodos de fraccionamiento con acetona o alcohol.