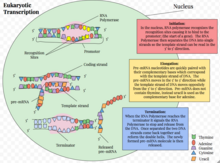
La transcripción eucariota es el elaborado proceso que utilizan las células eucariotas para copiar la información genética almacenada en el ADN en unidades de réplica de ARN complementario transportable . [1] La transcripción genética ocurre tanto en células eucariotas como en células procarióticas . A diferencia de la ARN polimerasa procariótica que inicia la transcripción de todos los diferentes tipos de ARN, la ARN polimerasa en eucariotas (incluidos los humanos) se presenta en tres variaciones, cada una de las cuales traduce un tipo diferente de gen. Una célula eucariota tiene un núcleo que separa los procesos de transcripción y traducción . La transcripción eucariota ocurre dentro del núcleo, donde el ADN se empaqueta en nucleosomas y estructuras de cromatina de orden superior . La complejidad del genoma eucariota requiere una gran variedad y complejidad en el control de la expresión génica.
La transcripción eucariota se produce en tres etapas secuenciales: iniciación, elongación y terminación. [1]
Los ARN transcritos cumplen diversas funciones. Por ejemplo, los componentes estructurales del ribosoma se transcriben mediante la ARN polimerasa I. Los genes codificadores de proteínas se transcriben mediante la ARN polimerasa II en ARN mensajeros (ARNm) que transportan la información del ADN al sitio de síntesis de proteínas. [1] Los llamados ARN no codificantes se elaboran en mayor cantidad y representan la gran mayoría de la producción transcripcional de una célula. [2] Estos ARN no codificantes realizan una variedad de funciones celulares importantes. [2]
Los eucariotas tienen tres ARN polimerasas nucleares, cada una con funciones y propiedades distintas. [3] [4]
La ARN polimerasa I (Pol I) cataliza la transcripción de todos los genes de ARNr excepto el 5S. [3] [4] Estos genes de ARNr están organizados en una única unidad transcripcional y se transcriben en una transcripción continua. Luego, este precursor se procesa en tres ARNr: 18S, 5,8S y 28S. La transcripción de genes de ARNr tiene lugar en una estructura especializada del núcleo llamada nucléolo, [5] donde los ARNr transcritos se combinan con proteínas para formar ribosomas . [6]
La ARN polimerasa II (Pol II) es responsable de la transcripción de todos los ARNm, algunos ARNsn, ARNip y todos los miARN. [3] [4] Muchas transcripciones de Pol II existen transitoriamente como ARN precursores de cadena única (pre-ARN) que se procesan posteriormente para generar ARN maduros. [1] Por ejemplo, los ARNm precursores (pre-ARNm) se procesan ampliamente antes de salir al citoplasma a través del poro nuclear para la traducción de proteínas.
La ARN polimerasa III (Pol III) transcribe pequeños ARN no codificantes, incluidos ARNt, ARNr 5S, ARNsn U6, ARN SRP y otros ARN cortos estables como el ARN de ribonucleasa P. [7]

Las ARN polimerasas I, II y III contienen 14, 12 y 17 subunidades, respectivamente. [8] Las tres polimerasas eucariotas tienen cinco subunidades centrales que exhiben homología con las subunidades β, β', α I , α II y ω de la ARN polimerasa de E. coli. Las tres polimerasas eucariotas utilizan una subunidad idéntica de tipo ω (RBP6), mientras que Pol I y III utilizan las mismas subunidades de tipo α. Las tres polimerasas eucariotas comparten otras cuatro subunidades comunes entre sí. Las subunidades restantes son exclusivas de cada ARN polimerasa. Las subunidades adicionales que se encuentran en Pol I y Pol III en relación con Pol II son homólogas a los factores de transcripción de Pol II. [8]
Las estructuras cristalinas de las ARN polimerasas I [9] y II [10] brindan la oportunidad de comprender las interacciones entre las subunidades y el mecanismo molecular de la transcripción eucariota con detalle atómico.
El dominio carboxilo terminal (CTD) de RPB1 , la subunidad más grande de la ARN polimerasa II, desempeña un papel importante al reunir la maquinaria necesaria para la síntesis y el procesamiento de transcripciones de Pol II. [11] El CTD, largo y estructuralmente desordenado, contiene múltiples repeticiones de la secuencia del heptapéptido YSPTSPS que están sujetas a fosforilación y otras modificaciones postraduccionales durante el ciclo de transcripción. Estas modificaciones y su regulación constituyen el código operativo para que el CTD controle el inicio, el alargamiento y la terminación de la transcripción y para acoplar la transcripción y el procesamiento de ARN. [11]
El inicio de la transcripción genética en eucariotas se produce en pasos específicos. [1] Primero, una ARN polimerasa junto con factores de transcripción generales se une a la región promotora del gen para formar un complejo cerrado llamado complejo de preiniciación . La transición posterior del complejo del estado cerrado al estado abierto da como resultado la fusión o separación de las dos cadenas de ADN y el posicionamiento de la cadena plantilla en el sitio activo de la ARN polimerasa. Sin la necesidad de un cebador, la ARN polimerasa puede iniciar la síntesis de una nueva cadena de ARN utilizando la cadena de ADN molde para guiar la selección de ribonucleótidos y la química de polimerización. [1] Sin embargo, muchas de las síntesis iniciadas se abortan antes de que las transcripciones alcancen una longitud significativa (~10 nucleótidos). Durante estos ciclos abortivos, la polimerasa sigue produciendo y liberando transcripciones cortas hasta que es capaz de producir una transcripción que supera los diez nucleótidos de longitud. Una vez que se alcanza este umbral, la ARN polimerasa pasa el promotor y la transcripción pasa a la fase de elongación. [1]
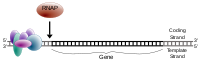
Los genes transcritos con Pol II contienen una región en las inmediaciones del sitio de inicio de la transcripción (TSS) que se une y posiciona el complejo de preiniciación. Esta región se denomina promotor central debido a su papel esencial en el inicio de la transcripción. [12] [13] En los promotores se encuentran diferentes clases de elementos de secuencia. Por ejemplo, la caja TATA es la secuencia de reconocimiento de ADN altamente conservada para la proteína de unión a la caja TATA, TBP , cuya unión inicia el ensamblaje del complejo de transcripción en muchos genes.
Los genes eucariotas también contienen secuencias reguladoras más allá del promotor central. Estos elementos de control que actúan en cis se unen a activadores o represores transcripcionales para aumentar o disminuir la transcripción del promotor central. Los elementos reguladores bien caracterizados incluyen potenciadores , silenciadores y aislantes . Estas secuencias reguladoras pueden extenderse a lo largo de una gran distancia genómica, a veces ubicadas a cientos de kilobases de los promotores centrales. [1]
Los factores de transcripción generales son un grupo de proteínas implicadas en el inicio y la regulación de la transcripción. [1] Estos factores generalmente tienen dominios de unión al ADN que se unen a elementos de secuencia específicos del promotor central y ayudan a reclutar la ARN polimerasa en el sitio de inicio de la transcripción. Los factores de transcripción generales para la ARN polimerasa II incluyen TFIID , TFIIA , TFIIB , TFIIF , TFIIE y TFIIH . [1] [14] [15]
La transcripción, un conjunto completo de factores de transcripción generales y la ARN polimerasa deben ensamblarse en el promotor central para formar el complejo de preiniciación de aproximadamente 2,5 millones de Dalton. [16] Por ejemplo, para los promotores que contienen una caja TATA cerca del TSS, el reconocimiento de la caja TATA por la subunidad TBP de TFIID inicia el ensamblaje de un complejo de transcripción. Las siguientes proteínas en ingresar son TFIIA y TFIIB, que estabilizan el complejo ADN-TFIID y reclutan Pol II en asociación con TFIIF y factores de transcripción adicionales. TFIIB sirve como puente entre la TBP unida a TATA y la ARN polimerasa. También ayuda a colocar el centro activo de la polimerasa en la posición correcta para iniciar la transcripción. Uno de los últimos factores de transcripción que se reclutan en el complejo de preiniciación es TFIIH, que desempeña un papel importante en la fusión y el escape del promotor. [17]

Para los genes transcritos con pol II, y a diferencia de la ARN polimerasa bacteriana, la fusión del promotor requiere hidrólisis de ATP y está mediada por TFIIH. [17] TFIIH es una proteína de diez subunidades, que incluye actividades de ATPasa y proteína quinasa . [18] Mientras que el TFIID mantiene el ADN promotor aguas arriba en una posición fija, el TFIIH tira del ADN bicatenario aguas abajo hacia la hendidura de la polimerasa, impulsando la separación de las cadenas de ADN y la transición del complejo de preiniciación del estado cerrado al abierto. . TFIIB ayuda en la formación de complejos abiertos uniendo el ADN fundido y estabilizando la burbuja de transcripción .
Una vez que el complejo de iniciación está abierto, el primer ribonucleótido se lleva al sitio activo para iniciar la reacción de polimerización en ausencia de un cebador. [1] Esto genera una cadena de ARN naciente que forma un heterodúplex con la cadena de ADN molde. Sin embargo, antes de entrar en la fase de elongación, la polimerasa puede terminar prematuramente y liberar una transcripción corta y truncada. Este proceso se llama iniciación abortiva. [19] Pueden ocurrir muchos ciclos de iniciación abortiva antes de que el transcrito crezca hasta alcanzar una longitud suficiente para promover el escape de la polimerasa del promotor. A lo largo de los ciclos de iniciación abortivos, la ARN polimerasa permanece unida al promotor y arrastra el ADN aguas abajo hacia su hendidura catalítica en un movimiento de tipo crujido. [19]
Cuando una transcripción alcanza la longitud umbral de diez nucleótidos, ingresa al canal de salida del ARN. [1] La polimerasa rompe sus interacciones con los elementos promotores y cualquier proteína reguladora asociada con el complejo de iniciación que ya no necesita. [20] El escape del promotor en eucariotas requiere hidrólisis de ATP y, en el caso de Pol II, fosforilación de CTD. Mientras tanto, la burbuja de transcripción colapsa hasta quedar entre 12 y 14 nucleótidos, proporcionando la energía cinética necesaria para el escape. [1]
Después de escapar del promotor y eliminar la mayoría de los factores de transcripción para el inicio, la polimerasa adquiere nuevos factores para la siguiente fase de la transcripción: la elongación. [21] [22] El alargamiento de la transcripción es un proceso procesivo . El ADN de doble cadena que ingresa desde el frente de la enzima se descomprime para aprovechar la cadena plantilla para la síntesis de ARN. Por cada par de bases de ADN separadas por la polimerasa que avanza, se forma inmediatamente un par de bases híbrido de ARN:ADN. Las hebras de ADN y la cadena de ARN naciente salen de canales separados; las dos cadenas de ADN se reúnen en el extremo final de la burbuja de transcripción mientras que la cadena única de ARN emerge sola.
Entre las proteínas reclutadas por la polimerasa se encuentran los factores de elongación, llamados así porque estimulan la elongación de la transcripción. [23] Hay diferentes clases de factores de alargamiento. Algunos factores pueden aumentar la tasa general de transcripción, algunos pueden ayudar a la polimerasa a través de sitios de pausa transitoria y algunos pueden ayudar a la polimerasa a transcribir a través de la cromatina. [24] Uno de los factores de elongación, P-TEFb , es particularmente importante. [25] P-TEFb fosforila el segundo residuo (Ser-2) de las repeticiones CTD (YSPTSPS) del Pol II unido. P-TEFb también fosforila y activa SPT5 y TAT-SF1. SPT5 es un factor de transcripción universal que ayuda a reclutar la enzima bloqueadora 5' en Pol II con un CTD fosforilado en Ser-5. TAF-SF1 recluta componentes de la maquinaria de empalme de ARN al CTD fosforilado en Ser-2. P-TEFb también ayuda a suprimir la pausa transitoria de la polimerasa cuando encuentra ciertas secuencias inmediatamente después del inicio. [25]
La fidelidad de la transcripción se logra mediante múltiples mecanismos. Las ARN polimerasas seleccionan el sustrato de nucleósido trifosfato (NTP) correcto para evitar errores de transcripción. Sólo el NTP que se empareja correctamente con la base codificante en el ADN es admitido en el centro activo. [26] [27] La ARN polimerasa realiza dos funciones conocidas de corrección de pruebas para detectar y eliminar nucleótidos mal incorporados: edición pirofosforilítica y edición hidrolítica. [1] El primero elimina el ribonucleótido insertado incorrectamente mediante una simple inversión de la reacción de polimerización, mientras que el segundo implica el retroceso de la polimerasa y la escisión de un segmento del producto de ARN que contiene el error. El factor de elongación TFIIS ( InterPro : IPR006289 ; TCEA1 , TCEA2 , TCEA3) estimula una actividad ribonucleasa inherente en la polimerasa, lo que permite la eliminación de bases mal incorporadas mediante una degradación local limitada del ARN. [28] Tenga en cuenta que todas las reacciones (síntesis de enlaces fosfodiéster, pirofosforólisis, hidrólisis de enlaces fosfodiéster) se realizan mediante ARN polimerasa mediante el uso de un único centro activo. [29]
El alargamiento de la transcripción no es un proceso fácil a lo largo del ADN bicatenario, ya que la ARN polimerasa sufre una pausa cotranscripcional extensa durante el alargamiento de la transcripción. [30] [31] En general, la ARN polimerasa II no se transcribe a través de un gen a un ritmo constante. Más bien, se detiene periódicamente en ciertas secuencias, a veces durante largos períodos de tiempo antes de reanudar la transcripción. [32] Esta pausa es especialmente pronunciada en los nucleosomas y surge en parte cuando la polimerasa entra en un estado de retroceso transcripcionalmente incompetente. [30] La duración de estas pausas varía de segundos a minutos o más, y la salida de pausas prolongadas puede ser promovida por factores de elongación como el TFIIS. [33]
Esta pausa también se utiliza a veces para corregir; aquí la polimerasa retrocede, borra parte del ARN que ya ha producido y vuelve a intentar la transcripción. [1] En casos extremos, por ejemplo, cuando la polimerasa encuentra un nucleótido dañado, se detiene por completo. Más a menudo, una polimerasa alargada se detiene cerca del promotor. [32] La pausa del promotor proximal durante el alargamiento temprano es un mecanismo comúnmente utilizado para regular genes preparados para expresarse rápidamente o de manera coordinada. La pausa está mediada por un complejo llamado NELF (factor de alargamiento negativo) en colaboración con DSIF (factor inductor de sensibilidad DRB que contiene SPT4/SPT5). [34] El bloqueo se libera una vez que la polimerasa recibe una señal de activación, como la fosforilación de Ser-2 de la cola de CTD por P-TEFb. Otros factores de elongación, como ELL y TFIIS, estimulan la tasa de elongación al limitar el tiempo que la polimerasa se detiene. [1]
El alargamiento de la polimerasa está asociado con un conjunto de factores proteicos necesarios para varios tipos de procesamiento de ARN. [1] El ARNm se tapa tan pronto como emerge del canal de salida de ARN de la polimerasa. Después de la protección, la desfosforilación de Ser-5 dentro de las repeticiones CTD puede ser responsable de la disociación de la maquinaria de protección. Una mayor fosforilación de Ser-2 provoca el reclutamiento de la maquinaria de empalme de ARN que cataliza la eliminación de intrones no codificantes para generar ARNm maduro. [1] El empalme alternativo expande los complementos proteicos en eucariotas. Al igual que con la protección y el empalme 5', la cola CTD participa en el reclutamiento de enzimas responsables de la poliadenilación 3' , el evento final de procesamiento del ARN que se acopla con la terminación de la transcripción. [1]
La última etapa de la transcripción es la terminación, que conduce a la disociación de la transcripción completa y la liberación de la ARN polimerasa del ADN molde. El proceso difiere para cada una de las tres ARN polimerasas. [35] El mecanismo de terminación es el menos comprendido de las tres etapas de transcripción.
La terminación de la transcripción de genes pre-ARNr por la polimerasa Pol I se realiza mediante un sistema que necesita un factor de terminación de la transcripción específico. [3] El mecanismo utilizado tiene cierta semejanza con la terminación rho-dependiente en procariotas. [36] Las células eucariotas contienen cientos de repeticiones de ADN ribosomal, a veces distribuidas en múltiples cromosomas. La terminación de la transcripción ocurre en la región espaciadora intergénica ribosomal que contiene varios sitios de terminación de la transcripción aguas arriba de un sitio de pausa Pol I. A través de un mecanismo aún desconocido, el extremo 3' del transcrito se escinde, generando una gran molécula de ARNr primario que se procesa posteriormente en los ARNr maduros 18S, 5,8S y 28S.
Cuando Pol II llega al final de un gen, dos complejos proteicos transportados por el CTD, CPSF (factor de especificidad de escisión y poliadenilación) y CSTF (factor de estimulación de escisión), reconocen la señal poli-A en el ARN transcrito. [35] CPSF y CSTF unidos a Poly-A reclutan otras proteínas para llevar a cabo la escisión del ARN y luego la poliadenilación. La polimerasa Poly-A agrega aproximadamente 200 adeninas al extremo 3' escindido del ARN sin plantilla. [35] La larga cola poli-A es exclusiva de las transcripciones realizadas por Pol II.
En el proceso de terminación de la transcripción por Pol I y Pol II, el complejo de elongación no se disuelve inmediatamente después de que se escinde el ARN. La polimerasa continúa moviéndose a lo largo del molde, generando una segunda molécula de ARN asociada con el complejo de elongación. [1] Se han propuesto dos modelos para explicar cómo se logra finalmente la terminación. [35] El modelo alostérico establece que cuando la transcripción avanza a través de la secuencia de terminación, provoca el desmontaje de los factores de elongación y/o un conjunto de factores de terminación que causan cambios conformacionales del complejo de elongación. [36] [37] El modelo de torpedo sugiere que una exonucleasa de 5' a 3' degrada el segundo ARN a medida que emerge del complejo de elongación. La polimerasa se libera cuando la exonucleasa altamente procesiva la alcanza. Se propone que una visión emergente exprese una fusión de estos dos modelos. [37]
La ARN polimerasa III puede terminar la transcripción de manera eficiente sin la participación de factores adicionales. La señal de terminación de Pol III consiste en un tramo de timinas (en la cadena sin plantilla) ubicadas dentro de 40 pb aguas abajo del extremo 3' de los ARN maduros. [35] La señal de terminación poli-T detiene Pol III
La regulación de la expresión genética en eucariotas se logra mediante la interacción de varios niveles de control que actúan tanto localmente para activar o desactivar genes individuales en respuesta a una necesidad celular específica como globalmente para mantener un patrón de expresión genética en toda la cromatina que da forma a la identidad celular. . [1] [38] Debido a que el genoma eucariota está envuelto alrededor de histonas para formar nucleosomas y estructuras de cromatina de orden superior, los sustratos para la maquinaria transcripcional están en general parcialmente ocultos. [1] Sin proteínas reguladoras, muchos genes se expresan en un nivel bajo o no se expresan en absoluto. La transcripción requiere el desplazamiento de los nucleosomas posicionados para permitir que la maquinaria transcripcional acceda al ADN. [39]
Todos los pasos de la transcripción están sujetos a cierto grado de regulación. [1] El inicio de la transcripción en particular es el nivel primario en el que se regula la expresión genética. Apuntar al paso inicial que limita la velocidad es el más eficiente en términos de costes energéticos para la célula. El inicio de la transcripción está regulado por elementos que actúan en cis ( potenciadores , silenciadores , aisladores) dentro de las regiones reguladoras del ADN y factores de acción trans específicos de secuencia que actúan como activadores o represores. [1] La transcripción genética también se puede regular después de la iniciación dirigiéndose al movimiento de la polimerasa en alargamiento. [40]
El genoma eucariota está organizado en una estructura de cromatina compacta que sólo permite el acceso regulado al ADN. La estructura de la cromatina puede ser globalmente "abierta" y más permisiva transcripcionalmente, o globalmente "condensada" y transcripcionalmente inactiva. La primera ( eucromatina ) está ligeramente empaquetada y es rica en genes bajo transcripción activa. Esta última ( heterocromatina ) incluye regiones pobres en genes, como telómeros y centrómeros , pero también regiones con densidad genética normal pero transcripcionalmente silenciadas. La transcripción puede silenciarse mediante modificación de histonas ( desacetilación y metilación ), interferencia de ARN y/o metilación de ADN . [41]
Los patrones de expresión genética que definen la identidad celular se heredan mediante la división celular. [1] Este proceso se llama regulación epigenética . La metilación del ADN se hereda de manera confiable mediante la acción de metilasas de mantenimiento que modifican la cadena de ADN naciente generada por la replicación. [1] En células de mamíferos, la metilación del ADN es el marcador principal de regiones transcripcionalmente silenciadas. Las proteínas especializadas pueden reconocer el marcador y reclutar histonas desacetilasas y metilasas para restablecer el silenciamiento. Las modificaciones de las histonas de los nucleosomas también podrían heredarse durante la división celular; sin embargo, no está claro si pueden funcionar de forma independiente sin la dirección de la metilación del ADN. [1]
Las dos tareas principales del inicio de la transcripción son proporcionar a la ARN polimerasa un acceso al promotor y ensamblar factores de transcripción generales con la polimerasa en un complejo de iniciación de la transcripción. Se han identificado diversos mecanismos para iniciar la transcripción anulando señales inhibidoras en el promotor del gen. [1] Los genes eucarióticos han adquirido secuencias reguladoras extensas que abarcan una gran cantidad de sitios de unión al regulador y distribuyen kilobases en general (a veces cientos de kilobases) desde el promotor, tanto en sentido ascendente como descendente. [1] Los sitios de unión del regulador a menudo se agrupan en unidades llamadas potenciadores. Los potenciadores pueden facilitar la acción altamente cooperativa de varios factores de transcripción (que constituyen potenciadoresomas ). Los potenciadores remotos permiten la regulación de la transcripción a distancia. Los aislantes situados entre potenciadores y promotores ayudan a definir los genes sobre los que un potenciador puede o no influir.
Los activadores transcripcionales eucariotas tienen funciones de activación y unión al ADN separadas. [1] Al unirse a su elemento cis, un activador puede reclutar la polimerasa directamente o reclutar otros factores necesarios para la maquinaria transcripcional. Un activador también puede reclutar modificadores de nucleosomas que alteran la cromatina en las proximidades del promotor y, por tanto, ayudan a la iniciación. Múltiples activadores pueden trabajar juntos, ya sea reclutando uno o dos componentes comunes de la maquinaria transcripcional mutuamente dependientes, o ayudándose mutuamente a unirse a sus sitios de ADN. [1] Estas interacciones pueden crear sinergias con múltiples entradas de señalización y producir respuestas transcripcionales complejas para abordar las necesidades celulares.
Los represores de la transcripción eucariotas comparten algunos de los mecanismos utilizados por sus homólogos procarióticos. Por ejemplo, al unirse a un sitio del ADN que se superpone con el sitio de unión de un activador, un represor puede inhibir la unión del activador. Pero con mayor frecuencia, los represores eucariotas inhiben la función de un activador enmascarando su dominio activador, impidiendo su localización nuclear, promoviendo su degradación o inactivándolo mediante modificaciones químicas. [1] Los represores pueden inhibir directamente el inicio de la transcripción uniéndose a un sitio aguas arriba de un promotor e interactuando con la maquinaria transcripcional. Los represores pueden reprimir indirectamente la transcripción reclutando modificadores de histonas (desacetilasas y metilasas) o enzimas remodeladoras de nucleosomas que afectan la accesibilidad del ADN. [1] La represión de las modificaciones de las histonas y del ADN también es la base del silenciamiento transcripcional que puede extenderse a lo largo de la cromatina y desactivar múltiples genes. [42]
La fase de elongación comienza una vez que se ha completado el ensamblaje del complejo de elongación y avanza hasta encontrar una secuencia de terminación. [1] El movimiento posterior al inicio de la ARN polimerasa es el objetivo de otra clase de mecanismos reguladores importantes. Por ejemplo, el activador transcripcional Tat afecta el alargamiento en lugar de la iniciación durante su regulación de la transcripción del VIH . [43] De hecho, muchos genes eucarióticos se regulan mediante la liberación de un bloqueo del alargamiento de la transcripción llamado pausa proximal del promotor. [44] La pausa puede influir en la estructura de la cromatina en los promotores para facilitar la actividad genética y conducir a respuestas transcripcionales rápidas o sincrónicas cuando las células se exponen a una señal de activación. [32] La pausa está asociada con la unión de dos factores de elongación negativos, DSIF (SPT4/SPT5) y NELF, al complejo de elongación. Otros factores también pueden influir en la estabilidad y duración de la polimerasa en pausa. [45] La liberación en pausa se desencadena por el reclutamiento de la quinasa P-TEFb. [40]
La terminación de la transcripción también se ha convertido en un área importante de la regulación transcripcional. La terminación va acompañada del reciclaje eficiente de la polimerasa. [46] Los factores asociados con la terminación de la transcripción también pueden mediar el bucle de genes y, por lo tanto, determinar la eficiencia del reinicio.
Cuando la transcripción se detiene por la presencia de una lesión en la cadena transcrita de un gen, las proteínas reparadoras del ADN se reclutan en la ARN polimerasa detenida para iniciar un proceso llamado reparación acoplada a la transcripción. [47] Un elemento central de este proceso es el factor de transcripción general TFIIH que tiene actividad ATPasa. TFIIH provoca un cambio conformacional en la polimerasa, para exponer la burbuja de transcripción atrapada en su interior, para que las enzimas reparadoras del ADN puedan acceder a la lesión. [48] Por lo tanto, la ARN polimerasa sirve como proteína que detecta daños en la célula para dirigir las enzimas reparadoras a los genes que se están transcribiendo activamente.
La transcripción eucariota es más compleja que la transcripción procariótica . Por ejemplo, en los eucariotas el material genético (ADN), y por tanto la transcripción, se localiza principalmente en el núcleo, donde está separado del citoplasma (en el que se produce la traducción) por la membrana nuclear. Esto permite la regulación temporal de la expresión genética mediante el secuestro del ARN en el núcleo y permite el transporte selectivo de ARN maduros al citoplasma. Las bacterias no tienen un núcleo distinto que separe el ADN del ribosoma y el ARNm se traduce en proteína tan pronto como se transcribe. El acoplamiento entre los dos procesos proporciona un mecanismo importante para la regulación de genes procarióticos. [1]
En el nivel de iniciación, la ARN polimerasa en procariotas (en particular bacterias) se une fuertemente a la región promotora e inicia una alta tasa basal de transcripción. No se necesita hidrólisis de ATP para la transición de cerrado a abierto; la fusión del promotor es impulsada por reacciones de unión que favorecen la conformación fundida. La cromatina impide en gran medida la transcripción en eucariotas. Se requiere el ensamblaje de un gran complejo de preiniciación multiproteica para la iniciación específica del promotor. La fusión del promotor en eucariotas requiere la hidrólisis del ATP. Como resultado, las ARN polimerasas eucariotas exhiben una tasa basal baja de inicio de la transcripción. [42]
En los vertebrados, la mayoría de los promotores de genes contienen una isla CpG con numerosos sitios CpG . [49] Cuando muchos de los sitios CpG promotores de un gen están metilados, el gen queda silenciado. [50] Los cánceres colorrectales suelen tener de 3 a 6 mutaciones de conductor y de 33 a 66 mutaciones de autoestopista o pasajero. [51] Sin embargo, el silenciamiento transcripcional puede ser más importante que la mutación para provocar la progresión al cáncer. Por ejemplo, en los cánceres colorrectales, la metilación de la isla CpG silencia transcripcionalmente entre 600 y 800 genes (ver regulación de la transcripción en el cáncer ). La represión transcripcional en el cáncer también puede ocurrir por otros mecanismos epigenéticos , como la expresión alterada de microARN . [52] En el cáncer de mama, la represión transcripcional de BRCA1 puede ocurrir con más frecuencia por microARN-182 sobreexpresado que por hipermetilación del promotor BRCA1 (ver Baja expresión de BRCA1 en cánceres de mama y ovario ).