

La inmunohistoquímica es una forma de inmunotinción . Implica el proceso de identificación selectiva de antígenos (proteínas) en células y tejidos, explotando el principio de la unión específica de los anticuerpos a los antígenos en los tejidos biológicos . Albert Hewett Coons , Ernest Berliner , Norman Jones y Hugh J Creech fueron los primeros en desarrollar la inmunofluorescencia en 1941. Esto condujo al desarrollo posterior de la inmunohistoquímica. [2] [3]
La tinción inmunohistoquímica se utiliza ampliamente en el diagnóstico de células anormales, como las que se encuentran en los tumores cancerosos . En algunas células cancerosas se expresan ciertos antígenos tumorales que permiten su detección. La inmunohistoquímica también se utiliza ampliamente en la investigación básica, para comprender la distribución y localización de biomarcadores y proteínas expresadas de forma diferencial en diferentes partes de un tejido biológico. [4]
La inmunohistoquímica se puede realizar en tejido que ha sido fijado e incluido en parafina , pero también en tejido criopreservado (congelado). Según la forma en que se conserva el tejido, existen diferentes pasos para preparar el tejido para la inmunohistoquímica, pero el método general incluye la fijación adecuada, la incubación de recuperación de antígeno con el anticuerpo primario y luego la incubación con el anticuerpo secundario. [5] [6]
La fijación del tejido es importante para preservarlo y mantener la morfología celular. La fórmula de fijación, la proporción de fijador respecto del tejido y el tiempo de permanencia en el fijador afectarán el resultado. La solución de fijación (fijador) suele ser una solución tampón neutra de formalina al 10 % . El tiempo de fijación normal es de 24 horas a temperatura ambiente. La proporción de fijador respecto del tejido varía de 1:1 a 1:20. Una vez fijado el tejido, se puede incrustar en parafina. [5] [6]
En el caso de las secciones congeladas, la fijación se realiza generalmente después de la sección si no se van a analizar nuevos anticuerpos. En ese caso, se puede utilizar acetona o formalina. [6]
La sección de la muestra de tejido se realiza utilizando un micrótomo. Para el tejido incluido en parafina, el grosor normal es de 4 μm, y para las secciones congeladas, de 4 a 6 μm. [6] El grosor de las secciones cortadas es importante y es un factor importante en la inmunohistoquímica. Si compara una sección de tejido cerebral que mide 4 μm con una sección que mide 7 μm, es posible que parte de lo que se ve en la sección de 7 μm de grosor falte en la sección de 4 μm. Esto demuestra la importancia de los métodos detallados relacionados con esta metodología. [7] Los tejidos incluidos en parafina deben desparafinarse para eliminar toda la parafina sobre y alrededor de la muestra de tejido en xileno o un buen sustituto, seguido de alcohol. [8]
La recuperación de antígenos es necesaria para que los epítopos sean accesibles para la tinción inmunohistoquímica en la mayoría de los cortes de tejido fijados con formalina. Los epítopos son los sitios de unión de los anticuerpos utilizados para visualizar el antígeno objetivo que puede estar enmascarado debido a la fijación. La fijación del tejido puede provocar la formación de puentes de metileno o la reticulación de grupos amino, de modo que los epítopos ya no estén disponibles. La recuperación de antígenos puede restaurar la antigenicidad enmascarada, posiblemente rompiendo los enlaces cruzados causados por la fijación. [9] La forma más común de realizar la recuperación de antígenos es mediante el uso de calentamiento a alta temperatura mientras se sumergen los portaobjetos en una solución tampón. [10] Esto se puede hacer de diferentes maneras, por ejemplo, utilizando un horno microondas, autoclaves, placas de calentamiento o baños de agua. Para las secciones congeladas, la recuperación de antígenos generalmente no es necesaria, pero para la sección congelada que se ha fijado en acetona o formalina, la recuperación de antígenos puede mejorar la señal inmunohistoquímica. [6]
La unión no específica de anticuerpos puede causar tinción de fondo. Aunque los anticuerpos se unen a epítopos específicos, también pueden unirse parcial o débilmente a sitios en proteínas no específicas que son similares al sitio de unión en la proteína diana. Al incubar el tejido con suero normal aislado de la especie en la que se produjo el anticuerpo secundario, se puede reducir la tinción de fondo. También es posible utilizar tampones de bloqueo universales disponibles comercialmente. Otros tampones de bloqueo comunes incluyen suero normal, leche en polvo descremada, BSA o gelatina. [5] [6] La actividad enzimática endógena también puede causar tinción de fondo, pero se puede reducir si el tejido se trata con peróxido de hidrógeno. [5]
Una vez preparada la muestra, se puede visualizar el objetivo mediante el uso de anticuerpos marcados con compuestos fluorescentes, metales o enzimas. Existen métodos directos e indirectos para marcar la muestra. [6] [11]
Los anticuerpos utilizados para la detección pueden ser policlonales o monoclonales. Los anticuerpos policlonales se obtienen utilizando animales como cobayas, conejos, ratones, ratas o cabras. Al animal se le inyecta el antígeno de interés y se desencadena una respuesta inmunitaria. Los anticuerpos se pueden aislar del suero completo del animal. La producción de anticuerpos policlonales dará como resultado una mezcla de diferentes anticuerpos y reconocerá múltiples epítopos. Los anticuerpos monoclonales se obtienen inyectando al animal el antígeno de interés y luego aislando una célula B productora de anticuerpos, generalmente del bazo. Luego, la célula productora de anticuerpos se fusiona con una línea celular cancerosa. Esto hace que los anticuerpos muestren especificidad para un solo epítopo. [12]
Para las estrategias de detección inmunohistoquímica, los anticuerpos se clasifican como reactivos primarios o secundarios. Los anticuerpos primarios se generan contra un antígeno de interés y, por lo general, no están conjugados (no están marcados). Los anticuerpos secundarios se generan contra inmunoglobulinas de la especie de anticuerpo primario. El anticuerpo secundario suele estar conjugado con una molécula de enlace, como la biotina, que luego recluta moléculas indicadoras, o el propio anticuerpo secundario se une directamente a la molécula indicadora. [11]
El método directo es un método de tinción de un solo paso que implica que un anticuerpo marcado reaccione directamente con el antígeno en secciones de tejido. Si bien esta técnica utiliza solo un anticuerpo y, por lo tanto, es simple y rápida, la sensibilidad es menor debido a la pequeña amplificación de la señal, en contraste con los métodos indirectos. [11]
El método indirecto implica un anticuerpo primario no marcado que se une al antígeno diana en el tejido. Luego se añade un anticuerpo secundario, que se une al anticuerpo primario, como segunda capa. Como se mencionó, el anticuerpo secundario debe generarse contra el anticuerpo IgG de la especie animal en la que se ha generado el anticuerpo primario. Este método es más sensible que las estrategias de detección directa debido a la amplificación de la señal debido a la unión de varios anticuerpos secundarios a cada anticuerpo primario. [11]
El método indirecto, además de su mayor sensibilidad, también tiene la ventaja de que sólo se necesita generar una cantidad relativamente pequeña de anticuerpos secundarios conjugados (marcados) estándar. Por ejemplo, un anticuerpo secundario marcado generado contra IgG de conejo es útil con cualquier anticuerpo primario generado en conejo. Esto es particularmente útil cuando un investigador está marcando más de un anticuerpo primario, ya sea debido a la selección policlonal que produce una serie de anticuerpos primarios para un antígeno singular o cuando hay interés en múltiples antígenos. Con el método directo, sería necesario marcar cada anticuerpo primario para cada antígeno de interés. [11]

Las moléculas indicadoras varían según la naturaleza del método de detección, siendo las más comunes la detección cromogénica y la detección por fluorescencia. En la inmunohistoquímica cromogénica, un anticuerpo se conjuga con una enzima, como el fosfato alcalino y la peroxidasa de rábano picante, que puede catalizar una reacción productora de color en presencia de un sustrato cromogénico como la diaminobencidina. [5] El producto coloreado se puede analizar con un microscopio óptico común. [13] En la inmunofluorescencia, el anticuerpo se etiqueta con un fluoróforo , como el isotiocianato de fluoresceína , el isotiocianato de tetrametilrodamina, el acetato de aminometilcumarina o la cianina5. También se utilizan comúnmente los fluorocromos sintéticos de Alexa Fluors. [13] [14] Los fluorocromos se pueden visualizar mediante un microscopio de fluorescencia o confocal. [13]
Para los métodos de detección cromogénicos y fluorescentes, el análisis densitométrico de la señal puede proporcionar datos semicuantitativos y totalmente cuantitativos, respectivamente, para correlacionar el nivel de la señal del reportero con el nivel de expresión o localización de la proteína. [6]
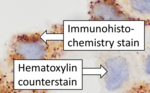
Después de la tinción inmunohistoquímica del antígeno diana, a menudo se aplica otra tinción. La contratinción proporciona un contraste que ayuda a que la tinción primaria se destaque y facilita el examen de la morfología del tejido. También ayuda con la orientación y visualización de la sección de tejido. La hematoxilina se utiliza comúnmente. [6] [15]
En las técnicas inmunohistoquímicas, hay varios pasos previos a la tinción final del tejido que pueden causar una variedad de problemas. Puede ser una tinción de fondo fuerte, una tinción débil del antígeno diana y la presencia de artefactos. Es importante que la calidad de los anticuerpos y las técnicas de inmunohistoquímica estén optimizadas. [16] La biotina endógena, las enzimas indicadoras o la reactividad cruzada de anticuerpos primarios/secundarios son causas comunes de una tinción de fondo fuerte. [11] [13] La tinción débil o ausente puede deberse a una fijación inexacta del tejido o a niveles bajos de antígeno. Estos aspectos de la preparación del tejido y la tinción de anticuerpos mediante inmunohistoquímica deben abordarse sistemáticamente para identificar y superar los problemas de tinción. [5] [6]

Los métodos para eliminar la tinción de fondo incluyen la dilución de los anticuerpos primarios o secundarios, el cambio del tiempo o la temperatura de incubación y el uso de un sistema de detección diferente o un anticuerpo primario diferente. El control de calidad debe incluir, como mínimo, un tejido que se sabe que expresa el antígeno como control positivo y controles negativos de tejido que se sabe que no expresa el antígeno, así como el tejido de prueba sondeado de la misma manera con la omisión del anticuerpo primario (o mejor, la absorción del anticuerpo primario). [5] [18]

La inmunohistoquímica es una excelente técnica de detección y tiene la enorme ventaja de poder mostrar exactamente dónde se encuentra una proteína dada dentro del tejido examinado. También es una forma eficaz de examinar los tejidos. Esto la ha convertido en una técnica ampliamente utilizada en neurociencia , permitiendo a los investigadores examinar la expresión de proteínas dentro de estructuras cerebrales específicas. Su principal desventaja es que, a diferencia de las técnicas de inmunotransferencia donde la tinción se verifica contra una escala de peso molecular , es imposible demostrar en inmunohistoquímica que la tinción corresponde con la proteína de interés. Por esta razón, los anticuerpos primarios deben estar bien validados en un Western Blot o un procedimiento similar. La técnica se usa aún más ampliamente en patología quirúrgica diagnóstica para inmunofenotipificación de tumores (por ejemplo, inmunotinción para e-cadherina para diferenciar entre carcinoma ductal in situ (tinción positiva) y carcinoma lobulillar in situ (no tinción positiva) [19] ). Más recientemente, las técnicas inmunohistoquímicas han sido útiles en diagnósticos diferenciales de múltiples formas de carcinomas de glándulas salivales, cabeza y cuello. [20]
La diversidad de marcadores inmunohistoquímicos utilizados en la patología quirúrgica diagnóstica es sustancial. Muchos laboratorios clínicos de hospitales terciarios tendrán menús de más de 200 anticuerpos utilizados como biomarcadores diagnósticos, pronósticos y predictivos. Algunos ejemplos de marcadores comúnmente utilizados incluyen:

En el cáncer se modifican diversas vías moleculares y algunas de esas alteraciones pueden ser objeto de tratamiento. La inmunohistoquímica puede utilizarse para evaluar qué tumores tienen más probabilidades de responder al tratamiento, detectando la presencia o los niveles elevados de la diana molecular. [ cita requerida ]
La biología tumoral permite una serie de objetivos intracelulares potenciales. Muchos tumores dependen de las hormonas. La presencia de receptores hormonales se puede utilizar para determinar si un tumor es potencialmente sensible a la terapia antihormonal. Una de las primeras terapias fue el antiestrógeno, tamoxifeno , utilizado para tratar el cáncer de mama. Dichos receptores hormonales se pueden detectar mediante inmunohistoquímica. [23] El imatinib , un inhibidor de la tirosina quinasa intracelular , se desarrolló para tratar la leucemia mieloide crónica , una enfermedad caracterizada por la formación de una tirosina quinasa anormal específica. El imitanib ha demostrado ser eficaz en tumores que expresan otras tirosina quinasas, en particular KIT. La mayoría de los tumores del estroma gastrointestinal expresan KIT, que se puede detectar mediante inmunohistoquímica. [24]
Muchas proteínas que se ha demostrado que están altamente reguladas al alza en estados patológicos mediante inmunohistoquímica son objetivos potenciales para terapias que utilizan anticuerpos monoclonales . Los anticuerpos monoclonales, debido a su tamaño, se utilizan contra objetivos de la superficie celular. Entre los objetivos sobreexpresados se encuentran miembros de la familia EGFR , proteínas transmembrana con un dominio receptor extracelular que regula una tirosina quinasa intracelular. [25] De estos, HER2/neu (también conocido como Erb-B2) fue el primero en desarrollarse. La molécula se expresa altamente en una variedad de tipos de células cancerosas, más notablemente el cáncer de mama. Como tal, los anticuerpos contra HER2/neu han sido aprobados por la FDA para el tratamiento clínico del cáncer bajo el nombre de fármaco Herceptin . Hay pruebas inmunohistoquímicas disponibles comercialmente, Dako HercepTest, Leica Biosystems Oracle [26] y Ventana Pathway. [27]
De manera similar, el receptor del factor de crecimiento epidérmico (HER-1) se sobreexpresa en una variedad de cánceres, incluidos los de cabeza y cuello y colon. La inmunohistoquímica se utiliza para determinar los pacientes que pueden beneficiarse de anticuerpos terapéuticos como Erbitux (cetuximab). [28] Los sistemas comerciales para detectar el receptor del factor de crecimiento epidérmico mediante inmunohistoquímica incluyen Dako pharmDx.
La inmunohistoquímica también se puede utilizar para obtener un perfil proteico más general, siempre que se disponga de anticuerpos validados para inmunohistoquímica. El Atlas de Proteínas Humanas muestra un mapa de la expresión proteica en órganos y tejidos humanos normales. La combinación de inmunohistoquímica y microarrays tisulares proporciona patrones de expresión proteica en una gran cantidad de tipos de tejidos diferentes. La inmunohistoquímica también se utiliza para obtener perfiles proteicos en las formas más comunes de cáncer humano. [29] [30]
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace )Última actualización del personal: 25 de enero de 2024{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )