La sustancia negra ( SN ) es una estructura de los ganglios basales ubicada en el mesencéfalo que desempeña un papel importante en la recompensa y el movimiento . Substantia nigra es la palabra latina para "sustancia negra", lo que refleja el hecho de que partes de la sustancia negra parecen más oscuras que las áreas vecinas debido a los altos niveles de neuromelanina en las neuronas dopaminérgicas . [1] La enfermedad de Parkinson se caracteriza por la pérdida de neuronas dopaminérgicas en la pars compacta de la sustancia negra . [2]
Aunque la sustancia negra aparece como una banda continua en secciones del cerebro, estudios anatómicos han descubierto que en realidad consta de dos partes con conexiones y funciones muy diferentes: la pars compacta (SNpc) y la pars reticulata (SNpr). La pars compacta sirve principalmente como una proyección hacia el circuito de los ganglios basales, suministrando dopamina al cuerpo estriado . La pars reticulata transmite señales desde los ganglios basales a numerosas otras estructuras cerebrales. [3]
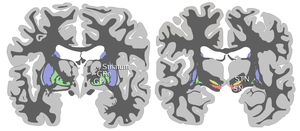


La sustancia negra, junto con otros cuatro núcleos, forma parte de los ganglios basales . Es el núcleo más grande del mesencéfalo y se encuentra dorsal a los pedúnculos cerebrales . Los humanos tenemos dos sustancias negras, una a cada lado de la línea media.
La SN se divide en dos partes: la pars reticulata (SNpr) y la pars compacta (SNpc), que se encuentra medial a la pars reticulata. A veces se menciona una tercera región, la pars lateralis, aunque generalmente se clasifica como parte de la pars reticulata. La (SNpr) y el globo pálido interno (GPi) están separados por la cápsula interna . [4]
La pars reticulata tiene un fuerte parecido estructural y funcional con la parte interna del globo pálido. A veces se considera que ambas son partes de la misma estructura, separadas por la sustancia blanca de la cápsula interna. Al igual que las del globo pálido, las neuronas de la pars reticulata son principalmente GABAérgicas . [5] [6]
La entrada principal a la SNpr se deriva del cuerpo estriado . Viene por dos rutas, conocidas como vías directa e indirecta . La vía directa consiste en axones de células espinosas medianas en el cuerpo estriado que se proyectan directamente a la pars reticulata. La vía indirecta consiste en tres enlaces: una proyección de las células espinosas medianas del cuerpo estriado a la parte externa del globo pálido ; una proyección GABAérgica del globo pálido al núcleo subtalámico , y una proyección glutamatérgica del núcleo subtalámico a la pars reticulata. [6] [7] [ mejor fuente necesaria ] Por lo tanto, la actividad estriatal a través de la vía directa ejerce un efecto inhibidor sobre las neuronas en el (SNpr) pero un efecto excitador a través de la vía indirecta. Las vías directa e indirecta se originan a partir de diferentes subconjuntos de células espinosas medianas del cuerpo estriado: están estrechamente entremezcladas, pero expresan diferentes tipos de receptores de dopamina, además de mostrar otras diferencias neuroquímicas.
Se producen proyecciones significativas hacia el tálamo (núcleos ventral lateral y ventral anterior), el colículo superior y otros núcleos caudales desde la pars reticulata (la vía nigrotalámica), [8] que utilizan GABA como neurotransmisor. Además, estas neuronas forman hasta cinco colaterales que se ramifican tanto dentro de la pars compacta como de la pars reticulata, probablemente modulando la actividad dopaminérgica en la pars compacta. [9]
La sustancia negra es un actor importante en la función cerebral, en particular, en el movimiento ocular , la planificación motora , la búsqueda de recompensas , el aprendizaje y la adicción . Muchos de los efectos de la sustancia negra están mediados por el cuerpo estriado . La entrada dopaminérgica nigral al cuerpo estriado a través de la vía nigroestriatal está íntimamente relacionada con la función del cuerpo estriado. [10] La codependencia entre el cuerpo estriado y la sustancia negra se puede ver de esta manera: cuando la sustancia negra es estimulada eléctricamente, no se produce ningún movimiento; sin embargo, los síntomas de degeneración nigral debido al Parkinson son un ejemplo conmovedor de la influencia de la sustancia negra en el movimiento. Además de las funciones mediadas por el cuerpo estriado, la sustancia negra también sirve como una fuente importante de inhibición GABAérgica para varios objetivos cerebrales.
La pars reticulata de la sustancia negra es un importante centro de procesamiento en los ganglios basales. Las neuronas GABAérgicas de la pars reticulata transmiten las señales procesadas finales de los ganglios basales al tálamo y al colículo superior . Además, la pars reticulata también inhibe la actividad dopaminérgica en la pars compacta a través de colaterales axónicas, aunque la organización funcional de estas conexiones sigue sin estar clara.
Las neuronas GABAérgicas de la pars reticulata disparan espontáneamente potenciales de acción . En ratas, la frecuencia de los potenciales de acción es de aproximadamente 25 Hz. [11] El propósito de estos potenciales de acción espontáneos es inhibir los objetivos de los ganglios basales, y las disminuciones en la inhibición están asociadas con el movimiento. [12] El núcleo subtalámico proporciona una entrada excitatoria que modula la tasa de disparo de estos potenciales de acción espontáneos. Sin embargo, la lesión del núcleo subtalámico conduce a solo una disminución del 20% en la tasa de disparo de la pars reticulata, lo que sugiere que la generación de potenciales de acción en la pars reticulata es en gran medida autónoma, [13] como lo ejemplifica el papel de la pars reticulata en el movimiento ocular sacádico . Un grupo de neuronas GABAérgicas de la pars reticulata se proyecta al colículo superior, exhibiendo un alto nivel de actividad inhibitoria sostenida. [14] Las proyecciones del núcleo caudado al colículo superior también modulan el movimiento ocular sacádico. En la enfermedad de Parkinson [15] y la epilepsia se encuentran patrones alterados de activación de la pars reticulata, como la activación en picos únicos o en ráfagas . [16]
La función más destacada de la pars compacta es el control motor , [17] aunque el papel de la sustancia negra en el control motor es indirecto; la estimulación eléctrica de la sustancia negra no produce movimiento, debido a la mediación del cuerpo estriado en la influencia nigral del movimiento. La pars compacta envía una entrada excitatoria al cuerpo estriado a través de la vía D1 que excita y activa el cuerpo estriado, lo que da como resultado la liberación de GABA en el globo pálido para inhibir sus efectos inhibidores en el núcleo talámico. Esto hace que las vías talamocorticales se exciten y transmitan señales de neuronas motoras a la corteza cerebral para permitir el inicio del movimiento, que está ausente en la enfermedad de Parkinson. Sin embargo, la falta de neuronas de la pars compacta tiene una gran influencia en el movimiento, como lo evidencian los síntomas de Parkinson. El papel motor de la pars compacta puede involucrar el control motor fino, como se ha confirmado en modelos animales con lesiones en esa región. [18]
La pars compacta está muy involucrada en las respuestas aprendidas a los estímulos. En los primates, la actividad de las neuronas dopaminérgicas aumenta en la vía nigroestriatal cuando se presenta un nuevo estímulo. [19] La actividad dopaminérgica disminuye con la presentación repetida de estímulos. [19] Sin embargo, la presentación de estímulos conductualmente significativos (es decir, recompensas) continúa activando neuronas dopaminérgicas en la pars compacta de la sustancia negra. Las proyecciones dopaminérgicas desde el área tegmental ventral (parte inferior del "mesencéfalo" o mesencéfalo) a la corteza prefrontal (vía mesocortical) y al núcleo accumbens (vía mesolímbica - "meso" se refiere a "desde el mesencéfalo"... específicamente el área tegmental ventral ) están implicadas en la recompensa, el placer y la conducta adictiva. La pars compacta también es importante en el aprendizaje espacial, las observaciones sobre el entorno y la ubicación en el espacio. Las lesiones en la pars compacta provocan déficits de aprendizaje en la repetición de movimientos idénticos, [20] y algunos estudios apuntan a su participación en un sistema de memoria basado en la respuesta y dependiente del estriato dorsal que funciona de forma relativamente independiente del hipocampo , que tradicionalmente se cree que sirve para funciones de memoria espacial o de tipo episódico . [21]
La pars compacta también desempeña un papel en el procesamiento temporal y se activa durante la reproducción del tiempo. Las lesiones en la pars compacta conducen a déficits temporales. [22] Últimamente, se ha sospechado que la pars compacta regula el ciclo sueño-vigilia, [23] lo que es consistente con síntomas como el insomnio y las alteraciones del sueño REM que informan los pacientes con enfermedad de Parkinson . Aun así, los déficits parciales de dopamina que no afectan el control motor pueden conducir a alteraciones en el ciclo sueño-vigilia, especialmente patrones similares al REM de actividad neuronal durante la vigilia, especialmente en el hipocampo . [24]
La sustancia negra es fundamental para el desarrollo de muchas enfermedades y síndromes, entre ellos el parkinsonismo y la enfermedad de Parkinson . Existe un estudio que demuestra que la aplicación de estimulación de alta frecuencia a la sustancia negra izquierda puede inducir síntomas transitorios de depresión aguda. [25]
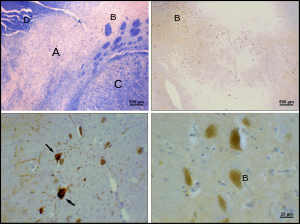
La enfermedad de Parkinson es una enfermedad neurodegenerativa caracterizada, en parte, por la muerte de neuronas dopaminérgicas en la SNpc. Los principales síntomas de la enfermedad de Parkinson incluyen temblor , acinesia , bradicinesia y rigidez. [26] Otros síntomas incluyen alteraciones de la postura, fatiga , anomalías del sueño y estado de ánimo deprimido . [27]
Se desconoce la causa de la muerte de las neuronas dopaminérgicas en la SNpc. Sin embargo, se han identificado algunas contribuciones a la susceptibilidad única de las neuronas dopaminérgicas en la pars compacta. Por un lado, las neuronas dopaminérgicas muestran anomalías en el complejo mitocondrial 1 , lo que provoca la agregación de alfa-sinucleína ; esto puede dar lugar a un manejo anormal de las proteínas y la muerte de las neuronas. [28] En segundo lugar, las neuronas dopaminérgicas en la pars compacta contienen menos calbindina que otras neuronas dopaminérgicas. [29] La calbindina es una proteína implicada en el transporte de iones de calcio dentro de las células, y el exceso de calcio en las células es tóxico. La teoría de la calbindina explicaría la alta citotoxicidad del Parkinson en la sustancia negra en comparación con el área tegmental ventral. Independientemente de la causa de la muerte neuronal, la plasticidad de la pars compacta es muy robusta; los síntomas parkinsonianos no aparecen generalmente hasta que al menos el 30% de las neuronas dopaminérgicas de la pars compacta han muerto. [30] La mayor parte de esta plasticidad ocurre a nivel neuroquímico; los sistemas de transporte de dopamina se ralentizan, lo que permite que la dopamina permanezca durante períodos más largos en las sinapsis químicas del cuerpo estriado. [31]
Menke, Jbabdi, Miller, Matthews y Zari (2010) utilizaron imágenes de tensor de difusión, así como mapeo T1 para evaluar las diferencias volumétricas en la SNpc y la SNpr, en participantes con Parkinson en comparación con individuos sanos. Estos investigadores encontraron que los participantes con Parkinson tenían consistentemente una sustancia negra más pequeña, específicamente en la SNpr. Debido a que la SNpr está conectada al tálamo posterior, al tálamo ventral y específicamente a la corteza motora, y debido a que los participantes con enfermedad de Parkinson reportan tener una SNprs más pequeña (Menke, Jbabdi, Miller, Matthews y Zari, 2010), el pequeño volumen de esta región puede ser responsable de las deficiencias motoras encontradas en pacientes con enfermedad de Parkinson. Este pequeño volumen puede ser responsable de movimientos motores más débiles y/o menos controlados, lo que puede resultar en los temblores que a menudo experimentan aquellos con Parkinson. [32]
El estrés oxidativo y el daño oxidativo en la SNpc son probablemente impulsores clave en la etiología de la enfermedad de Parkinson a medida que las personas envejecen. [33] Los daños del ADN causados por el estrés oxidativo pueden repararse mediante procesos modulados por la alfa-sinucleína . [34] La alfa-sinucleína se expresa en la sustancia negra, pero su función de reparación del ADN parece estar comprometida en las neuronas que contienen cuerpos de Lewy . [34] Esta pérdida puede desencadenar la muerte celular. [35] [36] [37]
Desde hace mucho tiempo se ha implicado a los niveles elevados de dopamina en el desarrollo de la esquizofrenia . [38] Sin embargo, hasta el día de hoy continúa habiendo mucho debate en torno a esta hipótesis de la dopamina en la esquizofrenia . A pesar de la controversia, los antagonistas de la dopamina siguen siendo un tratamiento estándar y exitoso para la esquizofrenia. Estos antagonistas incluyen antipsicóticos de primera generación (típicos) como las butirofenonas , las fenotiazinas y los tioxantenos . Estos fármacos han sido reemplazados en gran medida por antipsicóticos de segunda generación (atípicos) como la clozapina y la paliperidona . En general, estos fármacos no actúan sobre las neuronas productoras de dopamina en sí, sino sobre los receptores de la neurona postsináptica.
Otras evidencias no farmacológicas que apoyan la hipótesis de la dopamina relacionada con la sustancia negra incluyen cambios estructurales en la pars compacta, como la reducción del tamaño de la terminal sináptica. [39] Otros cambios en la sustancia negra incluyen una mayor expresión de receptores NMDA en la sustancia negra y una menor expresión de disbindina . El aumento de los receptores NMDA puede indicar la participación de las interacciones glutamato - dopamina en la esquizofrenia. La disbindina, que se ha relacionado (de manera controvertida) con la esquizofrenia, puede regular la liberación de dopamina, y la baja expresión de disbindina en la sustancia negra puede ser importante en la etiología de la esquizofrenia. [40] Debido a los cambios en la sustancia negra en el cerebro esquizofrénico, puede ser posible utilizar técnicas de imagen específicas (como la imagen específica de neuromelanina) para detectar signos fisiológicos de esquizofrenia en la sustancia negra. [41]
El síndrome de rigidez de la pared torácica por fentanilo, también llamado síndrome de rigidez de la pared torácica por fentanilo, es un efecto secundario poco frecuente de los opioides sintéticos como el fentanilo , el sulfentanilo, el alfentanilo y el remifentanilo . Produce un aumento generalizado del tono muscular esquelético . Se cree que el mecanismo es el aumento de la liberación de dopamina y la disminución de la liberación de GABA en los nervios de la sustancia negra/estriado. El efecto es más pronunciado en los músculos de la pared torácica y puede provocar una ventilación deficiente. La afección se observa con mayor frecuencia en la anestesia, en la que se administran dosis rápidas y altas de estos fármacos por vía intravenosa. [42] [43] [44]
La atrofia multisistémica caracterizada por la degeneración neuronal en el cuerpo estriado y la sustancia negra se denominaba anteriormente degeneración estriatonigral .
La manipulación y modificación química de la sustancia negra es importante en los campos de la neurofarmacología y la toxicología . Diversos compuestos, como la levodopa y el MPTP, se utilizan en el tratamiento y el estudio de la enfermedad de Parkinson, y muchos otros fármacos tienen efectos sobre la sustancia negra.
Los estudios han demostrado que, en ciertas regiones del cerebro, la anfetamina y las aminas traza aumentan las concentraciones de dopamina en la hendidura sináptica , aumentando así la respuesta de la neurona postsináptica. [45] Los diversos mecanismos por los cuales la anfetamina y las aminas traza afectan las concentraciones de dopamina se han estudiado ampliamente, y se sabe que involucran tanto a DAT como a VMAT2 . [45] [46] [47] La anfetamina es similar en estructura a la dopamina y las aminas traza; como consecuencia, puede ingresar a la neurona presináptica a través de DAT , así como difundiéndose a través de la membrana neuronal directamente. [45] Al ingresar a la neurona presináptica, la anfetamina y las aminas traza activan TAAR1 , que, a través de la señalización de la proteína quinasa , induce el eflujo de dopamina, la internalización de DAT dependiente de la fosforilación y la inhibición no competitiva de la recaptación. [45] [48] Debido a la similitud entre la anfetamina y las aminas traza, también es un sustrato para los transportadores de monoaminas; como consecuencia, inhibe (competitivamente) la recaptación de dopamina y otras monoaminas al competir con ellas por la captación también. [45]
Además, la anfetamina y las aminas traza son sustratos para el transportador de monoamina vesicular neuronal, el transportador de monoamina vesicular 2 (VMAT2). [47] Cuando la anfetamina es absorbida por el VMAT2 , la vesícula libera (efluye) moléculas de dopamina en el citosol a cambio. [47]
El mecanismo de acción de la cocaína en el cerebro humano incluye la inhibición de la recaptación de dopamina, [49] lo que explica las propiedades adictivas de la cocaína, ya que la dopamina es el neurotransmisor crítico para la recompensa. Sin embargo, la cocaína es más activa en las neuronas dopaminérgicas del área tegmental ventral que en la sustancia negra. La administración de cocaína aumenta el metabolismo en la sustancia negra, lo que puede explicar la función motora alterada observada en sujetos que consumen cocaína. [50] La inhibición de la recaptación de dopamina por la cocaína también inhibe la activación de potenciales de acción espontáneos por parte de la pars compacta. [51] El mecanismo por el cual la cocaína inhibe la recaptación de dopamina implica su unión a la proteína transportadora de dopamina . Sin embargo, los estudios muestran que la cocaína también puede causar una disminución en los niveles de ARNm de DAT , [52] muy probablemente debido a que la cocaína bloquea los receptores de dopamina en lugar de la interferencia directa con las vías transcripcionales o traduccionales. [52]
La inactivación de la sustancia negra podría ser un posible tratamiento para la adicción a la cocaína. En un estudio con ratas dependientes de la cocaína, la inactivación de la sustancia negra mediante cánulas implantadas redujo en gran medida la recaída en la adicción a la cocaína. [53]
La sustancia negra es el objetivo de la terapia química para el tratamiento de la enfermedad de Parkinson. La levodopa (comúnmente llamada L-DOPA), el precursor de la dopamina, es el medicamento más comúnmente prescrito para la enfermedad de Parkinson, a pesar de la controversia sobre la neurotoxicidad de la dopamina y la L-DOPA. [54] El fármaco es especialmente eficaz en el tratamiento de pacientes en las primeras etapas de Parkinson, aunque pierde su eficacia con el tiempo. [55] La levodopa puede atravesar la barrera hematoencefálica y aumenta los niveles de dopamina en la sustancia negra, aliviando así los síntomas de la enfermedad de Parkinson. El inconveniente del tratamiento con levodopa es que trata los síntomas de Parkinson (niveles bajos de dopamina), en lugar de la causa (la muerte de las neuronas dopaminérgicas en la sustancia negra).
La MPTP es una neurotoxina específica de las células dopaminérgicas del cerebro, concretamente de la sustancia negra. La MPTP cobró protagonismo en 1982, cuando unos consumidores de heroína de California mostraron síntomas parecidos a los del Parkinson tras consumir MPPP contaminada con MPTP. Los pacientes, que estaban rígidos y casi completamente inmóviles, respondieron al tratamiento con levodopa. No se informó de ninguna remisión de los síntomas parecidos a los del Parkinson, lo que sugiere una muerte irreversible de las neuronas dopaminérgicas. [56] El mecanismo propuesto de la MPTP implica la alteración de la función mitocondrial , incluida la alteración del metabolismo y la creación de radicales libres . [57]
Poco después, se probó el MPTP en modelos animales para determinar su eficacia en la inducción de la enfermedad de Parkinson (con éxito). El MPTP indujo acinesia, rigidez y temblor en primates, y se descubrió que su neurotoxicidad era muy específica de la pars compacta de la sustancia negra. [58] En otros animales, como los roedores, la inducción de Parkinson por MPTP es incompleta o requiere dosis mucho más altas y frecuentes que en los primates. Hoy en día, el MPTP sigue siendo el método más favorecido para inducir la enfermedad de Parkinson en modelos animales . [57] [59]
La sustancia negra fue descubierta en 1784 por Félix Vicq-d'Azyr , [60] y Samuel Thomas von Sömmerring aludió a esta estructura en 1791. [61] La diferenciación entre la sustancia negra pars reticulata y compacta fue propuesta por primera vez por Sano en 1910. [62] En 1963, Oleh Hornykiewicz concluyó a partir de su observación que "la pérdida de células en la sustancia negra (de los pacientes con enfermedad de Parkinson) bien podría ser la causa del déficit de dopamina en el cuerpo estriado". [63]
{{cite journal}}: CS1 maint: DOI inactivo a partir de junio de 2024 ( enlace ){{cite book}}: |journal=ignorado ( ayuda )