
La resistencia a las enfermedades de las plantas las protege de los patógenos de dos maneras: mediante estructuras y productos químicos preformados, y mediante respuestas del sistema inmunológico inducidas por infecciones. En relación con una planta susceptible, la resistencia a las enfermedades es la reducción del crecimiento de patógenos sobre o dentro de la planta (y, por lo tanto, una reducción de la enfermedad), mientras que el término tolerancia a las enfermedades describe plantas que exhiben poco daño por enfermedades a pesar de niveles sustanciales de patógenos. El resultado de la enfermedad está determinado por la interacción triple del patógeno, la planta y las condiciones ambientales (una interacción conocida como triángulo de la enfermedad ).
Los compuestos que activan las defensas pueden moverse de célula a célula y de forma sistemática a través del sistema vascular de la planta. Sin embargo, las plantas no tienen células inmunes circulantes , por lo que la mayoría de los tipos de células exhiben un amplio conjunto de defensas antimicrobianas . Aunque se pueden observar diferencias cualitativas obvias en la resistencia a las enfermedades cuando se comparan múltiples muestras (lo que permite clasificarlas como "resistentes" o "susceptibles" después de la infección por la misma cepa patógena con niveles de inóculo similares en ambientes similares), se puede establecer una gradación de diferencias cuantitativas en la resistencia a las enfermedades. Se observa más típicamente entre cepas o genotipos de plantas . Las plantas resisten consistentemente ciertos patógenos pero sucumben a otros; la resistencia suele ser específica de determinadas especies o cepas de patógenos.
La resistencia a las enfermedades de las plantas es crucial para la producción confiable de alimentos y proporciona reducciones significativas en el uso agrícola de la tierra, el agua, el combustible y otros insumos. Las plantas, tanto en poblaciones naturales como cultivadas, tienen una resistencia inherente a las enfermedades, pero esto no siempre las ha protegido.
La Gran Hambruna de Irlanda de la década de 1840 fue causada por el oomiceto Phytophthora infestans . El primer cultivar de banano cultivado en masa del mundo, Gros Michel, se perdió en la década de 1920 debido al mal de Panamá causado por el hongo Fusarium oxysporum . Las actuales epidemias de roya del tallo del trigo , roya de la hoja y roya rayada amarilla que se extienden desde África oriental hasta el subcontinente indio son causadas por los hongos de la roya Puccinia graminis y P. striiformis . Otras epidemias incluyen el tizón del castaño , así como enfermedades graves y recurrentes de las plantas, como el añublo del arroz , el nematodo del quiste de la soja y el cancro de los cítricos . [1] [2]
Los patógenos vegetales pueden propagarse rápidamente a grandes distancias, transmitidos por el agua, el viento, los insectos y los humanos. En grandes regiones y muchas especies de cultivos, se estima que las enfermedades suelen reducir el rendimiento de las plantas en un 10% cada año en los países o sistemas agrícolas más desarrollados, pero la pérdida de rendimiento debido a enfermedades a menudo supera el 20% en entornos menos desarrollados. [1]
Sin embargo, el control de enfermedades tiene un éxito razonable en la mayoría de los cultivos. El control de enfermedades se logra mediante el uso de plantas que han sido mejoradas para ofrecer una buena resistencia a muchas enfermedades y mediante enfoques de cultivo de plantas como la rotación de cultivos , semillas libres de patógenos, fecha de siembra y densidad de plantas apropiadas, control de la humedad del campo y uso de pesticidas .

El sistema inmunológico de las plantas lleva dos niveles de receptores interconectados, uno que detecta con mayor frecuencia moléculas fuera de la célula y el otro que detecta con mayor frecuencia moléculas dentro de la célula. Ambos sistemas detectan al intruso y responden activando las defensas antimicrobianas en la célula infectada y las células vecinas. En algunos casos, las señales que activan las defensas se propagan al resto de la planta o incluso a las plantas vecinas. Los dos sistemas detectan diferentes tipos de moléculas patógenas y clases de proteínas receptoras de plantas. [5] [6]
El primer nivel está gobernado principalmente por receptores de reconocimiento de patrones que se activan mediante el reconocimiento de patrones moleculares asociados a microbios o patógenos conservados evolutivamente (PAMP o MAMP). La activación de los PRR conduce a la señalización intracelular, la reprogramación transcripcional y la biosíntesis de una respuesta de salida compleja que limita la colonización. El sistema se conoce como inmunidad activada por PAMP o inmunidad activada por patrón (PTI). [7] [6] [8]
El segundo nivel, gobernado principalmente por los productos del gen R , a menudo se denomina inmunidad activada por efectores (ETI). La ETI generalmente se activa por la presencia de "efectores" de patógenos específicos y luego desencadena fuertes respuestas antimicrobianas (consulte la sección sobre el gen R a continuación).
Además de PTI y ETI, las defensas de las plantas pueden activarse mediante la detección de compuestos asociados al daño (DAMP), como porciones de la pared celular de la planta liberadas durante una infección patógena. [9]
Las respuestas activadas por los receptores PTI y ETI incluyen activación de canales iónicos , estallido oxidativo , cambios redox celulares o cascadas de proteína quinasa que activan directamente cambios celulares (como el refuerzo de la pared celular o la producción de antimicrobianos) o activan cambios en la expresión genética que luego elevan otras defensas. respuestas.
Los sistemas inmunológicos de las plantas muestran algunas similitudes mecanísticas con los sistemas inmunológicos de insectos y mamíferos, pero también exhiben muchas características específicas de las plantas. [10] Los dos niveles descritos anteriormente son fundamentales para la inmunidad de las plantas, pero no describen completamente los sistemas inmunológicos de las plantas. Además, muchos ejemplos específicos de aparente PTI o ETI violan definiciones comunes de PTI/ETI, lo que sugiere la necesidad de definiciones y/o paradigmas más amplios. [11]
El término resistencia cuantitativa (que se analiza a continuación) se refiere a la resistencia a enfermedades de las plantas que está controlada por múltiples genes y múltiples mecanismos moleculares, cada uno de los cuales tiene pequeños efectos sobre el rasgo de resistencia general. La resistencia cuantitativa a menudo se contrasta con la resistencia a ETI mediada por genes R de efecto principal único.
Muchos investigadores se refieren a las PAMP , moléculas conservadas que habitan en múltiples géneros de patógenos, como MAMP. Las defensas inducidas por la percepción de MAMP son suficientes para repeler a la mayoría de los patógenos. Sin embargo, las proteínas efectoras de patógenos (ver más abajo) están adaptadas para suprimir las defensas basales como la PTI. Se han descubierto muchos receptores para MAMP (y DAMP). Los MAMP y DAMP a menudo se detectan mediante receptores quinasas transmembrana que transportan dominios extracelulares LRR o LysM . [5]
La inmunidad desencadenada por efectores (ETI) se activa mediante la presencia de efectores patógenos. La respuesta ETI depende de los genes R y es activada por cepas patógenas específicas. La ETI de las plantas a menudo provoca una respuesta hipersensible apoptótica .
Las plantas han desarrollado genes R (genes de resistencia) cuyos productos median la resistencia a cepas específicas de virus, bacterias, oomicetos, hongos, nematodos o insectos. Los productos del gen R son proteínas que permiten el reconocimiento de efectores de patógenos específicos, ya sea mediante unión directa o mediante el reconocimiento de la alteración del efector de una proteína del huésped. [6] Muchos genes R codifican proteínas NB-LRR (proteínas con dominios repetidos de unión a nucleótidos y ricos en leucina , también conocidas como proteínas NLR o proteínas STAND, entre otros nombres). La mayoría de los sistemas inmunológicos de las plantas llevan un repertorio de 100 a 600 homólogos del gen R diferentes. Se ha demostrado que los genes R individuales median la resistencia a cepas específicas de virus, bacterias, oomicetos, hongos, nematodos o insectos. Los productos del gen R controlan un amplio conjunto de respuestas de resistencia a enfermedades cuya inducción suele ser suficiente para detener un mayor crecimiento o propagación de patógenos.
Los genes R estudiados generalmente confieren especificidad para cepas particulares de una especie de patógeno (aquellas que expresan el efector reconocido). Como señaló por primera vez Harold Flor en su formulación de mediados del siglo XX de la relación gen por gen , un gen R de una planta tiene especificidad por un gen de avirulencia de un patógeno (gen Avr). Ahora se sabe que los genes de avirulencia codifican efectores. El gen Avr del patógeno debe tener una especificidad coincidente con el gen R para que ese gen R confiera resistencia, lo que sugiere una interacción receptor/ ligando para los genes Avr y R. [10] Alternativamente, un efector puede modificar su objetivo celular huésped (o un señuelo molecular de ese objetivo), y el producto del gen R (proteína NLR) activa las defensas cuando detecta la forma modificada del objetivo o señuelo del huésped. [6] [12]
Los efectores son fundamentales para el potencial patógeno o simbiótico de los microbios y los animales microscópicos colonizadores de plantas, como los nematodos. [13] [14] [15] Los efectores generalmente son proteínas que se administran fuera del microbio y dentro de la célula huésped. Estos efectores derivados de colonos manipulan la fisiología y el desarrollo de las células del huésped. Como tales, los efectores ofrecen ejemplos de coevolución (ejemplo: una proteína fúngica que funciona fuera del hongo pero dentro de las células vegetales ha evolucionado para asumir funciones específicas de la planta). El rango de huéspedes patógenos está determinado, entre otras cosas, por la presencia de efectores apropiados que permitan la colonización de un huésped particular. [5] Los efectores derivados de patógenos son una herramienta poderosa para identificar funciones de las plantas que desempeñan papeles clave en las enfermedades y en la resistencia a ellas. Aparentemente, la mayoría de los efectores funcionan para manipular la fisiología del huésped para permitir que se produzca la enfermedad. Los patógenos bacterianos de plantas bien estudiados suelen expresar unas pocas docenas de efectores, a menudo administrados al huésped mediante un aparato de secreción de tipo III . [13] Los patógenos vegetales fúngicos, oomicetos y nematodos aparentemente expresan unos cientos de efectores. [14] [15]
Los llamados efectores "centrales" se definen operativamente por su amplia distribución entre la población de un patógeno particular y su contribución sustancial a la virulencia del patógeno. La genómica se puede utilizar para identificar efectores centrales, que luego se pueden utilizar para descubrir nuevos alelos del gen R , que se pueden utilizar en el fitomejoramiento para lograr resistencia a enfermedades.
Se entiende que las vías de ARNs de las plantas son componentes importantes de la inmunidad desencadenada por patrones moleculares asociados a patógenos (PAMP) (PTI) y de la inmunidad desencadenada por efectores (ETI). [16] [17] Se ha demostrado que los microARN (miARN) inducidos por bacterias en Arabidopsis influyen en la señalización hormonal, incluidas las auxinas, el ácido abscísico (ABA), el ácido jasmónico (JA) y el ácido salicílico (SA). [18] [19] Los avances en los estudios de todo el genoma revelaron una adaptación masiva de los patrones de expresión de miARN del huésped después de la infección por hongos patógenos Fusarium virguliforme , [20] Erysiphe graminis , [21] Verticillium dahliae , [22] y Cronartium quercuum , [23 ] y el oomiceto Phytophthora sojae . [24] Los cambios en la expresión del ARNs en respuesta a patógenos fúngicos indican que el silenciamiento genético puede estar involucrado en esta vía de defensa. Sin embargo, también hay evidencia de que la respuesta de defensa antifúngica frente a Colletotrichum spp. La infección en el maíz no está completamente regulada por la inducción de miARN específico, sino que puede actuar para ajustar el equilibrio entre los componentes genéticos y metabólicos tras la infección. [ cita necesaria ]
Es probable que el transporte de ARNs durante la infección se vea facilitado por vesículas extracelulares (EV) y cuerpos multivesiculares (MVB). [25] La composición del ARN en los vehículos eléctricos de las plantas no se ha evaluado completamente, pero es probable que sean, en parte, responsables del tráfico de ARN. Las plantas pueden transportar ARN virales, ARNm , miARN y pequeños ARN de interferencia (ARNip) sistémicamente a través del floema. [26] Se cree que este proceso ocurre a través de los plasmodesmos e involucra proteínas de unión a ARN que ayudan a la localización del ARN en las células del mesófilo. Aunque se han identificado en el floema con ARNm, no hay evidencia determinada de que median el transporte de ARN a larga distancia. [27] Por lo tanto, los vehículos eléctricos pueden contribuir a una vía alternativa de carga de ARN en el floema, o posiblemente podrían transportar ARN a través del apoplasto. [28] También hay evidencia de que los vehículos eléctricos de plantas pueden permitir la transferencia entre especies de ARNs mediante interferencia de ARN , como el silenciamiento genético inducido por el huésped (HIGS). [29] [30] El transporte de ARN entre plantas y hongos parece ser bidireccional, ya que se ha demostrado que los ARNs del hongo patógeno Botrytis cinerea se dirigen a genes de defensa del huésped en Arabidopsis y tomate. [31]
En un pequeño número de casos, los genes de las plantas son eficaces contra una especie patógena entera, aunque esa especie sea patógena para otros genotipos de esa especie huésped. Los ejemplos incluyen el MLO de cebada contra el mildiú polvoriento , el trigo Lr34 contra la roya de la hoja y el trigo Yr36 contra la roya lineal del trigo . Puede existir una variedad de mecanismos para este tipo de resistencia dependiendo del gen particular y la combinación de patógeno vegetal. Otras razones para una inmunidad vegetal eficaz pueden incluir una falta de coadaptación (el patógeno y/o la planta carecen de múltiples mecanismos necesarios para la colonización y el crecimiento dentro de esa especie huésped), o un conjunto particularmente eficaz de defensas preformadas. [ cita necesaria ]
La señalización de defensa de las plantas es activada por los receptores de detección de patógenos que se describen en la sección anterior. [5] Los receptores activados frecuentemente provocan producción reactiva de oxígeno y óxido nítrico , flujos de calcio , potasio y iones de protones , niveles alterados de ácido salicílico y otras hormonas y activación de MAP quinasas y otras proteínas quinasas específicas . [10] Estos eventos, a su vez, generalmente conducen a la modificación de proteínas que controlan la transcripción genética y a la activación de la expresión genética asociada a la defensa . [8]
Se han identificado numerosos genes y/o proteínas, así como otras moléculas, que median en la transducción de señales de defensa de las plantas. [32] [33] La dinámica del tráfico de vesículas y citoesqueletos ayuda a orientar las respuestas de defensa de las plantas hacia el punto de ataque del patógeno.
La actividad del sistema inmunológico de las plantas está regulada en parte por hormonas de señalización como: [34] [35]
Puede haber una importante interacción entre estas vías. [34]
Como ocurre con muchas vías de transducción de señales, la expresión de genes vegetales durante las respuestas inmunes puede regularse mediante degradación. Esto ocurre a menudo cuando la unión de hormonas a receptores hormonales estimula la degradación asociada a la ubiquitina de proteínas represoras que bloquean la expresión de ciertos genes. El resultado neto es la expresión genética activada por hormonas. Ejemplos: [36]
La ubiquitinación juega un papel central en la señalización celular que regula procesos que incluyen la degradación de proteínas y la respuesta inmunológica. [37] Aunque una de las funciones principales de la ubiquitina es apuntar a las proteínas para su destrucción, también es útil en vías de señalización, liberación de hormonas, apoptosis y translocación de materiales por toda la célula. La ubiquitinación es un componente de varias respuestas inmunes. Sin el correcto funcionamiento de la ubiquitina, la invasión de patógenos y otras moléculas dañinas aumentaría dramáticamente debido al debilitamiento de las defensas inmunes. [37]
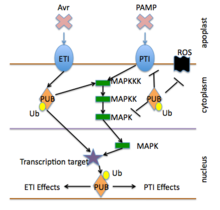
La enzima ubiquitina ligasa E3 es un componente principal que proporciona especificidad en las vías de degradación de proteínas, incluidas las vías de señalización inmunitaria. [36] Los componentes de la enzima E3 se pueden agrupar según los dominios que contienen e incluyen varios tipos. [38]
Estos incluyen la subunidad única Ring y U-box, HECT y CRL . [39] [40] Las vías de señalización de las plantas, incluidas las respuestas inmunitarias, están controladas por varias vías de retroalimentación, que a menudo incluyen retroalimentación negativa; y pueden ser regulados por enzimas de desubiquitinación, degradación de factores de transcripción y degradación de reguladores negativos de la transcripción. [36] [41]
Las diferencias en la resistencia a las enfermedades de las plantas son a menudo incrementales o cuantitativas más que cualitativas. El término resistencia cuantitativa (QR) se refiere a la resistencia a enfermedades de las plantas que está controlada por múltiples genes y múltiples mecanismos moleculares, cada uno de los cuales tiene efectos pequeños o menores sobre el rasgo de resistencia general. [42] La QR es importante en el fitomejoramiento porque la resistencia resultante suele ser más duradera (efectiva durante más años) y es más probable que sea eficaz contra la mayoría o todas las cepas de un patógeno en particular. La QR suele ser eficaz contra una especie de patógeno o un grupo de especies estrechamente relacionadas, en lugar de ser ampliamente eficaz contra múltiples patógenos. [42] El QR se obtiene a menudo mediante el fitomejoramiento sin conocimiento de los loci genéticos causales o los mecanismos moleculares. Es probable que la QR dependa de muchos de los componentes del sistema inmunológico de las plantas analizados en este artículo, así como de rasgos que son exclusivos de ciertas parejas de plantas y patógenos (como la sensibilidad a ciertos efectores de patógenos), así como de rasgos generales de las plantas, como la sensibilidad de las hojas. características de la superficie o sistema de raíces o arquitectura del dosel de la planta. El término QR es sinónimo de resistencia genética menor . [43]
La resistencia de las plantas adultas (APR) es un término especializado que se refiere a la resistencia cuantitativa que no es efectiva en la etapa de plántula, pero sí en muchas de las etapas restantes de crecimiento de las plantas. [43] [44] [42] La diferencia entre la resistencia de las plantas adultas y la resistencia de las plántulas es especialmente importante en los cultivos anuales . [45] La resistencia de las plántulas es una resistencia que comienza en la etapa de desarrollo de la planta y continúa durante toda su vida. Cuando lo utilizan los especialistas, el término no se refiere a la resistencia que sólo está activa durante la etapa de plántula. La "resistencia de las plántulas" pretende ser sinónimo de resistencia genética principal o resistencia en todas las etapas (ASR), y se utiliza como contraste con la "resistencia de las plantas adultas". [43] La resistencia de las plántulas a menudo está mediada por genes R únicos, pero no todos los genes R codifican la resistencia de las plántulas.
Los fitomejoradores enfatizan la selección y el desarrollo de líneas de plantas resistentes a enfermedades. Las enfermedades de las plantas también pueden controlarse parcialmente mediante el uso de pesticidas y prácticas de cultivo como la rotación de cultivos , la labranza, la densidad de siembra, semillas libres de enfermedades y limpieza de equipos, pero generalmente se prefieren las variedades de plantas con resistencia inherente (determinada genéticamente) a las enfermedades. [2] El mejoramiento genético para lograr resistencia a las enfermedades comenzó cuando las plantas fueron domesticadas por primera vez. Los esfuerzos de mejoramiento continúan porque las poblaciones de patógenos están bajo presión de selección y desarrollan una mayor virulencia, los patógenos se mueven (o son trasladados) a nuevas áreas, los cambios en las prácticas de cultivo o el clima favorecen a algunos patógenos y pueden reducir la eficacia de la resistencia, y el fitomejoramiento para otros rasgos puede alterar la resistencia anterior. . [46] Una línea de plantas con resistencia aceptable contra un patógeno puede carecer de resistencia contra otros.
El mejoramiento genético para la resistencia generalmente incluye:
La resistencia se considera duradera si continúa siendo eficaz durante varios años de uso generalizado a medida que evolucionan las poblaciones de patógenos. La " resistencia vertical " es específica de ciertas razas o cepas de una especie patógena, a menudo está controlada por genes R únicos y puede ser menos duradera. La resistencia horizontal o de amplio espectro contra una especie patógena entera a menudo no es completamente efectiva, pero es más duradera y a menudo está controlada por muchos genes que se segregan en las poblaciones reproductoras. [2] La durabilidad de la resistencia es importante incluso cuando se espera que futuras variedades mejoradas estén en camino: el tiempo promedio desde el reconocimiento humano de una nueva amenaza de enfermedad fúngica hasta la liberación de un cultivo resistente a ese patógeno es de al menos doce años. [47] [48]
Cultivos como la papa, la manzana, el plátano y la caña de azúcar a menudo se propagan mediante reproducción vegetativa para preservar variedades de plantas muy deseables, porque para estas especies, el cruzamiento altera seriamente los rasgos preferidos. Véase también propagación asexual . Los cultivos de propagación vegetativa pueden estar entre los mejores objetivos para mejorar la resistencia mediante el método biotecnológico de transformación de plantas para gestionar genes que afectan la resistencia a las enfermedades. [1]
El mejoramiento científico para la resistencia a enfermedades se originó con Sir Rowland Biffen , quien identificó un único gen recesivo para la resistencia a la roya amarilla del trigo. Luego, casi todos los cultivos fueron mejorados para incluir genes de resistencia a enfermedades (R), muchos de ellos mediante introgresión de parientes silvestres compatibles. [1]
El término transgénico ( "modificado genéticamente" ) se utiliza a menudo como sinónimo de transgénico para referirse a plantas modificadas mediante tecnologías de ADN recombinante. Las plantas con resistencia a enfermedades transgénicas/GM contra plagas de insectos han tenido un gran éxito como productos comerciales, especialmente en maíz y algodón, y se plantan anualmente en más de 20 millones de hectáreas en más de 20 países en todo el mundo [49] (ver también cultivos genéticamente modificados ). La resistencia a las enfermedades de las plantas transgénicas contra patógenos microbianos se demostró por primera vez en 1986. La expresión de secuencias genéticas de la proteína de la cubierta viral confería resistencia al virus a través de pequeños ARN . Este resultó ser un mecanismo ampliamente aplicable para inhibir la replicación viral. [50] Combinando genes de proteínas de cubierta de tres virus diferentes, los científicos desarrollaron híbridos de calabaza con resistencia multiviral validada en el campo. El mejoramiento convencional no había logrado niveles similares de resistencia a esta variedad de virus.
Se implementó una estrategia similar para combatir el virus de la mancha anular de la papaya , que en 1994 amenazaba con destruir la industria de la papaya de Hawaii . Las pruebas de campo demostraron una excelente eficacia y una alta calidad de la fruta. En 1998 se aprobó la venta de la primera papaya transgénica resistente a virus. La resistencia a las enfermedades ha sido duradera durante más de 15 años. La papaya transgénica representa aproximadamente el 85% de la producción hawaiana. La venta de la fruta está aprobada en EE.UU., Canadá y Japón.
Las líneas de papa que expresan secuencias virales de replicasa que confieren resistencia al virus del enrollamiento de la hoja de la papa se vendieron con los nombres comerciales NewLeaf Y y NewLeaf Plus, y fueron ampliamente aceptadas en la producción comercial entre 1999 y 2001, hasta que McDonald's Corp. decidió no comprar papas transgénicas y Monsanto decidió cerrar su negocio de patatas NatureMark. [51] Las patatas NewLeaf Y y NewLeaf Plus portaban dos rasgos transgénicos, ya que también expresaban resistencia mediada por Bt al escarabajo de la patata de Colorado.
Ningún otro cultivo con resistencia genética a enfermedades microbianas había llegado al mercado en 2013, aunque más de una docena se encontraban en algún estado de desarrollo y prueba.
La investigación dirigida a la resistencia diseñada sigue múltiples estrategias. Una es transferir PRR útiles a especies que carecen de ellos. La identificación de PRR funcionales y su transferencia a una especie receptora que carece de un receptor ortólogo podría proporcionar una vía general hacia repertorios de PRR adicionales ampliados. Por ejemplo, el receptor EF-Tu (EFR) PRR de Arabidopsis reconoce el factor de alargamiento de la traducción bacteriana EF-Tu . La investigación realizada en el Laboratorio Sainsbury demostró que la implementación de EFR en Nicotiana benthamiana o Solanum lycopersicum (tomate), que no pueden reconocer EF-Tu , confirió resistencia a una amplia gama de patógenos bacterianos. La expresión de EFR en tomate fue especialmente efectiva contra la devastadora y extendida bacteria del suelo Ralstonia solanacearum . [52] Por el contrario, el gen PRR Verticillium 1 ( Ve1 ) del tomate puede transferirse del tomate a Arabidopsis , donde confiere resistencia a los aislados de Verticillium de la raza 1 . [1]
La segunda estrategia intenta desplegar múltiples genes NLR simultáneamente, una estrategia de reproducción conocida como apilamiento. Los cultivares generados mediante mejoramiento molecular asistido por ADN o transferencia de genes probablemente mostrarán una resistencia más duradera, porque los patógenos tendrían que mutar múltiples genes efectores. La secuenciación de ADN permite a los investigadores “extraer” funcionalmente genes NLR de múltiples especies/cepas. [1]
El gen efector avrBs2 de Xanthomona perforans es el agente causal de la enfermedad de las manchas bacterianas del pimiento y el tomate. La primera búsqueda "racionalizada por el efector" de un gen R potencialmente duradero siguió al hallazgo de que avrBs2 se encuentra en la mayoría de las especies de Xanthomonas que causan enfermedades y es necesario para la aptitud del patógeno. El gen Bs2 NLR del pimiento silvestre, Capsicum chacoense , se trasladó al tomate, donde inhibió el crecimiento del patógeno. Las pruebas de campo demostraron una resistencia sólida sin productos químicos bactericidas. Sin embargo, cepas raras de Xanthomonas superaron la resistencia mediada por Bs2 en el pimiento mediante la adquisición de mutaciones avrBs2 que evitan el reconocimiento pero conservan la virulencia. El apilamiento de genes R, cada uno de los cuales reconoce un efector central diferente, podría retrasar o prevenir la adaptación. [1]
Más de 50 loci en cepas de trigo confieren resistencia a enfermedades contra los patógenos de la roya del tallo, la hoja y la roya amarilla. El gen NLR 35 ( Sr35 ) de la roya del tallo, clonado a partir de un pariente diploide del trigo cultivado, Triticum monococcum , proporciona resistencia al aislado de roya del trigo Ug99 . De manera similar, Sr33 , del pariente del trigo Aegilops tauschii , codifica un ortólogo del trigo para los genes de resistencia al mildiú polvoriento Mla de la cebada. Ambos genes son inusuales en el trigo y sus parientes. Combinados con el gen Sr2 que actúa de forma aditiva con al menos Sr33, podrían proporcionar una resistencia duradera a las enfermedades Ug99 y sus derivados. [1]
Otra clase de genes de resistencia a enfermedades de las plantas abre una “trampilla” que mata rápidamente las células invadidas, deteniendo la proliferación de patógenos. Los efectores similares al activador de la transcripción (TAL) de Xanthomonas y Ralstonia son proteínas de unión al ADN que activan la expresión del gen del huésped para mejorar la virulencia del patógeno. Tanto el linaje del arroz como el del pimiento desarrollaron de forma independiente sitios de unión efectores TAL que, en cambio, actúan como un verdugo que induce la muerte hipersensible de la célula huésped cuando se regula positivamente. Xa27 del arroz y Bs3 y Bs4c de la pimienta son genes "ejecutores" (o "verdugos") que codifican proteínas vegetales no homólogas de función desconocida. Los genes ejecutores se expresan sólo en presencia de un efector TAL específico. [1]
Se demostraron genes ejecutores diseñados rediseñando con éxito el promotor Bs3 del pimiento para que contenga dos sitios de unión adicionales para efectores TAL de cepas patógenas dispares. Posteriormente, se implementó en arroz un gen ejecutor diseñado mediante la adición de cinco sitios de unión efectores TAL al promotor Xa27 . La construcción sintética Xa27 confirió resistencia contra la plaga bacteriana Xanthomonas y las especies bacterianas de raya foliar. [1]
La mayoría de los patógenos de plantas reprograman los patrones de expresión de genes del huésped para beneficiar directamente al patógeno. Los genes reprogramados necesarios para la supervivencia y proliferación de patógenos pueden considerarse “genes de susceptibilidad a enfermedades”. Los genes de resistencia recesiva son candidatos a la susceptibilidad a enfermedades. Por ejemplo, una mutación desactivó un gen de Arabidopsis que codifica la pectato liasa (implicado en la degradación de la pared celular), lo que confiere resistencia al patógeno del oídio Golovinomyces cichoracearum . De manera similar, el gen MLO de la cebada y los ortólogos MLO de guisantes y tomates mutados espontáneamente también confieren resistencia al oídio. [1]
Lr34 es un gen que proporciona resistencia parcial a la roya amarilla y foliar y al mildiú polvoriento en el trigo. Lr34 codifica un transportador de casete de unión a trifosfato de adenosina (ATP) (ABC). El alelo dominante que proporciona resistencia a las enfermedades se encontró recientemente en el trigo cultivado (no en cepas silvestres) y, al igual que MLO, proporciona resistencia de amplio espectro en la cebada. [1]
Los alelos naturales de los factores de iniciación del alargamiento de la traducción del huésped eif4e y eif4g también son genes recesivos de resistencia viral. Algunos se han utilizado para controlar los potyvirus en la cebada, el arroz, el tomate, el pimiento, los guisantes, la lechuga y el melón. El descubrimiento impulsó una exitosa selección de mutantes para alelos eif4e inducidos químicamente en tomate. [1]
La variación del promotor natural puede conducir a la evolución de alelos recesivos de resistencia a enfermedades. Por ejemplo, el gen de resistencia recesiva xa13 del arroz es un alelo de Os-8N3 . Os-8N3 es activado transcripcionalmente por Xanthomonas oryzae pv. oryzae que expresan el efector TAL PthXo1 . El gen xa13 tiene un elemento de unión efector mutado en su promotor que elimina la unión de PthXo1 y hace que estas líneas sean resistentes a las cepas que dependen de PthXo1 . Este hallazgo también demostró que se requiere Os-8N3 para la susceptibilidad. [1]
Xa13/Os-8N3 es necesario para el desarrollo del polen, lo que demuestra que tales alelos mutantes pueden ser problemáticos si el fenotipo de susceptibilidad a la enfermedad altera la función en otros procesos. Sin embargo, las mutaciones en el elemento de unión efector TAL Os11N3 (OsSWEET14) se produjeron mediante la fusión de efectores TAL con nucleasas ( TALEN ). Las plantas de arroz editadas con genoma con sitios de unión Os11N3 alterados permanecieron resistentes a Xanthomonas oryzae pv. oryzae , pero todavía proporcionaba una función de desarrollo normal. [1]
La resistencia basada en el silenciamiento de ARN es una poderosa herramienta para diseñar cultivos resistentes. La ventaja del ARNi como nueva terapia genética contra infecciones fúngicas, virales y bacterianas en plantas radica en el hecho de que regula la expresión génica mediante la degradación del ARN mensajero , la represión de la traducción y la remodelación de la cromatina a través de pequeños ARN no codificantes. Mecánicamente, los procesos de silenciamiento son guiados por productos de procesamiento del activador del ARN bicatenario ( ARNds ), que se conocen como pequeños ARN de interferencia y microARN . [53]
Entre las miles de especies de microorganismos fitopatógenos, sólo una pequeña minoría tiene la capacidad de infectar una amplia gama de especies de plantas. En cambio, la mayoría de los patógenos exhiben un alto grado de especificidad de huésped. A menudo se dice que las especies de plantas no hospedantes expresan resistencia no hospedante . El término resistencia del huésped se utiliza cuando una especie patógena puede ser patógena para la especie huésped, pero ciertas cepas de esa especie de planta resisten ciertas cepas de la especie patógena. Las causas de la resistencia del huésped y de la resistencia del no huésped pueden superponerse. El rango de huéspedes patógenos está determinado, entre otras cosas, por la presencia de efectores apropiados que permitan la colonización de un huésped particular. [5] El rango de huéspedes del patógeno puede cambiar bastante repentinamente si, por ejemplo, la capacidad del patógeno para sintetizar una toxina o un efector específico del huésped se obtiene mediante mezcla/mutación de genes o mediante transferencia horizontal de genes . [54] [55]
Las poblaciones nativas a menudo se caracterizan por una diversidad genotípica sustancial y poblaciones dispersas (crecimiento en mezcla con muchas otras especies de plantas). También han sufrido una coevolución entre plantas y patógenos . Por lo tanto, mientras no se introduzcan o evolucionen nuevos patógenos, dichas poblaciones generalmente exhiben sólo una baja incidencia de epidemias de enfermedades graves . [56]
Los sistemas agrícolas de monocultivo proporcionan un ambiente ideal para la evolución de patógenos, porque ofrecen una alta densidad de especímenes objetivo con genotipos similares o idénticos. [56] El aumento de la movilidad derivado de los sistemas de transporte modernos proporciona a los patógenos acceso a más objetivos potenciales. [56] El cambio climático puede alterar el rango geográfico viable de especies patógenas y hacer que algunas enfermedades se conviertan en un problema en áreas donde antes eran menos importantes. [56]
Estos factores hacen que la agricultura moderna sea más propensa a epidemias de enfermedades. Las soluciones comunes incluyen el mejoramiento constante para lograr resistencia a las enfermedades, el uso de pesticidas, el uso de inspecciones fronterizas y restricciones a la importación de plantas, el mantenimiento de una diversidad genética significativa dentro del acervo genético de los cultivos (ver diversidad de cultivos ) y una vigilancia constante para acelerar el inicio de respuestas apropiadas. Algunas especies de patógenos tienen una capacidad mucho mayor que otras para superar la resistencia a las enfermedades de las plantas, a menudo debido a su capacidad de evolucionar rápidamente y dispersarse ampliamente. [56]
La plaga del castaño se notó por primera vez en los castaños americanos que crecían en lo que ahora se conoce como el Zoológico del Bronx en el año 1904. Durante los años posteriores a este incidente, se discutió cuál era la identidad del patógeno, así como la forma apropiada. aproximación a su control. Los primeros intentos de solucionar el problema de la castaña implicaron soluciones químicas o físicas. Intentaron usar fungicidas, cortar ramas de los árboles para detener la infección y eliminar completamente los árboles infectados de las viviendas para no permitir que infectaran a los demás. Todas estas estrategias terminaron sin éxito. Incluso se implementaron medidas de cuarentena que fueron favorecidas por la aprobación de la Ley de Cuarentena Vegetal. La plaga del castaño siguió siendo un gran problema, ya que se propagó rápidamente a través de los bosques de castaños densamente poblados. En 1914, se consideró la idea de inducir resistencia a la plaga en los árboles a través de diversos medios y mecanismos de reproducción diferentes. [57]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )