En química orgánica , la hiperconjugación ( σ-conjugación o resonancia sin enlace ) se refiere a la deslocalización de electrones con la participación de enlaces de carácter principalmente σ . Por lo general, la hiperconjugación implica la interacción de los electrones en un orbital sigma (σ) (por ejemplo, C–H o C–C) con un orbital p no enlazante o antienlazante σ* o π* adyacente despoblado para dar un par de orbitales moleculares extendidos . Sin embargo, a veces, los orbitales antienlazantes σ* bajos también pueden interactuar con orbitales llenos de carácter de par solitario (n) en lo que se denomina hiperconjugación negativa . [1] La mayor deslocalización de electrones asociada con la hiperconjugación aumenta la estabilidad del sistema. [2] [3] En particular, el nuevo orbital con carácter enlazante se estabiliza, lo que resulta en una estabilización general de la molécula. [4] Solo los electrones en enlaces que están en la posición β pueden tener este tipo de efecto estabilizador directo: donar desde un enlace sigma en un átomo a un orbital en otro átomo directamente unido a él. Sin embargo, las versiones extendidas de la hiperconjugación (como la hiperconjugación doble [5] ) también pueden ser importantes. El efecto Baker-Nathan , a veces utilizado como sinónimo de hiperconjugación, [6] es una aplicación específica de este efecto a ciertas reacciones químicas o tipos de estructuras. [7]
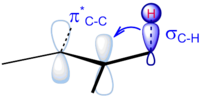
La hiperconjugación se puede utilizar para racionalizar una variedad de fenómenos químicos, incluyendo el efecto anomérico , el efecto gauche , la barrera rotacional del etano , el efecto beta-silicio , la frecuencia vibracional de los grupos carbonilo exocíclicos , y la estabilidad relativa de los carbocationes sustituidos y los radicales centrados en el carbono sustituidos , y la regla termodinámica de Zaitsev para la estabilidad de los alquenos. Más controvertidamente, la hiperconjugación es propuesta por el modelado mecánico cuántico como una mejor explicación para la preferencia de la conformación escalonada en lugar de la vieja noción de los libros de texto de impedimento estérico . [8] [9]
La hiperconjugación afecta varias propiedades. [6] [10]
La hiperconjugación se sugirió como la razón para la mayor estabilidad de los dobles enlaces carbono-carbono a medida que aumenta el grado de sustitución. Los primeros estudios sobre hiperconjugación fueron realizados por el grupo de investigación de George Kistiakowsky . Su trabajo, publicado por primera vez en 1937, fue concebido como un informe preliminar del progreso de los estudios termoquímicos de los cambios de energía durante las reacciones de adición de varios compuestos insaturados y cíclicos. La importancia de la hiperconjugación para explicar este efecto ha recibido apoyo de los cálculos químicos cuánticos. [12] Se cree que la interacción clave es la donación de densidad electrónica del enlace σ C–H vecino al orbital antienlazante π* del alqueno (σ C–H →π*). El efecto es casi un orden de magnitud más débil que el caso de la sustitución de alquilo en carbocationes (σ C–H →p C ), ya que un orbital p sin llenar tiene menor energía y, por lo tanto, se adapta mejor energéticamente a un enlace σ. Cuando este efecto se manifiesta en la formación del producto más sustituido en reacciones E1 controladas termodinámicamente, se conoce como regla de Zaitsev , aunque en muchos casos el producto cinético también sigue esta regla. ( Véase la regla de Hofmann para los casos en los que el producto cinético es el menos sustituido. )
Un conjunto de experimentos de Kistiakowsky implicó la recolección de datos de calores de hidrogenación durante reacciones en fase gaseosa de una variedad de compuestos que contenían una unidad de alqueno . Al comparar una variedad de alquenos mono -sustituidos con alquilo , encontraron que cualquier grupo alquilo aumentaba notablemente la estabilidad, pero que la elección de diferentes grupos alquilo específicos tenía poco o ningún efecto. [13]
Una parte del trabajo de Kistiakowsky implicó una comparación de otros compuestos insaturados en la forma de CH 2 =CH(CH 2 )n-CH=CH 2 (n = 0, 1, 2). Estos experimentos revelaron un resultado importante; cuando n = 0, hay un efecto de conjugación a la molécula donde el valor ΔH se reduce en 3,5 kcal . Esto se asemeja a la adición de dos grupos alquilo al etileno. Kistiakowsky también investigó los sistemas de cadena abierta, donde se encontró que el mayor valor de calor liberado era durante la adición a una molécula en la posición 1,4. Las moléculas cíclicas resultaron ser las más problemáticas, ya que se encontró que la tensión de la molécula tendría que ser considerada. La tensión de los anillos de cinco miembros aumentó con una disminución del grado de insaturación. Este fue un resultado sorprendente que se investigó más a fondo en trabajos posteriores con anhídridos de ácidos cíclicos y lactonas . También se estudiaron moléculas cíclicas como el benceno y sus derivados, ya que sus comportamientos eran diferentes al de otros compuestos insaturados. [13]
A pesar de la minuciosidad del trabajo de Kistiakowsky, no estaba completo y necesitaba más evidencia para respaldar sus hallazgos. Su trabajo fue un primer paso crucial para el inicio de las ideas de hiperconjugación y efectos de conjugación.
La conjugación del 1,3- butadieno fue evaluada por primera vez por Kistiakowsky, y se encontró una contribución conjugativa de 3,5 kcal/mol con base en la comparación energética de la hidrogenación entre especies conjugadas y análogos no conjugados. [13] Rogers, quien utilizó el método aplicado por primera vez por Kistiakowsky, informó que la estabilización de la conjugación del 1,3-butadieno fue cero, ya que la diferencia de Δ hyd H entre la primera y la segunda hidrogenación fue cero. Los calores de hidrogenación (Δ hyd H) se obtuvieron mediante el método de química cuántica computacional G3(MP2). [14]
Otro grupo dirigido por Houk [15] sugirió que los métodos empleados por Rogers y Kistiakowsky eran inadecuados, porque las comparaciones de calores de hidrogenación evalúan no solo los efectos de conjugación sino también otras diferencias estructurales y electrónicas. Obtuvieron -70,6 kcal/mol y -70,4 kcal/mol para la primera y segunda hidrogenación respectivamente mediante cálculo ab initio , lo que confirmó los datos de Rogers. Sin embargo, interpretaron los datos de manera diferente al tener en cuenta la estabilización de la hiperconjugación. Para cuantificar el efecto de la hiperconjugación, diseñaron las siguientes reacciones isodésmicas en 1-butino y 1-buteno .
La eliminación de las interacciones hiperconjugativas da como resultado estados virtuales con energías 4,9 y 2,4 kcal/mol superiores a las del 1-butino y el 1-buteno , respectivamente. El empleo de estos estados virtuales da como resultado una estabilización conjugativa de 9,6 kcal/mol para el 1,3-butadiino y de 8,5 kcal/mol para el 1,3-butadieno.
Un trabajo relativamente reciente (2006) de Fernández y Frenking (2006) resumió las tendencias en hiperconjugación entre varios grupos de moléculas acíclicas, utilizando análisis de descomposición de energía o EDA. Fernández y Frenking definen este tipo de análisis como "... un método que utiliza solo los orbitales pi de los fragmentos interactuantes en la geometría de la molécula para estimar las interacciones pi. [16] " Para este tipo de análisis, la formación de enlaces entre varias fracciones moleculares es una combinación de tres términos componentes. ΔE elstat representa lo que Fernández y Frenking llaman las "atracciones electrostáticas cuasiclásicas" de una molécula. [16] " El segundo término, ΔE Pauli , representa la repulsión de Pauli de la molécula. ΔE orb , el tercer término, representa interacciones estabilizadoras entre orbitales, y se define como la suma de ΔE pi y ΔE sigma . La energía total de interacción, ΔE int , es el resultado de la suma de los 3 términos. [16]
Un grupo cuyos valores ΔE pi fueron analizados muy exhaustivamente fue un grupo de enonas que variaban en sustituyente.

Fernández y Frenking informaron que los sustituyentes metilo , hidroxilo y amino resultaron en una disminución en ΔE pi del 2-propenal original . Por el contrario, los sustituyentes haluro de masa atómica creciente resultaron en un aumento de ΔE pi . Debido a que tanto el estudio de enonas como el análisis de Hammett estudian los efectos de los sustituyentes (aunque en especies diferentes), Fernández y Frenking sintieron que comparar los dos para investigar posibles tendencias podría brindar información significativa sobre sus propios resultados. Observaron una relación lineal entre los valores de ΔE pi para las enonas sustituidas y las constantes de Hammett correspondientes. Se encontró que la pendiente del gráfico era -51,67, con un coeficiente de correlación de -0,97 y una desviación estándar de 0,54. [16] Fernández y Frenking concluyen a partir de estos datos que "los efectos electrónicos de los sustituyentes R en la conjugación de pi en sistemas homo- y heteroconjugados son similares y, por lo tanto, parecen ser bastante independientes de la naturaleza del sistema conjugante". [16] [17]
Un ejemplo en el que la hiperconjugación puede pasarse por alto como una posible explicación química es la racionalización de la barrera rotacional del etano (C 2 H 6 ). Ya en la década de 1930 se había aceptado que las conformaciones escalonadas del etano eran más estables que la conformación eclipsada . Wilson había demostrado que la barrera de energía entre cualquier par de conformaciones eclipsadas y escalonadas es de aproximadamente 3 kcal/mol, y la justificación generalmente aceptada para esto eran las interacciones estéricas desfavorables entre los átomos de hidrógeno.

Sin embargo, en su artículo de 2001, Pophristic y Goodman [8] revelaron que esta explicación puede ser demasiado simplista. [18] Goodman se centró en tres factores físicos principales: interacciones hiperconjugativas, repulsión de intercambio definida por el principio de exclusión de Pauli e interacciones electrostáticas ( interacciones de Coulomb ). Al comparar una molécula de etano tradicional y una molécula de etano hipotética con todas las repulsiones de intercambio eliminadas, se prepararon curvas de potencial trazando el ángulo de torsión frente a la energía para cada molécula. El análisis de las curvas determinó que la conformación escalonada no tenía conexión con la cantidad de repulsiones electrostáticas dentro de la molécula. Estos resultados demuestran que las fuerzas de Coulomb no explican las conformaciones escalonadas favorecidas, a pesar del hecho de que el estiramiento del enlace central disminuye las interacciones electrostáticas. [8]
Goodman también realizó estudios para determinar la contribución de las interacciones vecinales (entre dos grupos metilo) y geminales (entre los átomos de un solo grupo metilo) a la hiperconjugación. En experimentos separados, se eliminaron las interacciones geminales y vecinales y se dedujo el confórmero más estable para cada interacción. [8]
A partir de estos experimentos, se puede concluir que los efectos hiperconjugativos deslocalizan la carga y estabilizan la molécula. Además, son los efectos hiperconjugativos vecinales los que mantienen la molécula en la conformación escalonada. [8] Gracias a este trabajo, el siguiente modelo de estabilización de la conformación escalonada del etano es ahora más aceptado:

La hiperconjugación también puede explicar varios otros fenómenos cuyas explicaciones pueden no ser tan intuitivas como la de la barrera rotacional del etano. [18]
La cuestión de la barrera rotacional del etano no está resuelta en la comunidad científica. Un análisis dentro de la teoría cuantitativa de orbitales moleculares muestra que las repulsiones de 2 orbitales y 4 electrones (estéricas) son dominantes sobre la hiperconjugación. [19] Un estudio de la teoría del enlace de valencia también enfatiza la importancia de los efectos estéricos. [20]