
En genética , una deleción (también llamada deleción génica , deficiencia o mutación por deleción ) (signo: Δ ) es una mutación (una aberración genética) en la que una parte de un cromosoma o una secuencia de ADN se omite durante la replicación del ADN. Se puede eliminar cualquier número de nucleótidos , desde una sola base hasta un trozo entero de cromosoma. [1] Algunos cromosomas tienen puntos frágiles donde se producen roturas, lo que da como resultado la eliminación de una parte del cromosoma. Las roturas pueden ser inducidas por calor, virus, radiación o reacciones químicas. Cuando un cromosoma se rompe, si se elimina o pierde una parte de él, la pieza faltante del cromosoma se conoce como deleción o deficiencia. [2]
Para que se produzca una sinapsis entre un cromosoma con una gran deficiencia intercalar y un homólogo completo normal, la región desapareada del homólogo normal debe salir de la estructura lineal hacia un bucle de deleción o compensación .
Las mutaciones de eliminación de una sola base más pequeñas ocurren por una inversión de una sola base en el ADN molde, seguida por un deslizamiento de la cadena de ADN molde, dentro del sitio activo de la ADN polimerasa. [3] [4] [5]
Las deleciones pueden ser causadas por errores en el entrecruzamiento cromosómico durante la meiosis , lo que causa varias enfermedades genéticas graves . Las deleciones que no ocurren en múltiplos de tres bases pueden causar un desplazamiento del marco de lectura al cambiar el marco de lectura de la proteína de 3 nucleótidos de la secuencia genética. Las deleciones son representativas de los organismos eucariotas , incluidos los humanos, y no de los organismos procariotas , como las bacterias.
Las causas incluyen las siguientes:
Los tipos de eliminación incluyen los siguientes:
La microdeleción suele encontrarse en niños con anomalías físicas. Una gran cantidad de deleción daría lugar a un aborto inmediato (aborto espontáneo).

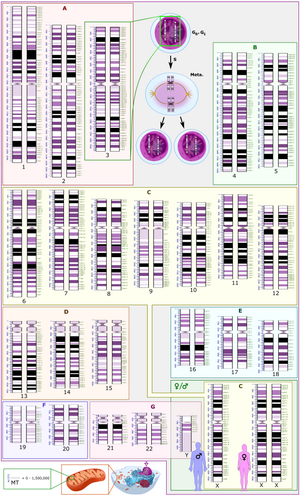
El Sistema Internacional de Nomenclatura Citogenómica Humana (ISCN) es un estándar internacional para la nomenclatura de los cromosomas humanos , que incluye nombres de bandas, símbolos y términos abreviados utilizados en la descripción de los cromosomas humanos y las anomalías cromosómicas. Las abreviaturas incluyen un signo menos (−) para las deleciones cromosómicas y del para las deleciones de partes de un cromosoma. [7]
Las deleciones pequeñas tienen menos probabilidades de ser fatales; las deleciones grandes suelen ser fatales; siempre hay variaciones en función de los genes que se pierden. Algunas deleciones de tamaño mediano provocan trastornos humanos reconocibles, por ejemplo, el síndrome de Williams .
La eliminación de un número de pares que no sea divisible por tres dará lugar a una mutación por desplazamiento del marco de lectura , lo que hará que todos los codones que se produzcan después de la eliminación se lean de forma incorrecta durante la traducción , lo que producirá una proteína gravemente alterada y potencialmente no funcional . Por el contrario, una eliminación que sea divisible por tres se denomina eliminación en el marco de lectura . [8]
Las deleciones son responsables de una variedad de trastornos genéticos, incluidos algunos casos de infertilidad masculina , dos tercios de los casos de distrofia muscular de Duchenne , [1] y dos tercios de los casos de fibrosis quística (aquellos causados por ΔF508 ). [9] La eliminación de parte del brazo corto del cromosoma 5 da como resultado el síndrome de Cri du chat . [1] Las deleciones en el gen que codifica SMN causan atrofia muscular espinal , la causa genética más común de muerte infantil.
Las microdeleciones están asociadas con muchas enfermedades diferentes, entre ellas el síndrome de Angelman, el síndrome de Prader-Willi y el síndrome de DiGeorge. [10] Algunos síndromes, entre ellos el síndrome de Angelman y el síndrome de Prader-Willi, están asociados tanto con microdeleciones como con impronta genómica, lo que significa que la misma microdeleción puede causar dos síndromes diferentes según el progenitor del que provenga la deleción. [11]
Trabajos recientes sugieren que algunas deleciones de secuencias altamente conservadas (CONDEL) pueden ser responsables de las diferencias evolutivas presentes entre especies estrechamente relacionadas. Dichas deleciones en humanos, conocidas como hCONDEL , pueden ser responsables de las diferencias anatómicas y de comportamiento entre humanos, chimpancés y otras variedades de mamíferos como simios o monos. [12]
Una reciente clasificación exhaustiva a nivel de paciente y cuantificación de eventos impulsores en cohortes de TCGA reveló que hay en promedio 12 eventos impulsores por tumor, de los cuales 2,1 son deleciones de supresores tumorales . [13]
La introducción de técnicas moleculares en conjunción con métodos citogenéticos clásicos ha mejorado en gran medida en los últimos años el potencial diagnóstico de anomalías cromosómicas. En particular, la hibridación genómica comparativa de microarrays (CGH) basada en el uso de clones BAC promete una estrategia sensible para la detección de cambios en el número de copias de ADN a escala de todo el genoma. La resolución de detección podría ser tan alta como >30.000 "bandas" y el tamaño de la deleción cromosómica detectada podría ser tan pequeño como 5-20 kb de longitud. [14] Se seleccionaron otros métodos de cálculo para descubrir errores de deleción en la secuenciación de ADN, como el perfil de secuencia final . [15] [16]
En la levadura Saccharomyces cerevisiae , los genes nucleares Rad51 p, Rad52 p y Rad59p codifican proteínas que son necesarias para la reparación recombinatoria y se emplean en la reparación de roturas de doble cadena en el ADN mitocondrial . [17] La pérdida de estas proteínas disminuye la tasa de eventos de eliminación espontánea de ADN en las mitocondrias. [17] Este hallazgo implica que la reparación de roturas de doble cadena de ADN por recombinación homóloga es un paso en la formación de deleciones de ADN mitocondrial.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )