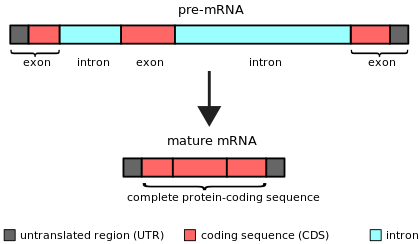
Un intrón es cualquier secuencia de nucleótidos dentro de un gen que no se expresa ni es operativa en el producto final de ARN. La palabra intrón se deriva del término región intragénica , es decir , una región dentro de un gen. [1] El término intrón se refiere tanto a la secuencia de ADN dentro de un gen como a la secuencia de ARN correspondiente en las transcripciones de ARN . [2] Las secuencias no intrones que se unen mediante este procesamiento de ARN para formar el ARN maduro se denominan exones . [3]
Los intrones se encuentran en los genes de la mayoría de los organismos y de muchos virus y pueden ubicarse tanto en genes que codifican proteínas como en genes que funcionan como ARN (genes no codificantes). Hay cuatro tipos principales de intrones: intrones de ARNt, intrones del grupo I, intrones del grupo II e intrones espliceosómicos (ver más abajo). Los intrones son raros en bacterias y arqueas (procariotas), pero la mayoría de los genes eucarióticos contienen múltiples intrones espliceosómicos.
Los intrones se descubrieron por primera vez en genes codificadores de proteínas de adenovirus , [4] [5] y posteriormente se identificaron en genes que codifican genes de ARN de transferencia y ARN ribosómico. Ahora se sabe que los intrones se encuentran en una amplia variedad de genes en organismos, bacterias [6] y virus en todos los reinos biológicos.
El hecho de que los genes fueran divididos o interrumpidos por intrones fue descubierto de forma independiente en 1977 por Phillip Allen Sharp y Richard J. Roberts , por lo que compartieron el Premio Nobel de Fisiología o Medicina en 1993. [7] El término intrón fue introducido por un bioquímico estadounidense Walter Gilbert : [1]
"La noción de cistrón [es decir, gen]... debe ser reemplazada por la de una unidad de transcripción que contenga regiones que se perderán del mensajero maduro – que sugiero que llamemos intrones (para regiones intragénicas) – alternando con regiones que se expresará – exones." (Gilbert 1978)
El término intrón también se refiere al intracistrón , es decir, una pieza adicional de ADN que surge dentro de un cistrón . [8]
Aunque a los intrones a veces se les llama secuencias intermedias , [9] el término "secuencia intermedia" puede referirse a cualquiera de varias familias de secuencias de ácidos nucleicos internas que no están presentes en el producto génico final, incluidas las inteínas , las regiones no traducidas (UTR) y los nucleótidos. eliminado mediante edición de ARN , además de los intrones.
Se observa que la frecuencia de intrones dentro de diferentes genomas varía ampliamente en todo el espectro de organismos biológicos. Por ejemplo, los intrones son extremadamente comunes en el genoma nuclear de los vertebrados con mandíbulas (por ejemplo, humanos, ratones y peces globo (fugu)), donde los genes que codifican proteínas casi siempre contienen múltiples intrones, mientras que los intrones son raros en los genes nucleares de algunos microorganismos eucariotas. , [10] por ejemplo levadura de panadería/cerveza ( Saccharomyces cerevisiae ). Por el contrario, los genomas mitocondriales de los vertebrados carecen por completo de intrones, mientras que los de los microorganismos eucariotas pueden contener muchos intrones. [11]
Un caso particularmente extremo es el gen dhc7 de Drosophila que contiene un intrón de ≥3,6 megabase (Mb), cuya transcripción tarda aproximadamente tres días. [12] [13] En el otro extremo, un estudio de 2015 sugiere que la longitud de intrón de metazoo más corta conocida es de 30 pares de bases (pb) que pertenecen al gen humano MST1L . [14] Los intrones más cortos conocidos pertenecen a los ciliados heterotricos , como Stentor coeruleus , en el que la mayoría (>95%) de los intrones tienen 15 o 16 pb de largo. [15]
El empalme de todas las moléculas de ARN que contienen intrones es superficialmente similar, como se describió anteriormente. Sin embargo, se identificaron diferentes tipos de intrones mediante el examen de la estructura de los intrones mediante análisis de secuencia de ADN, junto con análisis genéticos y bioquímicos de reacciones de empalme de ARN. Se han identificado al menos cuatro clases distintas de intrones:
Se propone que los intrones del grupo III sean una quinta familia, pero se sabe poco sobre el aparato bioquímico que media en su empalme. Parecen estar relacionados con intrones del grupo II y posiblemente con intrones espliceosómicos. [dieciséis]
Los intrones nucleares pre-ARNm (intrones espliceosómicos) se caracterizan por secuencias de intrones específicas ubicadas en los límites entre intrones y exones. [17] Estas secuencias son reconocidas por las moléculas de ARN espliceosómico cuando se inician las reacciones de empalme. [18] Además, contienen un punto de ramificación, una secuencia de nucleótidos particular cerca del extremo 3' del intrón que se une covalentemente al extremo 5' del intrón durante el proceso de empalme, generando una ramificación ( lariat ) [ aclaración necesaria (jerga complicada) ] intrón. Aparte de estos tres elementos conservados brevemente, las secuencias de intrones del pre-ARNm nuclear son muy variables. Los intrones nucleares del pre-ARNm suelen ser mucho más largos que los exones que los rodean.
Los intrones de ARN de transferencia que dependen de proteínas para su eliminación se producen en una ubicación específica dentro del bucle anticodón de los precursores de ARNt no empalmados y se eliminan mediante una endonucleasa de empalme de ARNt. Luego, los exones se unen entre sí mediante una segunda proteína, la ligasa de empalme de ARNt. [19] Tenga en cuenta que los intrones de autoempalme también se encuentran a veces dentro de los genes de ARNt. [20]
Los intrones del grupo I y del grupo II se encuentran en genes que codifican proteínas ( ARN mensajero ), ARN de transferencia y ARN ribosómico en una gama muy amplia de organismos vivos. [21] [22] Después de la transcripción en ARN, los intrones del grupo I y del grupo II también realizan extensas interacciones internas que les permiten plegarse en una arquitectura tridimensional compleja y específica . Estas arquitecturas complejas permiten que algunos intrones del grupo I y del grupo II se autoempalmen , es decir, la molécula de ARN que contiene el intrón puede reorganizar su propia estructura covalente para eliminar con precisión el intrón y unir los exones en el orden correcto. En algunos casos, determinadas proteínas de unión a intrones participan en el empalme, actuando de tal manera que ayudan al intrón a plegarse en la estructura tridimensional necesaria para la actividad de autoempalme. Los intrones del grupo I y del grupo II se distinguen por diferentes conjuntos de secuencias internas conservadas y estructuras plegadas, y por el hecho de que el corte y empalme de moléculas de ARN que contienen intrones del grupo II genera intrones ramificados (como los de los ARN espliceosómicos), mientras que los intrones del grupo I utilizan un -nucleótido de guanosina codificado (típicamente GTP) para iniciar el empalme, agregándolo al extremo 5' del intrón extirpado.
El espliceosoma es una estructura muy compleja que contiene hasta cien proteínas y cinco ARN diferentes. El sustrato de la reacción es una molécula de ARN larga y las reacciones de transesterificación catalizadas por el espliceosoma requieren la unión de sitios que pueden estar separados por miles de nucleótidos. [23] [24] Todas las reacciones bioquímicas están asociadas con tasas de error conocidas y cuanto más complicada es la reacción, mayor es la tasa de error. Por lo tanto, no es sorprendente que la reacción de empalme catalizada por el empalme tenga una tasa de error significativa, incluso aunque existen factores accesorios del empalme que suprimen la escisión accidental de los sitios de empalme crípticos. [25]
En circunstancias ideales, es probable que la reacción de empalme tenga una precisión del 99,999 % (tasa de error de 10 −5 ), se unirán los exones correctos y se eliminará el intrón correcto. [26] Sin embargo, estas condiciones ideales requieren coincidencias muy cercanas con las mejores secuencias del sitio de empalme y la ausencia de secuencias crípticas competitivas del sitio de empalme dentro de los intrones y esas condiciones rara vez se cumplen en genes eucarióticos grandes que pueden cubrir más de 40 pares de kilobases. Estudios recientes han demostrado que la tasa de error real puede ser considerablemente superior a 10 −5 y puede llegar al 2% o 3% de errores (tasa de error de 2 o 3 x 10 −2 ) por gen. [27] [28] [29] Estudios adicionales sugieren que la tasa de error no es inferior al 0,1% por intrón. [30] [31] Este nivel relativamente alto de errores de empalme explica por qué la mayoría de las variantes de empalme se degradan rápidamente por una descomposición mediada por sin sentido. [32] [33]
La presencia de sitios de unión descuidados dentro de los genes provoca errores de empalme y puede parecer extraño que estos sitios no hayan sido eliminados por la selección natural. El argumento a favor de su persistencia es similar al argumento a favor del ADN basura. [30] [34]
Aunque las mutaciones que crean o alteran los sitios de unión pueden ser ligeramente perjudiciales, el gran número de posibles mutaciones hace inevitable que algunas alcancen la fijación en una población. Esto es particularmente relevante en especies, como los humanos, con tamaños de población efectivos a largo plazo relativamente pequeños. Es posible, entonces, que el genoma humano contenga una carga sustancial de secuencias subóptimas que provoquen la generación de isoformas de transcripción aberrantes. En este estudio, presentamos evidencia directa de que este es efectivamente el caso. [30]
Si bien la reacción catalítica puede ser lo suficientemente precisa para un procesamiento eficaz la mayor parte del tiempo, la tasa de error general puede estar limitada en parte por la fidelidad de la transcripción porque los errores de transcripción introducirán mutaciones que crean sitios de empalme crípticos. Además, la tasa de error de transcripción de 10 −5 – 10 −6 es lo suficientemente alta como para que uno de cada 25.000 exones transcritos tenga un error de incorporación en uno de los sitios de empalme que conduzca a un intrón o exón omitido. Casi todos los genes multiexones producirán transcripciones empalmadas incorrectamente, pero la frecuencia de este ruido de fondo dependerá del tamaño de los genes, la cantidad de intrones y la calidad de las secuencias del sitio de empalme. [28] [31]
En algunos casos, las variantes de empalme se producirán mediante mutaciones en el gen (ADN). Estos pueden ser polimorfismos de SNP que crean un sitio de empalme críptico o mutan un sitio funcional. También pueden ser mutaciones de células somáticas que afectan el empalme en un tejido o línea celular en particular. [35] [36] [37] Cuando el alelo mutante está en un estado heterocigoto, esto dará como resultado la producción de dos variantes de empalme abundantes; uno funcional y otro no funcional. En el estado homocigoto, los alelos mutantes pueden causar una enfermedad genética como la hemofilia que se encuentra en los descendientes de la reina Victoria, donde una mutación en uno de los intrones en un gen del factor de coagulación sanguínea crea un sitio de empalme 3' críptico que resulta en un empalme aberrante. [38] Una fracción significativa de las muertes humanas por enfermedades puede ser causada por mutaciones que interfieren con el empalme normal; principalmente creando sitios de empalme crípticos. [39] [36]
Las transcripciones empalmadas incorrectamente pueden detectarse fácilmente y sus secuencias ingresarse en las bases de datos en línea. Por lo general, se describen como transcripciones "empalmadas alternativamente", lo que puede resultar confuso porque el término no distingue entre empalme alternativo real, biológicamente relevante y ruido de procesamiento debido a errores de empalme. Una de las cuestiones centrales en el campo del empalme alternativo es resolver las diferencias entre estas dos posibilidades. Muchos científicos han argumentado que la hipótesis nula debería ser el ruido del empalme, colocando la carga de la prueba sobre aquellos que afirman que existe un empalme alternativo biológicamente relevante. Según esos científicos, la afirmación de función debe ir acompañada de pruebas convincentes de que se producen múltiples productos funcionales a partir del mismo gen. [40] [41]
Si bien los intrones no codifican productos proteicos, son parte integral de la regulación de la expresión genética. Algunos intrones codifican ARN funcionales mediante un procesamiento adicional después del empalme para generar moléculas de ARN no codificantes . [42] El empalme alternativo se utiliza ampliamente para generar múltiples proteínas a partir de un solo gen. Además, algunos intrones desempeñan funciones esenciales en una amplia gama de funciones reguladoras de la expresión génica, como la descomposición mediada por sin sentido [43] y la exportación de ARNm. [44]
Después del descubrimiento inicial de intrones en genes codificadores de proteínas del núcleo eucariota, hubo un importante debate sobre si los intrones en los organismos modernos se heredaron de un ancestro antiguo común (denominado hipótesis temprana de los intrones), o si aparecieron en genes más recientemente en el proceso evolutivo (lo que se denomina hipótesis de los intrones tardíos). Otra teoría es que el espliceosoma y la estructura intrón-exón de los genes son una reliquia del mundo del ARN (la hipótesis de los intrones primero). [45] Todavía existe un debate considerable sobre hasta qué punto cuál de estas hipótesis es más correcta, pero el consenso popular en este momento es que después de la formación de la primera célula eucariota, los intrones del grupo II del endosimbionte bacteriano invadieron el genoma del huésped. Al principio, estos intrones de autoempalme se escindían del precursor de ARNm, pero con el tiempo algunos de ellos perdieron esa capacidad y su escisión tuvo que ser ayudada en trans por otros intrones del grupo II. Con el tiempo, evolucionaron varios intrones de acción trans específicos que se convirtieron en los precursores de los snRNA del espliceosoma. La eficiencia del empalme mejoró mediante la asociación con proteínas estabilizadoras para formar el espliceosoma primitivo. [46] [47] [48] [49]
Los primeros estudios de secuencias de ADN genómico de una amplia gama de organismos muestran que la estructura intrón-exón de genes homólogos en diferentes organismos puede variar ampliamente. [50] Estudios más recientes de genomas eucarióticos completos han demostrado que las longitudes y densidad (intrones/gen) de los intrones varían considerablemente entre especies relacionadas. Por ejemplo, mientras que el genoma humano contiene un promedio de 8,4 intrones/gen (139.418 en el genoma), el hongo unicelular Encephalitozoon cuniculi contiene sólo 0,0075 intrones/gen (15 intrones en el genoma). [51] Dado que los eucariotas surgieron de un ancestro común ( descendencia común ), debe haber habido una gran ganancia o pérdida de intrones durante el tiempo evolutivo. [52] [53] Se cree que este proceso está sujeto a selección, con una tendencia hacia la ganancia de intrones en especies más grandes debido a sus poblaciones más pequeñas, y lo contrario en especies más pequeñas (particularmente unicelulares). [54] Los factores biológicos también influyen en qué genes de un genoma pierden o acumulan intrones. [55] [56] [57]
El corte y empalme alternativo de exones dentro de un gen después de la escisión del intrón actúa para introducir una mayor variabilidad de las secuencias de proteínas traducidas de un solo gen, lo que permite generar múltiples proteínas relacionadas a partir de un solo gen y una única transcripción de ARNm precursor. El control del empalme alternativo del ARN se realiza mediante una compleja red de moléculas de señalización que responden a una amplia gama de señales intracelulares y extracelulares.
Los intrones contienen varias secuencias cortas que son importantes para un empalme eficiente, como sitios aceptores y donantes en cada extremo del intrón, así como un sitio de punto de ramificación, que son necesarios para un empalme adecuado por parte del espliceosoma . Se sabe que algunos intrones mejoran la expresión del gen que los contiene mediante un proceso conocido como mejora mediada por intrones (IME).
Las regiones de ADN transcritas activamente con frecuencia forman bucles R que son vulnerables al daño del ADN . En genes de levadura altamente expresados, los intrones inhiben la formación de bucles R y la aparición de daños en el ADN. [58] El análisis de todo el genoma tanto en levaduras como en humanos reveló que los genes que contienen intrones tienen niveles reducidos de bucle R y daño en el ADN en comparación con genes sin intrones de expresión similar. [ 58] La inserción de un intrón dentro de un gen propenso al bucle R también puede suprimir la formación y recombinación del bucle R. Bonnet et al. (2017) [58] especularon que la función de los intrones en el mantenimiento de la estabilidad genética puede explicar su mantenimiento evolutivo en ciertos lugares, particularmente en genes altamente expresados.
La presencia física de intrones promueve la resistencia celular a la inanición a través de la represión mejorada por intrones de genes de proteínas ribosómicas de las vías de detección de nutrientes. [59]
Los intrones pueden perderse o ganarse a lo largo del tiempo evolutivo, como lo demuestran muchos estudios comparativos de genes ortólogos . Análisis posteriores han identificado miles de ejemplos de eventos de pérdida y ganancia de intrones, y se ha propuesto que la aparición de eucariotas, o las etapas iniciales de la evolución eucariota, implicó una invasión de intrones. [60] Se han identificado dos mecanismos definitivos de pérdida de intrones, la pérdida de intrones mediada por transcriptasa inversa (RTMIL) y las deleciones genómicas, y se sabe que ocurren. [61] Sin embargo, los mecanismos definitivos de ganancia de intrones siguen siendo difíciles de alcanzar y controvertidos. Hasta ahora se han informado al menos siete mecanismos de ganancia de intrones: transposición de intrones, inserción de transposones, duplicación genómica en tándem, transferencia de intrones, ganancia de intrones durante la reparación de rotura de doble hebra (DSBR), inserción de un intrón del grupo II e intronización. En teoría, debería ser más fácil deducir el origen de los intrones adquiridos recientemente debido a la falta de mutaciones inducidas por el huésped, pero ni siquiera los intrones obtenidos recientemente surgieron de ninguno de los mecanismos antes mencionados. Por lo tanto, estos hallazgos plantean la cuestión de si los mecanismos propuestos de ganancia de intrones no logran describir el origen mecanicista de muchos intrones nuevos porque no son mecanismos precisos de ganancia de intrones, o si hay otros procesos, aún por descubrir, que generan nuevos intrones. intrones. [62]
En la transposición de intrones, el mecanismo de ganancia de intrones más comúnmente pretendido, se cree que un intrón empalmado invierte el empalme en su propio ARNm u otro ARNm en una posición que antes no tenía intrones. Este ARNm que contiene un intrón luego se transcribe de manera inversa y el ADNc que contiene un intrón resultante puede causar una ganancia de intrón mediante una recombinación completa o parcial con su locus genómico original. Las inserciones de transposones también pueden dar lugar a la creación de intrones. Tal inserción podría intronizar el transposón sin alterar la secuencia codificante cuando un transposón se inserta en la secuencia AGGT, dando como resultado la duplicación de esta secuencia en cada lado del transposón. Aún no se comprende por qué estos elementos se empalman, ya sea por casualidad o por alguna acción preferencial del transposón. En la duplicación genómica en tándem, debido a la similitud entre los sitios de empalme donante y aceptor de consenso, que se parecen mucho a AGGT, la duplicación genómica en tándem de un segmento exónico que alberga una secuencia AGGT genera dos sitios de empalme potenciales. Cuando el espliceosoma lo reconoce, la secuencia entre el AGGT original y el duplicado se empalmará, lo que dará como resultado la creación de un intrón sin alteración de la secuencia codificante del gen. La reparación de roturas de doble cadena mediante la unión de extremos no homólogos se identificó recientemente como una fuente de ganancia de intrones cuando los investigadores identificaron repeticiones directas cortas que flanquean el 43% de los intrones ganados en Daphnia. [62] Sin embargo, estos números deben compararse con el número de intrones conservados flanqueados por repeticiones en otros organismos, para mayor relevancia estadística. Para la inserción de intrones del grupo II, se propuso la retrolocalización de un intrón del grupo II en un gen nuclear para provocar una ganancia reciente de intrones espliceosómicos.
Se ha planteado la hipótesis de que la transferencia de intrones da como resultado una ganancia de intrones cuando un parálogo o pseudogén gana un intrón y luego transfiere este intrón mediante recombinación a una ubicación sin intrón en su parálogo hermano. La intronización es el proceso mediante el cual las mutaciones crean nuevos intrones a partir de una secuencia anteriormente exónica. Por tanto, a diferencia de otros mecanismos propuestos de ganancia de intrones, este mecanismo no requiere la inserción o generación de ADN para crear un nuevo intrón. [62]
El único mecanismo hipotético de ganancia reciente de intrones que carece de evidencia directa es el de la inserción de intrones del grupo II, que cuando se demuestra in vivo, suprime la expresión génica. [63] Por lo tanto, los intrones del grupo II son probablemente los presuntos ancestros de los intrones espliceosómicos, actúan como retroelementos específicos de sitio y ya no son responsables de la ganancia de intrones. [64] [65] La duplicación genómica en tándem es el único mecanismo propuesto que respalda la evidencia experimental in vivo: una duplicación en tándem intragénica corta puede insertar un nuevo intrón en un gen codificante de proteínas, dejando la secuencia peptídica correspondiente sin cambios. [66] Este mecanismo también tiene una amplia evidencia indirecta que respalda la idea de que la duplicación genómica en tándem es un mecanismo predominante para la ganancia de intrones. Es posible probar otros mecanismos propuestos in vivo, particularmente la ganancia de intrones durante DSBR, la transferencia de intrones y la intronización, aunque estos mecanismos deben demostrarse in vivo para solidificarlos como mecanismos reales de ganancia de intrones. Análisis genómicos adicionales, especialmente cuando se ejecutan a nivel de población, pueden luego cuantificar la contribución relativa de cada mecanismo, posiblemente identificando sesgos específicos de especie que pueden arrojar luz sobre las distintas tasas de ganancia de intrones entre diferentes especies. [62]
Estructura:
Empalme:
Función
Otros: