En química , el hipoclorito o cloróxido es un anión con la fórmula química ClO − . Se combina con varios cationes para formar sales de hipoclorito. Algunos ejemplos comunes son el hipoclorito de sodio ( lejía de uso doméstico ) y el hipoclorito de calcio (un componente del polvo blanqueador, el "cloro" de las piscinas). [1] La distancia Cl-O en ClO − es de 1,69 Å. [2]
El nombre también puede referirse a ésteres de ácido hipocloroso, es decir, compuestos orgánicos con un grupo ClO– unido covalentemente al resto de la molécula. El principal ejemplo es el hipoclorito de terc-butilo , que es un agente clorante útil. [3]
La mayoría de las sales de hipoclorito se manejan como soluciones acuosas . Sus principales aplicaciones son como agentes blanqueadores, desinfectantes y de tratamiento del agua . También se utilizan en química para reacciones de cloración y oxidación .
La acidificación de los hipocloritos genera ácido hipocloroso , que existe en equilibrio con el cloro. Un pH más bajo (es decir, hacia el ácido) impulsa la siguiente reacción hacia la derecha, liberando gas cloro, que puede ser peligroso:
Los hipocloritos son generalmente inestables y muchos compuestos existen sólo en solución. El hipoclorito de litio LiOCl, el hipoclorito de calcio Ca(OCl) 2 y el hipoclorito de bario Ba(ClO) 2 se han aislado como compuestos anhidros puros . Todos son sólidos. Se pueden producir unos pocos más como soluciones acuosas . En general, cuanto mayor sea la dilución, mayor será su estabilidad. No es posible determinar tendencias para las sales de metales alcalinotérreos , ya que muchas de ellas no se pueden formar. El hipoclorito de berilio es desconocido. El hipoclorito de magnesio puro no se puede preparar; sin embargo, se conoce el Mg(OH)OCl sólido. [4] El hipoclorito de calcio se produce a escala industrial y tiene buena estabilidad. El hipoclorito de estroncio, Sr(OCl) 2 , no está bien caracterizado y su estabilidad aún no se ha determinado. [ cita requerida ]
Al calentarse, el hipoclorito se degrada a una mezcla de cloruro , oxígeno y cloratos :
Esta reacción es exotérmica y en el caso de hipocloritos concentrados, como LiOCl y Ca(OCl) 2 , puede provocar una peligrosa fuga térmica y es potencialmente explosiva. [5]
Los hipocloritos de metales alcalinos disminuyen su estabilidad a medida que avanza el grupo . El hipoclorito de litio anhidro es estable a temperatura ambiente; sin embargo, el hipoclorito de sodio es explosivo como sólido anhidro. [6] El pentahidrato (NaOCl·(H 2 O) 5 ) es inestable por encima de 0 °C; [7] aunque las soluciones más diluidas que se encuentran como blanqueador doméstico son más estables. El hipoclorito de potasio (KOCl) se conoce solo en solución. [4]
Los hipocloritos de lantánidos también son inestables; sin embargo, se ha informado que son más estables en sus formas anhidras que en presencia de agua. [8] El hipoclorito se ha utilizado para oxidar el cerio de su estado de oxidación +3 a +4 . [9]
El ácido hipocloroso en sí no es estable de forma aislada, ya que se descompone para formar cloro . Su descomposición también produce alguna forma de oxígeno.
Los hipocloritos reaccionan con el amoniaco dando lugar primero a monocloramina ( NH
2Cl ), luego dicloramina ( NHCl
2), y finalmente tricloruro de nitrógeno ( NCl
3). [1]
Sales de hipoclorito formadas por la reacción entre el cloro y los hidróxidos de metales alcalinos y alcalinotérreos . La reacción se lleva a cabo a una temperatura cercana a la ambiente para suprimir la formación de cloratos . Este proceso se utiliza ampliamente para la producción industrial de hipoclorito de sodio (NaClO) e hipoclorito de calcio (Ca(ClO) 2 ).
También se producen grandes cantidades de hipoclorito de sodio de forma electroquímica mediante un proceso de cloro-álcali no separado . En este proceso, la salmuera se electroliza para formar Cl
2que se disocia en agua para formar hipoclorito. Esta reacción debe realizarse en condiciones no ácidas para evitar la liberación de cloro:
Algunos hipocloritos también pueden obtenerse mediante una reacción de metátesis de sal entre el hipoclorito de calcio y varios sulfatos metálicos . Esta reacción se lleva a cabo en agua y depende de la formación de sulfato de calcio insoluble , que precipitará de la solución, lo que hará que la reacción se complete.
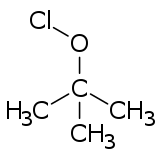
Los ésteres de hipoclorito se forman en general a partir de los alcoholes correspondientes , mediante tratamiento con cualquiera de varios reactivos (por ejemplo , cloro , ácido hipocloroso , monóxido de dicloro y varias sales de hipoclorito acidificadas). [3]
Las cloroperoxidasas son enzimas que catalizan la cloración de compuestos orgánicos. Esta enzima combina los sustratos inorgánicos cloruro y peróxido de hidrógeno para producir el equivalente de Cl + , que reemplaza un protón en el sustrato hidrocarbonado:
La fuente de "Cl + " es el ácido hipocloroso (HOCl). [11] Muchos compuestos organoclorados se biosintetizan de esta manera.
En respuesta a una infección, el sistema inmunológico humano genera pequeñas cantidades de hipoclorito dentro de glóbulos blancos especiales , llamados granulocitos neutrófilos . [12] Estos granulocitos engullen virus y bacterias en una vacuola intracelular llamada fagosoma , donde son digeridos.
Parte del mecanismo de digestión implica una explosión respiratoria mediada por enzimas , que produce compuestos reactivos derivados del oxígeno, incluido el superóxido (que es producido por la NADPH oxidasa ). El superóxido se descompone en oxígeno y peróxido de hidrógeno , que se utiliza en una reacción catalizada por la mieloperoxidasa para convertir el cloruro en hipoclorito. [13] [14] [15]
También se encontró que concentraciones bajas de hipoclorito interactuaban con las proteínas de choque térmico de un microbio , estimulando su papel como chaperona intracelular y haciendo que las bacterias se agrupen (como un huevo que ha sido hervido) que eventualmente morirán. [16] El mismo estudio encontró que niveles bajos (micromolares) de hipoclorito inducen a E. coli y Vibrio cholerae a activar un mecanismo de protección, aunque sus implicaciones no estaban claras. [16]
En algunos casos, la acidez básica del hipoclorito compromete la membrana lipídica de una bacteria , una reacción similar a la de reventar un globo. [ cita requerida ]
Los hipocloritos, especialmente el de sodio ("lejía líquida", "agua de Javel") y el de calcio ("polvo blanqueador") se utilizan ampliamente, tanto a nivel industrial como doméstico , para blanquear la ropa, aclarar el color del cabello y eliminar manchas . Fueron los primeros productos blanqueadores comerciales, desarrollados poco después de que el químico francés Claude Berthollet descubriera esa propiedad en 1785 .
Los hipocloritos también se utilizan ampliamente como desinfectantes y desodorizantes de amplio espectro . Esa aplicación comenzó poco después de que el químico francés Labarraque descubriera esas propiedades, alrededor de 1820 (aún antes de que Pasteur formulara su teoría de las enfermedades a partir de los gérmenes).
El hipoclorito es el agente oxidante más fuerte de los oxianiones de cloro. Esto se puede comprobar comparando los potenciales de semicelda estándar en toda la serie; los datos también muestran que los oxianiones de cloro son oxidantes más fuertes en condiciones ácidas. [17]
El hipoclorito es un oxidante suficientemente fuerte para convertir Mn(III) en Mn(V) durante la reacción de epoxidación de Jacobsen y para convertir Ce3+
A Ce4+
. [9]
Este poder oxidante es lo que los convierte en agentes blanqueadores y desinfectantes eficaces.
En química orgánica , los hipocloritos se pueden utilizar para oxidar alcoholes primarios a ácidos carboxílicos . [18]
Las sales de hipoclorito también pueden servir como agentes clorantes . Por ejemplo, convierten los fenoles en clorofenoles. El hipoclorito de calcio convierte la piperidina en N -cloropiperidina .
El cloro puede ser el núcleo de oxianiones con estados de oxidación de −1, +1, +3, +5 o +7. (El elemento también puede asumir el estado de oxidación +4 como se observa en el compuesto neutro dióxido de cloro ClO 2 ).
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )