
En biología celular , el aparato del huso es la estructura citoesquelética de las células eucariotas que se forma durante la división celular para separar las cromátidas hermanas entre las células hijas . Se le conoce como huso mitótico durante la mitosis , un proceso que produce células hijas genéticamente idénticas, o huso meiótico durante la meiosis , un proceso que produce gametos con la mitad de cromosomas que la célula madre.
Además de los cromosomas, el aparato del huso está compuesto por cientos de proteínas . [1] [2] Los microtúbulos comprenden los componentes más abundantes de la maquinaria.

La unión de los microtúbulos a los cromosomas está mediada por cinetocoros , que monitorean activamente la formación del huso y previenen la aparición prematura de la anafase . La polimerización y despolimerización de microtúbulos impulsan el congreso cromosómico dinámico. La despolimerización de los microtúbulos genera tensión en los cinetocoros; [3] la unión bipolar de cinetocoros hermanos a microtúbulos que emanan de polos celulares opuestos acopla fuerzas de tensión opuestas, alineando los cromosomas en el ecuador celular y preparándolos para la segregación en células hijas. Una vez que cada cromosoma está biorientado, comienza la anafase y se corta la cohesina , que une las cromátidas hermanas , permitiendo el tránsito de las cromátidas hermanas a los polos opuestos.
El aparato del huso celular incluye los microtúbulos del huso , proteínas asociadas, que incluyen motores moleculares de cinesina y dineína , cromosomas condensados y cualquier centrosoma o áster que pueda estar presente en los polos del huso según el tipo de célula. [4] El aparato del huso tiene una sección transversal vagamente elipsoide y se estrecha en los extremos. En la porción media ancha, conocida como zona media del huso, los microtúbulos antiparalelos están agrupados por cinesinas . En los extremos puntiagudos, conocidos como polos del huso, los microtúbulos son nucleados por los centrosomas en la mayoría de las células animales. Los husos acentrosomales o anastrales carecen de centrosomas o ásteres en los polos del huso, respectivamente, y ocurren, por ejemplo, durante la meiosis femenina en la mayoría de los animales. [5] En este caso, un gradiente de Ran GTP es el principal regulador de la organización y ensamblaje de los microtúbulos del huso. En los hongos , los husos se forman entre los cuerpos polares del huso incrustados en la envoltura nuclear , que no se rompe durante la mitosis.
El alargamiento y acortamiento dinámico de los microtúbulos del huso, mediante un proceso conocido como inestabilidad dinámica, determina en gran medida la forma del huso mitótico y promueve el correcto alineamiento de los cromosomas en la zona media del huso. Las proteínas asociadas a microtúbulos (MAP) se asocian con microtúbulos en la zona media y los polos del huso para regular su dinámica. La γ-tubulina es una variante de tubulina especializada que se ensambla en un complejo de anillo llamado γ-TuRC que nuclea la polimerización de los heterodímeros de tubulina α/β en microtúbulos. "El reclutamiento de γ-TuRC en la región pericentrosomal estabiliza los extremos negativos de los microtúbulos y los ancla cerca del centro organizador de los microtúbulos" . La proteína Augmin asociada a los microtúbulos actúa junto con γ-TURC para nuclear nuevos microtúbulos a partir de microtúbulos existentes. [6]
Los extremos en crecimiento de los microtúbulos están protegidos contra catástrofes mediante la acción de proteínas de seguimiento de microtúbulos del extremo positivo (+TIP) para promover su asociación con cinetocoros en la zona media. Se demostró que CLIP170 se localiza cerca de los extremos positivos de los microtúbulos en las células HeLa [7] y se acumula en los cinetocoros durante la prometafase . [8] Aunque aún no está claro cómo CLIP170 reconoce los extremos positivos, se ha demostrado que sus homólogos protegen contra catástrofes y promueven el rescate, [9] [10] lo que sugiere un papel para CLIP170 en la estabilización de los extremos positivos y posiblemente mediando su unión directa a cinetocoros. [11] También se ha demostrado que las proteínas asociadas a CLIP como CLASP1 en humanos se localizan en los extremos positivos y el cinetocoro externo, así como modulan la dinámica de los microtúbulos del cinetocoro (Maiato 2003). Se requieren homólogos CLASP en Drosophila , Xenopus y levadura para el ensamblaje adecuado del huso; En los mamíferos, CLASP1 y CLASP2 contribuyen al ensamblaje adecuado del huso y a la dinámica de los microtúbulos en la anafase. [12] La polimerización del extremo positivo puede ser moderada aún más por la proteína EB1, que se une directamente a los extremos en crecimiento de los microtúbulos y coordina la unión de otros +TIP. [13] [14]
Oponiéndose a la acción de estas proteínas estabilizadoras de microtúbulos hay una serie de factores despolimerizantes de microtúbulos que permiten la remodelación dinámica del huso mitótico para promover el congreso cromosómico y el logro de la bipolaridad . La superfamilia de MAP de cinesina -13 contiene una clase de proteínas motoras dirigidas al extremo positivo con actividad de despolimerización de microtúbulos asociada, incluidos los mamíferos bien estudiados MCAK y Xenopus XKCM1. MCAK se localiza en las puntas en crecimiento de los microtúbulos en los cinetocoros, donde puede desencadenar una catástrofe en competencia directa con la actividad estabilizadora de +TIP. [15] Estas proteínas aprovechan la energía de la hidrólisis del ATP para inducir cambios conformacionales desestabilizadores en la estructura del protofilamento que provocan la liberación de cinesina y la despolimerización de los microtúbulos. [16] La pérdida de su actividad da como resultado numerosos defectos mitóticos. [15] Otras proteínas desestabilizadoras de microtúbulos incluyen Op18/ estatamina y katanina , que desempeñan funciones en la remodelación del huso mitótico y en la promoción de la segregación cromosómica durante la anafase. [17]
Las actividades de estos MAP están cuidadosamente reguladas para mantener la dinámica adecuada de los microtúbulos durante el ensamblaje del huso, y muchas de estas proteínas sirven como sustratos de quinasas tipo Aurora y Polo. [17] [18]
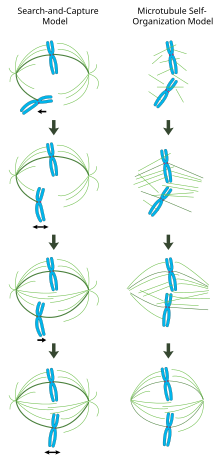
En un huso mitótico formado correctamente, los cromosomas biorientados están alineados a lo largo del ecuador de la célula con microtúbulos del huso orientados aproximadamente perpendiculares a los cromosomas, sus extremos positivos incrustados en cinetocoros y sus extremos negativos anclados en los polos celulares. Se requiere la orientación precisa de este complejo para garantizar una segregación cromosómica precisa y especificar el plano de división celular. Sin embargo, aún no está claro cómo se organiza el huso. En este campo predominan dos modelos que son sinérgicos y no mutuamente excluyentes. En el modelo de búsqueda y captura , el huso está organizado predominantemente mediante la separación hacia los polos de los centros organizadores de microtúbulos centrosomales (MTOC). Los microtúbulos del huso emanan de los centrosomas y "buscan" cinetocoros; cuando se unen a un cinetocoro, se estabilizan y ejercen tensión sobre los cromosomas. En un modelo alternativo de autoensamblaje , los microtúbulos sufren una nucleación acentrosomal entre los cromosomas condensados. Limitados por las dimensiones celulares, las asociaciones laterales con microtúbulos antiparalelos a través de proteínas motoras y las uniones terminales a los cinetocoros, los microtúbulos adoptan naturalmente una estructura similar a un huso con los cromosomas alineados a lo largo del ecuador celular.
En este modelo, los microtúbulos se nuclean en centros organizadores de microtúbulos y experimentan un rápido crecimiento y una catástrofe para "buscar" cinetocoros en el citoplasma. Una vez que se unen a un cinetocoro, se estabilizan y se reduce su dinámica. El cromosoma recién monoorientado oscila en el espacio cerca del polo al que está unido hasta que un microtúbulo del polo opuesto se une al cinetocoro hermano. Esta segunda unión estabiliza aún más la unión del cinetocoro al huso mitótico. Gradualmente, el cromosoma biorientado es arrastrado hacia el centro de la célula hasta que la tensión de los microtúbulos se equilibra en ambos lados del centrómero ; Luego, el cromosoma reunido oscila en la placa metafásica hasta que el inicio de la anafase libera la cohesión de las cromátidas hermanas.
En este modelo, los centros organizadores de microtúbulos están localizados en los polos celulares, y su separación es impulsada por la polimerización de los microtúbulos y el "deslizamiento" de los microtúbulos antiparalelos del huso entre sí en la zona media del huso mediado por cinesinas bipolares dirigidas hacia el extremo positivo. [19] [20] Estas fuerzas de deslizamiento pueden explicar no sólo la separación de los polos del huso al comienzo de la mitosis, sino también el alargamiento del huso durante la anafase tardía.
En contraste con el mecanismo de búsqueda y captura en el que los centrosomas dictan en gran medida la organización del huso mitótico, este modelo propone que los microtúbulos se nuclean acentrosomally cerca de los cromosomas y se ensamblan espontáneamente en haces antiparalelos y adoptan una estructura similar a un huso. [21] Los experimentos clásicos de Heald y Karsenti muestran que se forman husos y núcleos mitóticos funcionales alrededor de perlas recubiertas de ADN incubadas en extractos de huevos de Xenopus y que se forman conjuntos bipolares de microtúbulos en ausencia de centrosomas y cinetocoros. [22] De hecho, también se ha demostrado que la ablación con láser de centrosomas en células de vertebrados no inhibe ni el ensamblaje del huso ni la segregación cromosómica. [23] Según este esquema, la forma y el tamaño del huso mitótico son función de las propiedades biofísicas de las proteínas motoras entrecruzadas. [24]
El factor de intercambio de nucleótidos de guanina para la pequeña GTPasa Ran (regulador de la condensación cromosómica 1 o RCC1 ) está unido a los nucleosomas a través de las histonas centrales H2A y H2B. [25] Por lo tanto, se genera un gradiente de Ran unido a GTP alrededor de la vecindad de la cromatina mitótica. Las perlas de vidrio recubiertas con RCC1 inducen la nucleación de microtúbulos y la formación de huso bipolar en extractos de huevos de Xenopus , lo que revela que el gradiente Ran GTP por sí solo es suficiente para el ensamblaje del huso. [26] El gradiente desencadena la liberación de factores de ensamblaje del huso (SAF) a partir de interacciones inhibidoras a través de las proteínas de transporte importina β/α. Los SAF libres luego promueven la nucleación y estabilización de los microtúbulos alrededor de la cromatina mitótica, y la bipolaridad del huso está organizada por proteínas motoras de los microtúbulos. [27]
El ensamblaje del huso está regulado en gran medida por eventos de fosforilación catalizados por quinasas mitóticas. Los complejos de quinasa dependientes de ciclina (CDK) son activados por ciclinas mitóticas, cuya traducción aumenta durante la mitosis. CDK1 (también llamada CDC2) se considera la principal quinasa mitótica en células de mamíferos y es activada por la ciclina B1. Se requieren aurora quinasas para el ensamblaje y separación adecuados del husillo. [28] Aurora A se asocia con centrosomas y se cree que regula la entrada mitótica. Aurora B es miembro del complejo cromosómico pasajero y media la unión cromosoma-microtúbulos y la cohesión de las cromátidas hermanas. La quinasa tipo polo, también conocida como PLK, especialmente PLK1, tiene funciones importantes en el mantenimiento del huso al regular la dinámica de los microtúbulos. [29]
Al final de la replicación del ADN , las cromátidas hermanas se unen en una masa amorfa de ADN y proteínas enredados. La entrada mitótica desencadena una reorganización dramática del genoma duplicado, lo que da como resultado cromátidas hermanas que se desenredan y separan unas de otras. Los cromosomas también se acortan en longitud, hasta 10.000 veces en las células animales, [30] en un proceso llamado condensación. La condensación comienza en la profase y los cromosomas se compactan al máximo en estructuras en forma de varilla cuando se alinean en el medio del huso en la metafase. Esto les da a los cromosomas mitóticos la clásica forma de "X" que se ve en los cariotipos , con cada cromátida hermana condensada unida a lo largo de su longitud por proteínas cohesina y unidas, a menudo cerca del centro, en el centrómero . [30] [31] [32]
Si bien estos reordenamientos dinámicos son de vital importancia para garantizar una segregación precisa y de alta fidelidad del genoma, nuestra comprensión de la estructura de los cromosomas mitóticos sigue siendo en gran medida incompleta. Sin embargo, se han identificado algunos actores moleculares específicos: la topoisomerasa II utiliza la hidrólisis de ATP para catalizar la decatenación de entrelazamientos de ADN, promoviendo la resolución de las cromátidas hermanas. [33] Las condensinas son complejos de 5 subunidades que también utilizan la hidrólisis de ATP para promover la condensación de los cromosomas. [34] Los experimentos con extractos de huevos de Xenopus también han implicado al enlazador Histona H1 como un importante regulador de la compactación de los cromosomas mitóticos. [35]
La finalización de la formación del huso es un punto de transición crucial en el ciclo celular llamado punto de control del ensamblaje del huso . Si los cromosomas no están correctamente unidos al huso mitótico en el momento de este punto de control, el inicio de la anafase se retrasará. [36] La falla de este punto de control del conjunto del husillo puede resultar en aneuploidía y puede estar involucrada en el envejecimiento y la formación de cáncer. [37]

La orientación de la división celular es de gran importancia para la arquitectura de los tejidos, el destino celular y la morfogénesis. Las células tienden a dividirse a lo largo de su eje longitudinal según la llamada regla de Hertwig . El eje de división celular está determinado por la orientación del aparato del huso. Las células se dividen a lo largo de la línea que conecta dos centrosomas del aparato del huso. Después de la formación, el aparato del huso sufre rotación dentro de la célula. Los microtúbulos astrales que se originan en los centrosomas alcanzan la membrana celular donde son atraídos hacia pistas corticales específicas. In vitro , la distribución de las pistas corticales está determinada por el patrón adhesivo. [38] Las señales de polaridad in vivo están determinadas por la localización de uniones tricelulares localizadas en los vértices de las células. [39] La distribución espacial de las pistas corticales conduce al campo de fuerza que determina la orientación final del aparato del huso y la orientación posterior de la división celular.
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )