El hipotálamo ( pl.: hipotálamo ; del griego antiguo ὑπό ( hupó ) 'debajo' y θάλαμος ( thálamos ) 'cámara') es una pequeña parte del cerebro que contiene varios núcleos con una variedad de funciones. Una de las funciones más importantes es vincular el sistema nervioso con el sistema endocrino a través de la glándula pituitaria . El hipotálamo se encuentra debajo del tálamo y forma parte del sistema límbico . [1] Forma la parte ventral del diencéfalo . Todos los cerebros de los vertebrados contienen un hipotálamo. [2] En los humanos, es del tamaño de una almendra . [ cita necesaria ]
El hipotálamo se encarga de regular ciertos procesos metabólicos y otras actividades del sistema nervioso autónomo . Sintetiza y secreta ciertas neurohormonas , llamadas hormonas liberadoras u hormonas hipotalámicas, y estas a su vez estimulan o inhiben la secreción de hormonas de la glándula pituitaria. El hipotálamo controla la temperatura corporal , el hambre , aspectos importantes de la crianza de los hijos y las conductas de apego materno , la sed , [3] la fatiga , el sueño , los ritmos circadianos y es importante en ciertos comportamientos sociales, como los comportamientos sexuales y agresivos. [4] [5]
El hipotálamo se divide en cuatro regiones (preóptica, supraóptica, tuberal, mamilar) en un plano parasagital, lo que indica su ubicación anteroposterior; y tres zonas (periventricular, intermedia, lateral) en el plano coronal, indicando ubicación medial-lateral. [6] Los núcleos hipotalámicos se encuentran dentro de estas regiones y zonas específicas. [7] Se encuentra en todos los sistemas nerviosos de los vertebrados. En los mamíferos, las células neurosecretoras magnocelulares del núcleo paraventricular y del núcleo supraóptico del hipotálamo producen hormonas neurohipofisarias , oxitocina y vasopresina . [8] Estas hormonas se liberan a la sangre en la hipófisis posterior . [9] Las células neurosecretoras parvocelulares mucho más pequeñas , las neuronas del núcleo paraventricular, liberan la hormona liberadora de corticotropina y otras hormonas en el sistema portal hipofisario , donde estas hormonas se difunden hacia la hipófisis anterior . [ cita necesaria ]
Los núcleos hipotalámicos incluyen los siguientes: [10] [11]
El hipotálamo está altamente interconectado con otras partes del sistema nervioso central , en particular con el tronco del encéfalo y su formación reticular . Como parte del sistema límbico , tiene conexiones con otras estructuras límbicas, incluidas la amígdala y el tabique , y también está conectado con áreas del sistema nervioso autónomo .
El hipotálamo recibe muchas entradas del tronco del encéfalo , las más notables del núcleo del tracto solitario , el locus coeruleus y la médula ventrolateral .
La mayoría de las fibras nerviosas dentro del hipotálamo discurren de dos maneras (bidireccionales).
Varios núcleos hipotalámicos son sexualmente dimórficos ; es decir, existen claras diferencias tanto en estructura como en función entre hombres y mujeres. [16] Algunas diferencias son evidentes incluso en la neuroanatomía macroscópica: la más notable es el núcleo sexualmente dimórfico dentro del área preóptica , [16] en el que las diferencias son cambios sutiles en la conectividad y la sensibilidad química de conjuntos particulares de neuronas. La importancia de estos cambios puede reconocerse por las diferencias funcionales entre hombres y mujeres. Por ejemplo, los machos de la mayoría de las especies prefieren el olor y la apariencia de las hembras a los de los machos, lo que es fundamental para estimular el comportamiento sexual masculino. Si se lesiona el núcleo sexualmente dimórfico, esta preferencia por las hembras por parte de los machos disminuye. Además, el patrón de secreción de la hormona del crecimiento es sexualmente dimórfico; [17] Esta es la razón por la que en muchas especies, los machos adultos tienen tamaños visiblemente distintos al de las hembras.
Otros dimorfismos funcionales sorprendentes se encuentran en las respuestas conductuales a los esteroides ováricos del adulto. Los hombres y las mujeres responden a los esteroides ováricos de diferentes maneras, en parte porque la expresión de las neuronas sensibles a los estrógenos en el hipotálamo es sexualmente dimórfica; es decir, los receptores de estrógeno se expresan en diferentes conjuntos de neuronas. [ cita necesaria ]
El estrógeno y la progesterona pueden influir en la expresión genética de determinadas neuronas o inducir cambios en el potencial de la membrana celular y la activación de la quinasa , lo que lleva a diversas funciones celulares no genómicas. El estrógeno y la progesterona se unen a sus receptores hormonales nucleares afines , que se trasladan al núcleo celular e interactúan con regiones del ADN conocidas como elementos de respuesta hormonal (HRE) o se unen al sitio de unión de otro factor de transcripción . Se ha demostrado que el receptor de estrógeno (ER) transactiva otros factores de transcripción de esta manera, a pesar de la ausencia de un elemento de respuesta al estrógeno (ERE) en la región promotora proximal del gen. En general, los RE y los receptores de progesterona (PR) son activadores de genes, con un aumento del ARNm y la posterior síntesis de proteínas después de la exposición hormonal. [ cita necesaria ]
Los cerebros masculinos y femeninos difieren en la distribución de los receptores de estrógeno, y esta diferencia es una consecuencia irreversible de la exposición neonatal a los esteroides. [ cita necesaria ] Los receptores de estrógeno (y receptores de progesterona) se encuentran principalmente en las neuronas del hipotálamo anterior y mediobasal, en particular:
En la vida neonatal, los esteroides gonadales influyen en el desarrollo del hipotálamo neuroendocrino. Por ejemplo, determinan la capacidad de las hembras para exhibir un ciclo reproductivo normal, y de los machos y las hembras para exhibir comportamientos reproductivos apropiados en la vida adulta.
En los primates, la influencia de los andrógenos en el desarrollo es menos clara y sus consecuencias se comprenden menos. Dentro del cerebro, la testosterona se aromatiza (a estradiol ), que es la principal hormona activa para las influencias del desarrollo. El testículo humano secreta niveles elevados de testosterona desde aproximadamente la octava semana de vida fetal hasta 5 a 6 meses después del nacimiento (en muchas especies se observa un aumento perinatal similar de testosterona), un proceso que parece subyacer al fenotipo masculino. El estrógeno de la circulación materna es relativamente ineficaz, en parte debido a los altos niveles circulantes de proteínas transportadoras de esteroides durante el embarazo. [20]
Los esteroides sexuales no son las únicas influencias importantes sobre el desarrollo hipotalámico; en particular, el estrés prepuberal en los primeros años de vida (de ratas) determina la capacidad del hipotálamo adulto para responder a un factor estresante agudo. [21] A diferencia de los receptores de esteroides gonadales, los receptores de glucocorticoides están muy extendidos en todo el cerebro; en el núcleo paraventricular , median el control de retroalimentación negativa de la síntesis y secreción de CRF , pero en otros lugares su papel no se comprende bien.
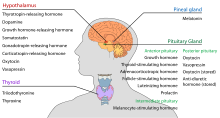
El hipotálamo tiene una función neuroendocrina central , sobre todo por su control de la hipófisis anterior , que a su vez regula varias glándulas y órganos endocrinos. Las hormonas liberadoras (también llamadas factores liberadores) se producen en los núcleos hipotalámicos y luego se transportan a lo largo de los axones hasta la eminencia media o la hipófisis posterior , donde se almacenan y liberan según sea necesario. [22]
En el eje hipotalámico-adenohipofisario, las hormonas liberadoras, también conocidas como hormonas hipofisiotrópicas o hipotalámicas, se liberan desde la eminencia media, una prolongación del hipotálamo, hacia el sistema porta hipofisario , que las transporta hasta la hipófisis anterior, donde ejercen sus funciones reguladoras. sobre la secreción de hormonas adenohipofisarias. [23] Estas hormonas hipofisiotrópicas son estimuladas por células neurosecretoras parvocelulares ubicadas en el área periventricular del hipotálamo. Después de su liberación en los capilares del tercer ventrículo, las hormonas hipofisiotrópicas viajan a través de la llamada circulación porta hipotálamo-pituitaria. Una vez que llegan a su destino en la hipófisis anterior, estas hormonas se unen a receptores específicos ubicados en la superficie de las células pituitarias. Dependiendo de qué células se activen a través de esta unión, la pituitaria comenzará a secretar o dejará de secretar hormonas al resto del torrente sanguíneo. [24]
Otras hormonas secretadas por la eminencia media incluyen vasopresina , oxitocina y neurotensina . [26] [27] [28] [29]
En el eje hipotalámico-pituitario-suprarrenal, las hormonas neurohipofisarias se liberan desde la hipófisis posterior, que en realidad es una prolongación del hipotálamo, hacia la circulación.
También se sabe que las hormonas del eje hipotalámico-pituitario-suprarrenal (HPA) están relacionadas con ciertas enfermedades de la piel y con la homeostasis de la piel. Existe evidencia que vincula la hiperactividad de las hormonas HPA con enfermedades de la piel y tumores de piel relacionados con el estrés. [30]
El hipotálamo coordina muchos ritmos circadianos hormonales y conductuales, patrones complejos de resultados neuroendocrinos , mecanismos homeostáticos complejos y comportamientos importantes. Por lo tanto, el hipotálamo debe responder a muchas señales diferentes, algunas de las cuales se generan externamente y otras internamente. La señalización de ondas delta que surge en el tálamo o en la corteza influye en la secreción de hormonas liberadoras; La GHRH y la prolactina se estimulan mientras que la TRH se inhibe.
El hipotálamo responde a:
Los estímulos olfativos son importantes para la reproducción sexual y la función neuroendocrina en muchas especies. Por ejemplo, si una ratona preñada se expone a la orina de un macho "extraño" durante un período crítico después del coito, el embarazo falla (el efecto Bruce ). Así, durante el coito, una ratona forma una "memoria olfativa" precisa de su pareja que persiste durante varios días. Las señales de feromonas ayudan a la sincronización del estro en muchas especies; en las mujeres, la menstruación sincronizada también puede surgir de señales feromonas, aunque el papel de las feromonas en los humanos es controvertido.
Las hormonas peptídicas tienen influencias importantes sobre el hipotálamo y, para ello, deben atravesar la barrera hematoencefálica . El hipotálamo está limitado en parte por regiones cerebrales especializadas que carecen de una barrera hematoencefálica eficaz; el endotelio capilar en estos sitios está fenestrado para permitir el paso libre incluso de proteínas grandes y otras moléculas. Algunos de estos sitios son los sitios de neurosecreción: la neurohipófisis y la eminencia media . Sin embargo, otros son sitios en los que el cerebro toma muestras de la composición de la sangre. Dos de estos sitios, el SFO ( órgano subfornical ) y el OVLT ( organum vasculosum de la lámina terminal ) son los llamados órganos circunventriculares , donde las neuronas están en íntimo contacto tanto con la sangre como con el LCR . Estas estructuras están densamente vascularizadas y contienen neuronas osmorreceptivas y receptoras de sodio que controlan el consumo de alcohol , la liberación de vasopresina , la excreción de sodio y el apetito por sodio. También contienen neuronas con receptores para angiotensina , factor natriurético auricular , endotelina y relaxina , cada uno de los cuales es importante en la regulación del equilibrio de líquidos y electrolitos. Las neuronas del OVLT y la SFO se proyectan al núcleo supraóptico y al núcleo paraventricular , y también a las áreas hipotalámicas preópticas. Los órganos circunventriculares también pueden ser el lugar de acción de las interleucinas para provocar fiebre y secreción de ACTH, a través de efectos sobre las neuronas paraventriculares. [ cita necesaria ]
No está claro cómo todos los péptidos que influyen en la actividad hipotalámica obtienen el acceso necesario. En el caso de la prolactina y la leptina , hay evidencia de captación activa en el plexo coroideo desde la sangre al líquido cefalorraquídeo (LCR). Algunas hormonas pituitarias tienen una influencia de retroalimentación negativa sobre la secreción hipotalámica; por ejemplo, la hormona del crecimiento se retroalimenta del hipotálamo, pero no está claro cómo ingresa al cerebro. También hay evidencia de acciones centrales de la prolactina . [ cita necesaria ]
Los hallazgos han sugerido que la hormona tiroidea (T4) es captada por las células gliales hipotalámicas en el núcleo infundibular / eminencia media , y que aquí es convertida en T3 por la desyodasa tipo 2 (D2). Posteriormente, la T3 se transporta a las neuronas productoras de la hormona liberadora de tirotropina ( TRH ) en el núcleo paraventricular . Se han encontrado receptores de hormona tiroidea en estas neuronas , lo que indica que efectivamente son sensibles a los estímulos T3. Además, estas neuronas expresaban MCT8 , un transportador de hormona tiroidea , lo que respalda la teoría de que la T3 se transporta hacia ellas. Luego, la T3 podría unirse al receptor de la hormona tiroidea en estas neuronas y afectar la producción de la hormona liberadora de tirotropina, regulando así la producción de hormona tiroidea. [32]
El hipotálamo funciona como una especie de termostato del cuerpo. [33] Establece la temperatura corporal deseada y estimula la producción y retención de calor para elevar la temperatura de la sangre a un nivel más alto o la sudoración y la vasodilatación para enfriar la sangre a una temperatura más baja. Todas las fiebres son el resultado de una elevación del hipotálamo; Las temperaturas corporales elevadas por cualquier otra causa se clasifican como hipertermia . [33] En raras ocasiones, el daño directo al hipotálamo, como por ejemplo un derrame cerebral , causará fiebre; A esto a veces se le llama fiebre hipotalámica . Sin embargo, es más común que dicho daño cause temperaturas corporales anormalmente bajas. [33]
El hipotálamo contiene neuronas que reaccionan fuertemente a los esteroides y glucocorticoides (las hormonas esteroides de la glándula suprarrenal , liberadas en respuesta a la ACTH ). También contiene neuronas especializadas sensibles a la glucosa (en el núcleo arqueado y el hipotálamo ventromedial ), que son importantes para el apetito . El área preóptica contiene neuronas termosensibles; estos son importantes para la secreción de TRH .
La secreción de oxitocina en respuesta a la succión o a la estimulación vaginocervical está mediada por algunas de estas vías; La secreción de vasopresina en respuesta a estímulos cardiovasculares que surgen de quimiorreceptores en el cuerpo carotídeo y el arco aórtico , y de receptores de volumen auricular de baja presión , está mediada por otros. En la rata, la estimulación de la vagina también provoca la secreción de prolactina , lo que da lugar a una pseudopreñez tras un apareamiento infértil. En el conejo, el coito provoca la ovulación refleja . En las ovejas, la estimulación cervical en presencia de altos niveles de estrógeno puede inducir un comportamiento maternal en una oveja virgen. Todos estos efectos están mediados por el hipotálamo y la información se transporta principalmente por vías espinales que se transmiten en el tronco del encéfalo. La estimulación de los pezones estimula la liberación de oxitocina y prolactina y suprime la liberación de LH y FSH .
Los estímulos cardiovasculares son transportados por el nervio vago . El vago también transmite una variedad de información visceral, incluidas, por ejemplo, señales que surgen de la distensión o el vaciado gástrico, para suprimir o promover la alimentación, al señalar la liberación de leptina o gastrina , respectivamente. Nuevamente, esta información llega al hipotálamo a través de relés en el tronco del encéfalo.
Además, la función hipotalámica responde a los niveles de los tres neurotransmisores monoaminoclásicos , noradrenalina , dopamina y serotonina (5-hidroxitriptamina), y está regulada por ellos, en aquellos tractos de los que recibe inervación. Por ejemplo, los aportes noradrenérgicos que surgen del locus coeruleus tienen importantes efectos reguladores sobre los niveles de la hormona liberadora de corticotropina (CRH).
La parte extrema lateral del núcleo ventromedial del hipotálamo es responsable del control de la ingesta de alimentos . La estimulación de esta zona provoca un aumento de la ingesta de alimentos. La lesión bilateral de esta zona provoca el cese completo de la ingesta de alimentos. Las partes mediales del núcleo tienen un efecto controlador sobre la parte lateral. La lesión bilateral de la parte medial del núcleo ventromedial provoca hiperfagia y obesidad del animal. Una lesión adicional de la parte lateral del núcleo ventromedial en el mismo animal produce el cese completo de la ingesta de alimentos.
Existen diferentes hipótesis relacionadas con esta regulación: [35]
La zona medial del hipotálamo es parte de un circuito que controla las conductas motivadas, como las conductas defensivas. [36] Los análisis del etiquetado de Fos mostraron que una serie de núcleos en la "columna de control del comportamiento" son importantes para regular la expresión de comportamientos defensivos innatos y condicionados. [37]
La exposición a un depredador (como un gato) provoca conductas defensivas en los roedores de laboratorio, incluso cuando el animal nunca ha estado expuesto a un gato. [38] En el hipotálamo, esta exposición provoca un aumento de células marcadas con Fos en el núcleo hipotalámico anterior, la parte dorsomedial del núcleo ventromedial y en la parte ventrolateral del núcleo premamilar (PMDvl). [39] El núcleo premamilar tiene un papel importante en la expresión de comportamientos defensivos hacia un depredador, ya que las lesiones en este núcleo anulan comportamientos defensivos, como congelarse y huir. [39] [40] El PMD no modula el comportamiento defensivo en otras situaciones, ya que las lesiones de este núcleo tuvieron efectos mínimos en las puntuaciones de congelación post-shock. [40] El PMD tiene conexiones importantes con el gris periacueductal dorsal , una estructura importante en la expresión del miedo. [41] [42] Además, los animales muestran comportamientos de evaluación de riesgos para el medio ambiente previamente asociados con el gato. El análisis de células marcadas con Fos mostró que PMDvl es la estructura más activada en el hipotálamo, y la inactivación con muscimol antes de la exposición al contexto suprime el comportamiento defensivo. [39] Por lo tanto, el hipotálamo, principalmente el PMDvl, tiene un papel importante en la expresión de comportamientos defensivos innatos y condicionados hacia un depredador.
Asimismo, el hipotálamo desempeña un papel en la derrota social : los núcleos de la zona medial también se movilizan durante un encuentro con un conespecífico agresivo. El animal derrotado presenta un aumento de los niveles de Fos en estructuras sexualmente dimórficas, como el núcleo preóptico medial, la parte ventrolateral del núcleo ventromedial y el núcleo premamilar ventral. [5] Estas estructuras son importantes en otros comportamientos sociales, como los comportamientos sexuales y agresivos. Además, también se moviliza el núcleo premamilar, la parte dorsomedial pero no la ventrolateral. [5] Las lesiones en este núcleo anulan el comportamiento defensivo pasivo, como el congelamiento y la postura "sobre la espalda". [5]
Dentro del cerebro, la histamina es sintetizada exclusivamente por neuronas con sus cuerpos celulares en el núcleo tuberomamilar (NTM) que se encuentra dentro del hipotálamo posterior. En los seres humanos hay aproximadamente 64.000 neuronas histaminérgicas por lado. Estas células se proyectan por todo el cerebro y la médula espinal. Las áreas que reciben proyecciones especialmente densas incluyen la corteza cerebral, el hipocampo, el neostriatum, el núcleo accumbens, la amígdala y el hipotálamo. ... Si bien la función mejor caracterizada del sistema de histamina en el cerebro es la regulación del sueño y la excitación, la histamina también participa en el aprendizaje y la memoria ... También parece que la histamina participa en la regulación de la alimentación y el equilibrio energético.