

Se cree que la evolución de los cetáceos comenzó en el subcontinente indio a partir de los ungulados pares (Artiodactyla) hace 50 millones de años (mya) y se desarrolló a lo largo de un período de al menos 15 millones de años. [2] Los cetáceos son mamíferos marinos totalmente acuáticos que pertenecen al orden Artiodactyla y se separaron de otros artiodáctilos hace alrededor de 50 millones de años . Se cree que los cetáceos evolucionaron durante el Eoceno (56-34 millones de años), la segunda época de la actual Era Cenozoica. Los análisis moleculares y morfológicos sugieren que los cetáceos comparten un ancestro común más cercano relativamente reciente con los hipopótamos y que son grupos hermanos. [3] Al ser mamíferos, salen a la superficie para respirar aire; tienen 5 huesos de los dedos (pares) en las aletas; amamantan a sus crías; y, a pesar de su estilo de vida totalmente acuático, conservan muchas características esqueléticas de sus ancestros terrestres. [4] [5] Una investigación realizada a finales de la década de 1970 en Pakistán reveló varias etapas en la transición de los cetáceos de la tierra al mar.
Se cree que los dos pares modernos de cetáceos, Mysticeti (ballenas barbadas) y Odontoceti (ballenas dentadas), se separaron entre sí alrededor de 28 a 33 millones de años en una segunda radiación de cetáceos , la primera ocurrió con los arqueocetos . [6] La adaptación de la ecolocalización animal en las ballenas dentadas las distingue de los arqueocetos totalmente acuáticos y de las primeras ballenas barbadas . La presencia de barbas en las ballenas barbadas se produjo gradualmente, y las variedades anteriores tenían muy pocas barbas, y su tamaño está relacionado con la dependencia de las barbas (y el posterior aumento de la alimentación por filtración).
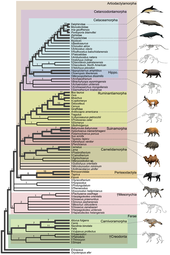

El estilo de vida acuático de los cetáceos comenzó en el subcontinente indio a partir de los ungulados pares hace 50 millones de años, y esta etapa inicial duró aproximadamente entre 4 y 15 millones de años. [8] Archaeoceti es un parvorder extinto de Cetacea que contiene ballenas antiguas. La hipótesis tradicional de la evolución de los cetáceos, propuesta por primera vez por Van Valen en 1966, [9] era que las ballenas estaban relacionadas con los mesoniquios , un orden extinto de ungulados carnívoros (animales con pezuñas) que se parecían a los lobos con pezuñas y eran un grupo hermano de los artiodáctilos. (ungulados pares). Esta hipótesis se propuso debido a las similitudes entre los inusuales dientes triangulares de los mesoniquios y los de las primeras ballenas. Sin embargo, los datos de filogenia molecular indican que las ballenas están muy estrechamente relacionadas con los artiodáctilos, siendo los hipopótamos su pariente vivo más cercano. Debido a esta observación, los cetáceos y los hipopótamos se ubican en el mismo suborden , Whippomorpha . [10] Cetartiodactyla (formado a partir de las palabras Cetacea y Artiodactyla) es un nombre propuesto para un orden que incluye tanto cetáceos como artiodáctilos. Sin embargo, los antracoterios más antiguos , los antepasados de los hipopótamos, no aparecen en el registro fósil hasta el Eoceno medio, millones de años después de Pakicetus , mientras que el primer ancestro de las ballenas conocido apareció durante el Eoceno temprano; esta diferencia de tiempo implica que los dos grupos divergieron mucho antes del Eoceno. El análisis molecular identifica a los artiodáctilos como muy estrechamente relacionados con los cetáceos, por lo que los mesoniquios probablemente sean una rama de Artiodactyla, y los cetáceos no derivaron directamente de los mesoniquios, pero los dos grupos pueden compartir un ancestro común. [11]
Los datos moleculares están respaldados por el descubrimiento de Pakicetus , el arqueoceto más antiguo . Los esqueletos de Pakicetus muestran que las ballenas no derivaron directamente de los mesoniquios. En cambio, son artiodáctilos que comenzaron a llegar al agua poco después de que los artiodáctilos se separaron de los mesoniquios. Los arqueocetos conservaron aspectos de su ascendencia mesoníquia (como los dientes triangulares) que los artiodáctilos modernos y las ballenas modernas han perdido. Los primeros ancestros de todos los mamíferos ungulados probablemente fueron, al menos en parte, carnívoros o carroñeros, y los artiodáctilos y perisodáctilos actuales se convirtieron en herbívoros más adelante en su evolución. Las ballenas, sin embargo, mantuvieron su dieta carnívora porque las presas estaban más disponibles y necesitaban un mayor contenido calórico para vivir como endotermos marinos (de sangre caliente). Los mesoniquios también se convirtieron en carnívoros especializados, pero esto probablemente fue una desventaja porque las presas grandes eran poco comunes. Esta puede ser la razón por la que fueron superados por animales mejor adaptados como los hienodontidos y más tarde los Carnivora . [11]
Indohyus era un pequeño animal parecido a un chevrotain que vivió hace unos 48 millones de años en lo que hoy es Cachemira . [12] Pertenece a la familia de artiodáctilos Raoellidae , que se cree que es el grupo hermano más cercano de Cetacea . Indohyus se identifica como un artiodáctilo porque tiene dos bisagras de tróclea , un rasgo exclusivo de los artiodáctilos. [7] Aproximadamente del tamaño de un mapache o un gato doméstico, esta criatura omnívora compartía algunos rasgos de las ballenas modernas, en particular el involucrum , un patrón de crecimiento óseo que es la característica diagnóstica de cualquier cetáceo; esto no se encuentra en ninguna otra especie. [1] También mostró signos de adaptaciones a la vida acuática, incluidos huesos densos de las extremidades que reducen la flotabilidad para que puedan permanecer bajo el agua, que son similares a las adaptaciones que se encuentran en los mamíferos acuáticos modernos como el hipopótamo. [10] [13] Esto sugiere una estrategia de supervivencia similar a la del chevrotain africano o chevrotain de agua que, cuando se ve amenazado por un ave de presa, se sumerge en el agua y se esconde debajo de la superficie durante hasta cuatro minutos. [14]
Los primeros fósiles de Indohyus fueron desenterrados por el geólogo indio A. Ranga Rao. [15] Descubrió algunos dientes y una mandíbula entre las rocas que había recogido. Después de su muerte, su viuda Leelavathi Rao donó las rocas al profesor Hans Thewissen . Su técnico rompió accidentalmente un par de rocas donadas y descubrió fósiles de Indohyus adicionales.
Los pakicetidos eran mamíferos con pezuñas digitígrados que se cree que fueron los primeros cetáceos conocidos, siendo Indohyus el grupo hermano más cercano. [12] [16] Vivieron a principios del Eoceno , hace unos 50 millones de años. Sus fósiles fueron descubiertos por primera vez en el norte de Pakistán en 1979, ubicado en un río no lejos de las orillas del antiguo mar de Tetis . [17] Después del descubrimiento inicial, se encontraron más fósiles, principalmente en los depósitos fluviales del Eoceno temprano en el norte de Pakistán y el noroeste de la India. Según este descubrimiento, lo más probable es que los pakicetidos vivieran en un ambiente árido con arroyos efímeros y llanuras aluviales moderadamente desarrolladas hace millones de años. [1] Mediante el uso de análisis de isótopos de oxígeno estables , se demostró que bebían agua dulce, lo que implica que vivían alrededor de cuerpos de agua dulce. [18] Su dieta probablemente incluía animales terrestres que se acercaban al agua para beber o algunos organismos acuáticos de agua dulce que vivían en el río. [1] Las vértebras cervicales alargadas y las cuatro vértebras sacras fusionadas son consistentes con artiodáctilos, lo que convierte a Pakicetus en uno de los primeros fósiles recuperados del período posterior al evento de divergencia Cetacea/Artiodactyla . [19]
Los pakicetidos se clasifican como cetáceos principalmente debido a la estructura de la bulla auditiva (hueso del oído), que se forma únicamente a partir del hueso ectotimpánico . La forma de la región de la oreja en los pakicetidos es muy inusual y el cráneo se parece al de un cetáceo, aunque en esta etapa todavía no hay espiráculo. La mandíbula de los pakicetidos también carece del espacio agrandado ( agujero mandibular ) que está lleno de grasa o aceite, que se utiliza para recibir el sonido submarino en los cetáceos modernos. [20] Tienen órbitas dorsales (cuencas de los ojos hacia arriba), que son similares a las de los cocodrilos. Esta ubicación de los ojos ayuda a los depredadores sumergidos a observar presas potenciales sobre el agua. [18] Según un estudio de 2009, los dientes de los pakicetidos también se parecen a los dientes de las ballenas fósiles, se parecen menos a los incisivos de un perro y tienen dientes triangulares dentados, que es otro vínculo con los cetáceos más modernos. [21] Inicialmente se pensó que los oídos de los pakicetidos estaban adaptados para oír bajo el agua, pero, como se esperaría de la anatomía del resto de esta criatura, los oídos de los pakicétidos están especializados para oír en tierra. [22] Sin embargo, los pakicetidos pudieron escuchar bajo el agua mediante el uso de conducción ósea mejorada, en lugar de depender de la membrana timpánica como otros mamíferos terrestres. Este método de audición no proporcionaba una audición direccional bajo el agua. [20]
Los pakicetidos tienen piernas largas y delgadas, con manos y pies relativamente cortos, lo que sugiere que eran malos nadadores. [1] Para compensar esto, sus huesos son inusualmente gruesos ( osteoscleróticos ), lo que probablemente sea una adaptación para hacer que el animal sea más pesado para contrarrestar la flotabilidad del agua. [7] Según un análisis morfológico de 2001 realizado por Thewissen et al., los pakicetidos no muestran ninguna adaptación esquelética acuática; en cambio, muestran adaptaciones para correr y saltar. Por lo tanto, lo más probable es que los pakicetidos fueran aves limícolas acuáticas. [23]
Ambulocetus , que vivió hace unos 49 millones de años, fue descubierto en Pakistán en 1994. Eran mamíferos vagamente parecidos a los cocodrilos , que poseían grandes mandíbulas brevirostrina. En el Eoceno, los ambulocétidos habitaban las bahías y estuarios del mar de Tetis en el norte de Pakistán. Los fósiles de ambulocétidos siempre se encuentran en depósitos marinos poco profundos cercanos a la costa asociados con abundantes fósiles de plantas marinas y moluscos litorales . [1] Aunque se encuentran únicamente en depósitos marinos, sus valores de isótopos de oxígeno indican que consumieron una variedad de agua con diferentes grados de salinidad, teniendo algunos ejemplares no evidencia de consumo de agua de mar y otros que no ingirieron agua dulce en el momento. época en la que se fosilizaron sus dientes. Está claro que los ambulocétidos toleraron una amplia gama de concentraciones de sal. Por lo tanto, los ambulocétidos representan una fase de transición de los ancestros de los cetáceos entre el agua dulce y el hábitat marino. [18]
El agujero mandibular en los ambulocétidos había aumentado de tamaño, lo que indica que era probable que se albergara una almohadilla de grasa en la mandíbula inferior. En las ballenas dentadas modernas, esta almohadilla de grasa en el agujero mandibular se extiende posteriormente hasta el oído medio. Esto permite que los sonidos se reciban en la mandíbula inferior y luego se transmitan a través de la almohadilla grasa hasta el oído medio. Al igual que los pakicetids, las órbitas de los ambulocetids están en la parte superior del cráneo, pero miran más lateralmente que en los pakicetids. [18]
Los ambulocétidos tenían extremidades relativamente largas con patas traseras particularmente fuertes y conservaban una cola sin signos de aleta caudal . [17] La estructura de las extremidades posteriores de los Ambulocétidos muestra que su capacidad para participar en la locomoción terrestre era significativamente limitada en comparación con la de los mamíferos terrestres contemporáneos, y probablemente no llegaron a la tierra en absoluto. Las estructuras esqueléticas de la rodilla y el tobillo indican que el movimiento de las extremidades traseras estaba restringido a un solo plano. Esto sugiere que, en tierra, la propulsión de las extremidades traseras estaba impulsada por la extensión de los músculos dorsales. [24] Probablemente nadaban mediante remo pélvico (una forma de nadar que utiliza principalmente sus extremidades traseras para generar propulsión en el agua) y ondulación caudal (una forma de nadar que utiliza las ondulaciones de la columna vertebral para generar fuerza para los movimientos), como las nutrias , las focas y los cetáceos modernos lo hacen. [25] Esta es una etapa intermedia en la evolución de la locomoción de los cetáceos, ya que los cetáceos modernos nadan mediante oscilación caudal (una forma de nadar similar a la ondulación caudal, pero es más eficiente energéticamente). [18]
Un estudio reciente sugiere que los ambulocétidos eran completamente acuáticos como los cetáceos modernos, poseían una morfología torácica similar y no podían soportar su peso en tierra. Esto sugiere que el abandono total de la tierra se produjo entre los cetáceos mucho antes de lo que se pensaba anteriormente. Sin embargo, los científicos involucrados en el estudio advirtieron que el estudio estaba limitado por la falta de información sobre la densidad exacta del hueso, la ubicación del centro de masa y la dependencia de costillas falsas para el soporte torácico. [26]
Los remingtonocétidos vivieron en el Eoceno medio en el sur de Asia , hace entre 49 y 43 millones de años. [27] En comparación con las familias Pakicetidae y Ambulocetidae, Remingtonocetidae era una familia diversa que se encontraba en el norte y centro de Pakistán y en el oeste de la India. Los remingtonocétidos también se encontraron en depósitos marinos poco profundos, pero obviamente eran más acuáticos que los ambulocétidos. Esto se demuestra por la recuperación de sus fósiles de una variedad de ambientes marinos costeros, incluidos depósitos cercanos a la costa y lagunares. [1] Según el análisis de isótopos estables de oxígeno, la mayoría de los remingtonocétidos no ingirieron agua dulce y, por lo tanto, habían perdido su dependencia del agua dulce relativamente pronto después de su origen. [18]
Las órbitas de los remingtonocétidos estaban orientadas lateralmente y eran pequeñas. Esto sugiere que la visión no era un sentido importante para ellos. La abertura nasal, que eventualmente se convierte en el espiráculo de los cetáceos modernos, estaba ubicada cerca de la punta del hocico . La posición de la abertura nasal no había cambiado desde los pakicetidos. [18] Una de las características notables de los remingtonocétidos es que los canales semicirculares , que son importantes para el equilibrio en los mamíferos terrestres, habían disminuido de tamaño. [28] Esta reducción de tamaño había acompañado de cerca la radiación de los cetáceos en ambientes marinos. Según un estudio de 2002 realizado por Spoor et al., esta modificación del sistema de canales semicirculares puede representar un "punto sin retorno" crucial en la evolución temprana de los cetáceos, que excluía una fase semiacuática prolongada. [28]
En comparación con los ambulocétidos, los remingtonocétidos tenían extremidades relativamente cortas. [18] Según sus restos esqueléticos, los remingtonocétidos probablemente eran cetáceos anfibios que estaban bien adaptados a la natación y probablemente nadaban únicamente mediante la ondulación caudal. [1]
Los protocétidos forman un grupo diverso y heterogéneo conocido en Asia, Europa, África y América del Norte. Vivieron en el Eoceno, hace aproximadamente entre 48 y 35 millones de años. Los restos fósiles de protocétidos se descubrieron en facies costeras y lagunares del sur de Asia; A diferencia de familias de cetáceos anteriores, sus fósiles descubiertos en África y América del Norte también incluyen formas marinas abiertas. [1] Probablemente eran anfibios, pero más acuáticos en comparación con los remingtonocétidos. [27] Los protocétidos fueron los primeros cetáceos que abandonaron el subcontinente indio y se dispersaron por todos los océanos subtropicales poco profundos del mundo. [18] Había muchos géneros dentro de la familia Protocetidae. Hubo diferentes grados de adaptaciones acuáticas en este grupo, algunos capaces de soportar su peso en tierra y otros no. [1] El descubrimiento del Peregocetus del Pacífico sureste indica que cruzaron el Atlántico y alcanzaron una distribución en circunstancias ecuatoriales hace 40 millones de años. [29] Su naturaleza anfibia está respaldada por el descubrimiento de una Maiacetus embarazada , en la que el feto fosilizado estaba colocado para un parto de cabeza, lo que sugiere que Maiacetus dio a luz en tierra. Si dieran a luz en el agua, el feto se colocaría para dar a luz con la cola primero para evitar ahogarse durante el parto. [30]
A diferencia de los remingtonocétidos y los ambulocétidos, los protocétidos tienen órbitas grandes orientadas lateralmente. Se podrían utilizar cada vez más ojos orientados hacia los lados para observar presas bajo el agua, y son similares a los ojos de los cetáceos modernos. Además, las aberturas nasales eran grandes y llegaban hasta la mitad del hocico. La gran variedad de dientes sugiere diversos modos de alimentación en los protocétidos. [27] Tanto en los remingtonocétidos como en los protocétidos, el tamaño del agujero mandibular había aumentado. [18] El gran agujero mandibular indica que la almohadilla de grasa mandibular estaba presente. Sin embargo, los senos llenos de aire que están presentes en los cetáceos modernos, cuya función es aislar acústicamente el oído para permitir una mejor audición bajo el agua, todavía no estaban presentes. [20] También estaba presente el meato auditivo externo ( canal auditivo ), que está ausente en los cetáceos modernos. Por tanto, el método de transmisión del sonido que estaban presentes en ellos combina aspectos de los pakicetidos y los odontocetos modernos (ballenas dentadas). [20] En esta etapa intermedia del desarrollo de la audición, la transmisión del sonido aéreo era deficiente debido a las modificaciones del oído para la audición bajo el agua, mientras que la audición direccional bajo el agua también era deficiente en comparación con los cetáceos modernos. [20]
Algunos protocétidos tenían patas delanteras y traseras cortas y anchas que probablemente se utilizaban para nadar, pero las extremidades proporcionaban una locomoción lenta y engorrosa en tierra. [18] Es posible que algunos protocétidos tuvieran duelas. Sin embargo, está claro que se adaptaron aún más a un estilo de vida acuático. En Rodhocetus , por ejemplo, el sacro (un hueso que, en los mamíferos terrestres, es una fusión de cinco vértebras que conecta la pelvis con el resto de la columna vertebral ) estaba dividido en vértebras sueltas. Sin embargo, la pelvis todavía estaba conectada a una de las vértebras sacras. La ascendencia ungulada de estos arqueocetos todavía está subrayada por características como la presencia de pezuñas en los extremos de los dedos de los pies en Rodhocetus . [31]
La estructura del pie de Rodhocetus muestra que los protocétidos eran predominantemente acuáticos. Un estudio de 2001 realizado por Gingerich et al. Planteó la hipótesis de que Rodhocetus se movía en el ambiente oceánico de manera similar a cómo los ambulocétidos remaban en la pelvis, que se complementaba con la ondulación caudal. La locomoción terrestre de Rodhocetus era muy limitada debido a la estructura de sus extremidades traseras. Se cree que se movían de una manera similar a como se mueven las focas con orejas en tierra, girando sus aletas traseras hacia adelante y debajo de su cuerpo. [32]

Los basilosáuridos y los dorudontinos vivieron juntos a finales del Eoceno, hace entre 41 y 33,9 millones de años, y son los cetáceos acuáticos obligados más antiguos conocidos. [22] Eran ballenas totalmente reconocibles que vivían enteramente en el océano. Esto está respaldado por sus fósiles que generalmente se encuentran en depósitos indicativos de ambientes completamente marinos, sin afluencia de agua dulce. [1] Probablemente se distribuyeron por los mares tropicales y subtropicales del mundo. Los basilosáuridos se encuentran comúnmente asociados con los dorudontinos y estaban estrechamente relacionados entre sí. [18] El contenido del estómago fosilizado de un basilosáurido indica que comía pescado. [1]
Aunque se parecen mucho a los cetáceos modernos, los basilosáuridos carecían del ' órgano melón ' que permite a las ballenas dentadas utilizar la ecolocalización . Tenían cerebros pequeños; esto sugiere que eran solitarios y no tenían las complejas estructuras sociales de algunos cetáceos modernos. El agujero mandibular de los basilosáuridos cubría toda la profundidad de la mandíbula inferior como en los cetáceos modernos. Sus órbitas miraban lateralmente y la abertura nasal se había movido aún más arriba en el hocico, más cerca de la posición del espiráculo en los cetáceos modernos. [18] Además, las estructuras de sus orejas eran funcionalmente modernas, con la inserción de senos llenos de aire entre la oreja y el cráneo. [20] A diferencia de los cetáceos modernos, los basilosáuridos conservaban un gran meato auditivo externo. [20]
Ambos basilosáuridos tienen esqueletos que son inmediatamente reconocibles como cetáceos. Un basilosáurido era tan grande como las ballenas modernas más grandes, con géneros como Basilosaurus que alcanzaban longitudes de hasta 60 pies (18 m); Los dorudontinos eran más pequeños, con géneros como Dorudon que alcanzaban unos 4,6 m (15 pies) de largo. El gran tamaño de los basilosáuridos se debe al extremo alargamiento de sus vértebras lumbares. Tenían una aleta caudal, pero las proporciones de su cuerpo sugieren que nadaban mediante la ondulación caudal y que la aleta caudal no se usaba para propulsión. [1] [33] Por el contrario, los dorudontinos tenían una columna vertebral más corta pero poderosa. Ellos también tenían una casualidad y, a diferencia de los basilosáuridos, probablemente nadaban de manera similar a los cetáceos modernos, utilizando oscilaciones caudales. [18] Las extremidades anteriores de los basilosáuridos probablemente tenían forma de aleta, y las extremidades traseras externas eran pequeñas y ciertamente no participaban en la locomoción. [1] Sus dedos, sin embargo, conservaron las articulaciones móviles de sus parientes ambulocétidos. Las dos pequeñas pero bien formadas patas traseras de los basilosáuridos probablemente se utilizaban como sujetadores durante el apareamiento. Los huesos pélvicos asociados con estas extremidades traseras no estaban conectados a la columna vertebral como lo estaban en los protocétidos. Básicamente, las vértebras sacras ya no se pueden distinguir claramente de las demás vértebras. [1] [34]
Tanto los basilosáuridos como los dorudontinos están relativamente estrechamente relacionados con los cetáceos modernos, que pertenecen a los parvórdenes Odontoceti y Mysticeti . Sin embargo, según un estudio de 1994 realizado por Fordyce y Barnes, el gran tamaño y el cuerpo vertebral alargado de los basilosáuridos les impiden ser ancestrales de las formas existentes. En cuanto a los dorudontinos, hay algunas especies dentro de la familia que no tienen cuerpos vertebrales alargados, que podrían ser los ancestros inmediatos de Odontoceti y Mysticeti. Los otros basilosáuridos se extinguieron. [27]

Todas las ballenas barbadas o misticetos modernos se alimentan por filtración y tienen barbas en lugar de dientes, aunque el medio exacto por el cual se utilizan las barbas difiere entre especies (alimentación por boca en los balaenopteridos, alimentación desnatada en los balaenidos y arado de fondo en los eschrichtiidos). Los primeros miembros de ambos grupos aparecieron durante el Mioceno medio . La alimentación por filtración es muy beneficiosa ya que permite a las ballenas barbadas obtener enormes recursos energéticos de manera eficiente, lo que hace posible el gran tamaño corporal en las variedades modernas. [35] El desarrollo de la alimentación por filtración puede haber sido el resultado de cambios ambientales a nivel mundial y cambios físicos en los océanos. Un cambio a gran escala en la corriente y la temperatura del océano podría haber contribuido a la radiación de los misticetos modernos. [36] Las variedades anteriores de ballenas barbadas, o "arqueomisticetes", como Janjucetus y Mammalodon tenían muy pocas barbas y dependían principalmente de sus dientes. [37]
También hay evidencia de un componente genético en la evolución de las ballenas desdentadas. Se han identificado múltiples mutaciones en genes relacionados con la producción de esmalte en las ballenas barbadas modernas. [38] Estas son principalmente mutaciones de inserción/deleción que resultan en codones de parada prematuros. [38] Se plantea la hipótesis de que estas mutaciones ocurrieron en cetáceos que ya poseían estructuras de barbas preliminares, lo que llevó a la pseudogenización de un "juego de herramientas genéticas" para la producción de esmalte. [39] Investigaciones recientes también han indicado que el desarrollo de las barbas y la pérdida de los dientes cubiertos de esmalte ocurrieron una vez y ambos ocurrieron en la rama del tallo del misticeto.
Generalmente se especula que las cuatro familias modernas de misticetos tienen orígenes separados entre los cetoterios . Las ballenas barbadas modernas, Balaenopteridae (rorcuales y ballena jorobada, Megaptera novaengliae ), Balaenidae (ballenas francas), Eschrichtiidae (ballena gris, Eschrictius robustus ) y Neobalaenidae (ballena franca pigmea, Caperea marginata ) tienen características derivadas actualmente desconocidas en cualquier cetoterio y viceversa (como una cresta sagital [40] ). [41] Los misticetos también son conocidos por su gigantismo, ya que las ballenas barbadas se encuentran entre los organismos más grandes que jamás hayan existido; alcanzan longitudes superiores a los 20 my pesan más de 100.000 kg. [42] Este gigantismo está directamente relacionado con su mecanismo de alimentación: se ha descubierto que el tamaño del misticeto depende de la cantidad de barbas que un misticeto puede utilizar para filtrar a sus presas. [43] Además, el tamaño es un rasgo seleccionado positivamente que le da a los misticetos un impulso en su condición física. [44] Por lo tanto, las poblaciones de misticetos se volverán aún más gigantescas a medida que se seleccionen ballenas con mayores cantidades de barbas.
La adaptación de la ecolocalización se produjo cuando las ballenas dentadas (Odontoceti) se separaron de las ballenas barbadas y distingue a las ballenas dentadas modernas de los arqueocetos totalmente acuáticos. Esto ocurrió hace unos 34 millones de años en una segunda radiación de cetáceos . [45] [46] Las ballenas dentadas modernas no dependen de su sentido de la vista, sino más bien de su sonar para cazar presas. La ecolocalización también permitió a las ballenas dentadas sumergirse más profundamente en busca de alimento, sin que la luz ya fuera necesaria para la navegación, lo que abrió nuevas fuentes de alimento. [27] [47] Las ballenas dentadas se ecolocalizan creando una serie de clics emitidos en varias frecuencias. Los pulsos de sonido se emiten, se reflejan en los objetos y se recuperan a través de la mandíbula inferior. Los cráneos de Squalodon muestran evidencia de la primera aparición hipotética de ecolocalización. [48] Squalodon vivió desde el Oligoceno temprano hasta el medio y el Mioceno medio , hace alrededor de 33 a 14 millones de años. Squalodon presentaba varios puntos en común con las ballenas dentadas modernas: el cráneo estaba bien comprimido (para dejar espacio para el melón, una parte de la nariz ), la tribuna se extendía hacia afuera formando un pico, una característica de las ballenas dentadas modernas que le daba a Squalodon una apariencia similar. a ellos. Sin embargo, se cree poco probable que los escualodóntidos sean ancestros directos de las ballenas dentadas modernas. [49]
Los primeros delfines oceánicos, como los kentriodontos , evolucionaron a finales del Oligoceno y se diversificaron mucho a mediados del Mioceno. [50] Los primeros cetáceos fósiles cerca de mares poco profundos (donde habitan las marsopas) se encontraron alrededor del Pacífico Norte; especies como Semirostrum se encontraron a lo largo de California (en lo que entonces eran estuarios). [51] Estos animales se extendieron a las costas europeas y al hemisferio sur sólo mucho más tarde, durante el Plioceno . [52] El ancestro más antiguo conocido de las ballenas árticas es Denebola brachycephala de finales del Mioceno, hace alrededor de 9 a 10 millones de años. [53] Un solo fósil de Baja California indica que la familia alguna vez habitó en aguas más cálidas. [27] [54] [55]

Los cachalotes antiguos se diferencian de los modernos en el número de dientes y en la forma de la cara y las mandíbulas. Por ejemplo, Scaldicetus tenía una tribuna ahusada . Los géneros del Oligoceno y Mioceno tenían dientes en la mandíbula superior. Estas diferencias anatómicas sugieren que estas especies antiguas pueden no haber sido necesariamente cazadoras de calamares de aguas profundas como el cachalote moderno, sino que algunos géneros comían principalmente pescado. [27] [56] A diferencia de los cachalotes modernos, la mayoría de los cachalotes antiguos fueron construidos para cazar ballenas. Livyatan tenía una tribuna corta y ancha que medía 10 pies (3,0 m) de ancho, lo que le daba a la ballena la capacidad de infligir daños importantes a presas grandes que luchaban, como otras ballenas primitivas. Especies como estas se conocen colectivamente como cachalotes asesinos o cachalotes macroraptoriales . [56] [57]
Los zifios constan de más de 20 géneros. [58] [59] Las variedades anteriores probablemente fueron presa de cachalotes asesinos y tiburones grandes como el megalodón . En 2008, se descubrió una gran cantidad de ziphiidos fósiles frente a la costa de Sudáfrica, lo que confirma que las especies restantes de ziphiidos podrían ser simplemente un remanente de una diversidad mayor que desde entonces se ha extinguido. Después de estudiar numerosos cráneos fósiles, los investigadores descubrieron la ausencia de dientes maxilares funcionales en todos los ziphiids sudafricanos, lo que es evidencia de que la alimentación por succión ya se había desarrollado en varios linajes de zifios durante el Mioceno. Los ziphiids extintos también tenían cráneos robustos, lo que sugiere que los colmillos se usaban para las interacciones entre hombres. [58]
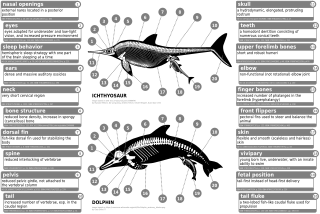
Los cetáceos modernos tienen extremidades traseras internas y rudimentarias, como fémures, peroné y tibias reducidos, y una cintura pélvica . Indohyus tiene un labio interno ectotimpánico engrosado del hueso del oído. Esta característica se compara directamente con la de los cetáceos modernos. Otra característica similar fue la composición de los dientes, que contenían principalmente fosfato de calcio , que es necesario para que los animales acuáticos coman y beban, aunque, a diferencia de las ballenas dentadas modernas, tenían una dentición heterodonte (morfología de más de un diente) en lugar de una dentición homodóntica (morfología de un diente presente). [60] Aunque se parecían un poco a un lobo, los fósiles de pakicetidos mostraban que las cuencas de los ojos estaban mucho más cerca de la parte superior de su cabeza que las de otros mamíferos terrestres, pero similares a la estructura de los ojos de los cetáceos. Su transición de la tierra al agua provocó una remodelación del cráneo y del equipo de procesamiento de alimentos porque los hábitos alimentarios estaban cambiando. El cambio de posición de los ojos y los huesos de las extremidades se asocia con el hecho de que los pakicetidos se conviertan en aves zancudas. Los ambulocétidos también comenzaron a desarrollar hocicos largos, como se ve en los cetáceos actuales. Sus extremidades (y su supuesto movimiento) eran muy similares a las de las nutrias. [61]
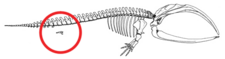
La falta de extremidades en los cetáceos no representa una regresión de las extremidades completamente formadas ni la ausencia de iniciación de las yemas de las extremidades, sino más bien una detención del desarrollo de las yemas de las extremidades. [62] Las yemas de las extremidades se desarrollan normalmente en los embriones de cetáceos. [10] [63] Las yemas de las extremidades progresan a la fase de condensación de la esqueletogénesis temprana, donde los nervios crecen hacia las yemas de las extremidades y la cresta ectodérmica apical (AER), una estructura que garantiza el desarrollo adecuado de las extremidades, parece funcional. [62] [63] Ocasionalmente, los genes que codifican extremidades más largas hacen que una ballena moderna desarrolle patas en miniatura ( atavismo ). [64]

Pakicetus tenía un hueso pélvico muy similar al de los mamíferos terrestres. En especies posteriores, como Basilosaurus , el hueso pélvico, que ya no estaba unido a las vértebras ni al ilion , estaba reducido. [60] Se cree que ciertos genes son responsables de los cambios que se produjeron en la estructura pélvica de los cetáceos, como BMP7 , PBX1 , PBX2 , PRRX1 y PRRX2 . [65] Alguna vez se pensó que la cintura pélvica en los cetáceos modernos eran estructuras vestigiales que no servían para ningún propósito. La cintura pélvica de los cetáceos machos tiene un tamaño diferente al de las hembras, y se cree que el tamaño es el resultado del dimorfismo sexual. [66] Los huesos pélvicos de los cetáceos machos modernos son más masivos, más largos y más grandes que los de las hembras. Debido al dimorfismo sexual mostrado, lo más probable es que estuvieran involucrados en el soporte de los genitales masculinos que permanecen ocultos detrás de las paredes abdominales hasta que ocurre la reproducción sexual. [65] [67] [68]
Los primeros arqueocetos, como Pakicetus, tenían aberturas nasales al final del hocico , pero en especies posteriores, como Rodhocetus , las aberturas habían comenzado a desplazarse hacia la parte superior del cráneo. Esto se conoce como deriva nasal. [69] Las fosas nasales de los cetáceos modernos se han modificado para convertirse en espiráculos que les permiten salir a la superficie, inhalar y sumergirse con comodidad. Las orejas también comenzaron a moverse hacia adentro y, en el caso del Basilosaurus , el oído medio comenzó a recibir vibraciones de la mandíbula inferior. Las ballenas dentadas modernas de hoy utilizan su órgano melancólico, una almohadilla de grasa, para la ecolocalización . [70]
Hay tres eventos de radiación importantes que marcan la diversificación y especiación en la historia evolutiva de los Cetáceos. El primero ocurrió alrededor del Eoceno medio (40 millones de años), cuando estos primeros cetáceos abandonaron sus hábitats ribereños y costeros poco profundos, preparando el escenario para Protocetidae, el primer cetáceo completamente marino. [1] Con los océanos y sus nutrientes a su disposición, los protocétidos en rápida diversificación también fueron responsables de la primera gran expansión geográfica, dispersándose por el norte de África, Europa y América del Norte. [19] El segundo de tres eventos de radiación importantes ocurrió cerca del inicio del Oligoceno (~34 millones de años) cuando Neoceti divergió de Basilosauridae. [5] Este evento de radiación ocurre simultáneamente con la desintegración de Gondwana y la apertura del Océano Austral, cambiando enormemente los ecosistemas oceánicos, la productividad y los gradientes de temperatura. [71] El momento de este segundo evento de radiación no es una coincidencia, ya que la siguiente diversificación de los cetáceos probablemente se debió a las nuevas oportunidades ecológicas que les brindó el cambio en los océanos. [72] El último evento de radiación importante, que ocurrió a lo largo del Mioceno medio y en el Plioceno (12 millones de años a 2 millones de años), no se debió a un evento específico, sino que está asociado con una expansión genérica generalizada de odontocetos y misticetos. [19] [71] Algunos géneros modernos de cetáceos comenzaron a surgir, incluido Balaenoptera , un género de rorcuales que incluye a la ballena azul. [19] [71] Los Delphinidae, delfines oceánicos, también surgieron durante este evento de radiación a finales del Mioceno. [71]
La cultura es un comportamiento específico de un grupo transferido por el aprendizaje social. El uso de herramientas para ayudar con la búsqueda de alimento es un ejemplo. El hecho de que un delfín utilice o no una herramienta afecta su comportamiento alimentario, lo que provoca diferencias en la dieta. Además, el uso de una herramienta permite que se abra un nuevo nicho y una nueva presa para ese delfín en particular. Debido a estas diferencias, los niveles de aptitud física cambian dentro de los delfines de una población, lo que provoca que se produzca una evolución a largo plazo. [74] La cultura y las redes sociales han desempeñado un papel importante en la evolución de los cetáceos modernos, como se concluye en estudios que muestran que los delfines prefieren parejas con los mismos comportamientos socialmente aprendidos y que las ballenas jorobadas utilizan cantos entre áreas de reproducción. En particular, para los delfines, los mayores efectos no genéticos en su evolución se deben a la cultura y la estructura social. [75]
Según un estudio de 2014, la población de delfines mulares del Indo-Pacífico ( Tursiops sp.) alrededor de Shark Bay en Australia Occidental se puede dividir en esponjadores y no esponjadores. Los esponjadores se ponen esponjas marinas en el hocico como protección contra las abrasiones de objetos punzantes, púas de mantarraya u organismos tóxicos. Las esponjas también ayudan a los delfines a localizar peces sin vejiga natatoria, ya que la ecolocalización no puede detectar fácilmente a estos peces en un fondo complejo. Los esponjadores también se alimentan específicamente en canales profundos, pero los no esponjadores se encuentran buscando alimento tanto en canales profundos como poco profundos. [76] Este comportamiento de búsqueda de alimento se transmite principalmente de madre a hijo. Por lo tanto, al tratarse de un comportamiento grupal que se transmite mediante el aprendizaje social, el uso de esta herramienta se considera un rasgo cultural. [74]
Los investigadores en un estudio de 2014 en Shark Bay encontraron que los análisis de ácidos grasos entre las poblaciones del oeste y del este del Golfo difieren, lo que se debe a que las dos áreas tienen diferentes fuentes de alimentos. Sin embargo, al comparar datos dentro del Golfo Occidental, los esponjadores y los no esponjadores en los canales profundos obtuvieron resultados de ácidos grasos muy diferentes a pesar de que se encuentran en el mismo hábitat. Los no esponjas de canales profundos y poco profundos obtuvieron datos similares. Esto sugiere que la esponja fue la causa de los diferentes datos y no los canales profundos versus los superficiales. La esponja abrió un nuevo nicho para los delfines y les permitió acceder a nuevas presas, lo que provocó cambios en la dieta a largo plazo. Al producir diferentes fuentes de alimentos dentro de una población, hay menos competencia intrapoblacional por los recursos, lo que muestra un desplazamiento de carácter . Como resultado, la capacidad de carga aumenta ya que toda la población no depende de una sola fuente de alimento. Los niveles de aptitud física de la población también cambian, lo que permite que esta cultura evolucione. [76]
La estructura social forma grupos con individuos que interactúan entre sí, y esto permite que surjan, intercambien y evolucionen rasgos culturales. Esta relación se ve especialmente en las poblaciones de delfines mulares en el suroeste de Australia, que se sabe que piden comida a los pescadores. Este comportamiento de mendicidad se extendió entre la población debido al aprendizaje individual (los delfines pasan tiempo alrededor de los barcos) y social (los delfines pasan tiempo con otros delfines que expresan un comportamiento de mendicidad). [74]
Sin embargo, la cultura puede afectar la estructura social al provocar un emparejamiento de comportamiento y un apareamiento selectivo. Los individuos dentro de una determinada cultura tienen más probabilidades de aparearse con individuos que utilizan los mismos comportamientos que con un individuo aleatorio, lo que influye así en los grupos y la estructura sociales. Por ejemplo, los esponjas de Shark Bay se quedan preferentemente con otros esponjas. [74] Además, algunos delfines mulares en la Bahía Moreton , Australia, siguieron a los arrastreros de camarones para alimentarse de sus desechos, mientras que otros delfines de la misma población no lo hicieron. Los delfines se asociaban preferentemente con individuos con el mismo comportamiento a pesar de que todos vivían en el mismo hábitat. Más tarde, los arrastreros de gambas ya no estaban presentes y los delfines se integraron en una red social después de un par de años. [74]
Las redes sociales todavía pueden afectar y provocar la evolución por sí solas al imponer diferencias de aptitud física en los individuos. [77] Según un estudio de 2012, los terneros machos tenían una tasa de supervivencia más baja si tenían vínculos más fuertes con los machos jóvenes. Sin embargo, cuando se probaron otras clases de edad y sexo, su tasa de supervivencia no cambió significativamente. [78] Esto sugiere que los varones jóvenes imponen un estrés social a sus homólogos más jóvenes. De hecho, se ha documentado que los machos jóvenes comúnmente realizan actos de agresión, dominancia e intimidación contra los machos. [78] Según un estudio de 2010, ciertas poblaciones de delfines de Shark Bay tenían diferentes niveles de aptitud y éxito de cría. Esto se debe al aprendizaje social (ya sea que la madre transmitiera o no su conocimiento sobre la capacidad reproductiva a las crías) o a la fuerte asociación entre las madres delfines en la población; Al permanecer en un grupo, una madre individual no necesita estar tan alerta todo el tiempo ante los depredadores. [77]
Los estudios genéticos realizados sobre delfines Clymene ( Stenella clymene ) se centraron en sus historias naturales y los resultados muestran que el origen de la especie fue en realidad el resultado de la especiación híbrida . [79] [80] La hibridación entre delfines giradores ( Stenella longirostris ) y delfines listados ( Stenella coeruleoalba ) en el Atlántico norte fue causada por el constante intercambio de hábitat de las dos especies. Las relaciones entre estas tres especies se habían especulado de acuerdo con notables semejanzas entre las anatomías del delfín Clymene y los delfines giradores, lo que resultó en que el primero fuera considerado como subespecie del segundo hasta 1981, [81] y la posibilidad del delfín Clymene como un híbrido entre El delfín girador y el delfín listado han sido cuestionados debido a las similitudes anatómicas y de comportamiento entre estas dos especies. [82]
Las secuencias del genoma realizadas en 2013 revelaron que el delfín del río Yangtze , o "baiji" ( Lipotes vexillifer ), carece de polimorfismos de un solo nucleótido en su genoma. Después de reconstruir la historia del genoma baiji de esta especie de delfín, los investigadores descubrieron que la mayor disminución en la diversidad genética se debió probablemente a un evento de cuello de botella durante el último evento de desglaciación . Durante este período, el nivel del mar aumentaba mientras las temperaturas globales aumentaban. Otros eventos climáticos históricos también pueden correlacionarse y compararse con la historia del genoma del delfín del río Yangtze. Esto muestra cómo el cambio climático global y local puede afectar drásticamente un genoma, provocando cambios en la aptitud, la supervivencia y la evolución de una especie. [83]
La población europea de delfines comunes ( Delphinus delphis ) en el Mediterráneo se ha diferenciado en dos tipos: oriental y occidental. Según un estudio de 2012, esto parece deberse también a un reciente cuello de botella, que redujo drásticamente el tamaño de la población del Mediterráneo oriental. Además, la falta de estructura poblacional entre las regiones occidental y oriental parece contradictoria con las distintas estructuras poblacionales entre otras regiones de delfines. [84] Aunque los delfines en el área del Mediterráneo no tenían una barrera física entre sus regiones, todavía se diferenciaban en dos tipos debido a la ecología y la biología. Por lo tanto, las diferencias entre los delfines orientales y occidentales probablemente se deben a la elección de un nicho altamente especializado y no simplemente a barreras físicas. De esta manera, el medio ambiente juega un papel importante en la diferenciación y evolución de esta especie de delfín. [85]
La divergencia y especiación dentro de los delfines mulares se ha debido en gran medida a los cambios climáticos y ambientales a lo largo de la historia. Según la investigación, las divisiones dentro del género se correlacionan con períodos de rápido cambio climático. Por ejemplo, los cambios de temperatura podrían provocar que el paisaje costero cambie, que se vacíen nichos y que aparezcan oportunidades de separación. [86] En el Atlántico nororiental, específicamente, la evidencia genética sugiere que los delfines mulares se han diferenciado en tipos costeros y pelágicos. Lo más probable es que la divergencia se deba a un evento fundacional en el que un grupo grande se separó. Después de este evento, los grupos separados se adaptaron en consecuencia y formaron sus propias especializaciones y estructuras sociales. Estas diferencias hicieron que los dos grupos divergieran y permanecieran separados. [87]
Dos tipos endémicos y distintivos de ballena piloto de aleta corta , Tappanaga (o Shiogondou ), el tipo norteño más grande, y Magondou , el tipo sur más pequeño, se pueden encontrar a lo largo del archipiélago japonés, donde las distribuciones de estos dos tipos en su mayoría no se superponen por el océano oceánico. Frontera frontal alrededor del punto más oriental de Honshu . Se cree que la extinción local de los calderones de aleta larga en el Pacífico Norte en el siglo XII podría haber desencadenado la aparición de Tappanaga , provocando que los calderones de aleta corta colonizaran las zonas más frías de la variante de aleta larga. [88] [89] Ballenas con características similares a las Tappanaga también se pueden encontrar a lo largo de la isla de Vancouver y en las costas del norte de Estados Unidos. [90]
{{cite newsgroup}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )Para una revisión de la evolución de las ballenas, consulte Uhen, MD (2010). "El origen (es) de las ballenas". Revista Anual de Ciencias de la Tierra y Planetarias . 38 (1): 189–219. Código Bib : 2010AREPS..38..189U. doi : 10.1146/annurev-earth-040809-152453.