
Las células envolventes olfatorias ( OEC ), también conocidas como glía envolvente olfatoria o células gliales envolventes olfatorias , son un tipo de macroglia ( glia radial ) que se encuentra en el sistema nervioso . También se les conoce como células de Schwann olfatorias , porque envuelven los axones no mielinizados de las neuronas olfatorias de manera similar a como las células de Schwann envuelven las neuronas periféricas no mielinizadas . También comparten la propiedad de ayudar a la regeneración axonal.
Las OEC son capaces de fagocitar restos axonales in vivo e in vitro fagocitan bacterias . Se cree que la glía olfativa que expresa la enzima antimicrobiana lisozima (LYZ) desempeña un papel importante en la inmunoprotección de la mucosa , donde las neuronas están directamente expuestas al entorno externo.
Las OEC se han probado con éxito en la regeneración axonal experimental en ratas adultas con daño traumático de la médula espinal y actualmente se están realizando ensayos clínicos para obtener más información sobre las lesiones de la médula espinal y otras enfermedades neurodegenerativas .

En el sistema nervioso periférico, las OEC se encuentran dispersas dentro del epitelio olfatorio y el nervio olfatorio . En el sistema nervioso central , las OEC se encuentran dentro de las dos capas exteriores del bulbo olfatorio . Durante el desarrollo, las neuronas olfatorias primitivas extienden sus axones desde la placoda olfatoria , a través del mesénquima , hacia la vesícula telencefálica. [1] Después de llegar a la vesícula telencefálica, una pequeña capa de células y axones cubre la vesícula. Los axones olfatorios invaden la lámina basal de la glía limitante y el bulbo olfatorio para crear el nervio olfatorio y las capas glomerulares . Una fracción de los precursores migratorios epiteliales dan lugar a la glía envolvente olfatoria que habita en el nervio olfatorio y las capas glomerulares. [1] Las OEC y los astrocitos interactúan entre sí para formar una nueva glía limitante . [1] Las OEC se diferencian de otras glías en su origen de desarrollo, ya que están presentes en el sistema nervioso periférico y en el sistema nervioso central. También se forman en haces de axones de neuronas sensoriales olfativas de una manera distinta a la mielinización .
Las OEC son glías radiales que realizan una variedad de funciones. Dentro del sistema olfativo fagocitan restos axonales y células muertas. Cuando se cultivan en una placa de Petri (in vitro), fagocitan bacterias. Múltiples estudios han demostrado que los OEC pueden ayudar en el tratamiento de la lesión de la médula espinal (LME) debido a sus propiedades regeneradoras en el sistema nervioso periférico y su presencia en el sistema nervioso central. [2] También se sabe que las OEC apoyan y guían los axones olfativos, crecen a través de cicatrices gliales y secretan muchos factores neurotróficos . [3]
Las OEC expresan marcadores gliales como la proteína ácida fibrilar glial , s100 y p75 , y marcadores gliales radiales como nestina y vimentina , que pueden ayudar aún más a los investigadores a comprender las características de etiquetado de estas células gliales especializadas.
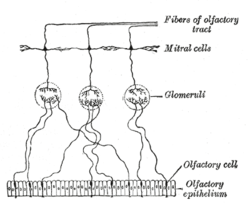
El sistema olfativo de los mamíferos es inusual porque tiene la capacidad de regenerar continuamente sus neuronas durante la edad adulta. [4] Esta capacidad está asociada con la glía envolvente olfativa. Las nuevas neuronas receptoras olfativas deben proyectar sus axones a través del sistema nervioso central hasta un bulbo olfativo para ser funcionales. El crecimiento y la regeneración de los axones olfatorios pueden atribuirse a las OEC, ya que forman los fascículos a través de los cuales los axones crecen desde el sistema nervioso periférico hasta el sistema nervioso central. [5] Las neuronas receptoras olfativas tienen una vida útil promedio de 6 a 8 semanas y, por lo tanto, deben ser reemplazadas por células diferenciadas de las células madre que se encuentran dentro de una capa en la base del epitelio cercano. El crecimiento axonal está guiado por la composición glial y la citoarquitectura del bulbo olfatorio, además de la presencia de OEC. [4]
Se cree que las OEC son en parte responsables de la neurogénesis de las neuronas olfativas primarias a través de los procesos de fasciculación , clasificación celular y orientación axonal. [6]
El daño traumático de la médula espinal causa una pérdida permanente de funciones motoras y sensoriales en el sistema nervioso central, lo que se denomina paraplejía o tetraplejía según el sitio de la lesión. Otros efectos perjudiciales pueden tener lugar en el sistema respiratorio y renal como resultado de la lesión. A diferencia del sistema nervioso periférico, el sistema nervioso central es incapaz de regenerar los axones dañados, por lo que sus conexiones sinápticas se pierden para siempre. El tratamiento actual es limitado y los principales métodos potenciales son controvertidos o no eficaces. Estudios que se remontan a los años 1990 comenzaron a investigar el sistema olfativo de los mamíferos, en particular de las ratas, para comprender mejor la regeneración axonal y la neurogénesis , así como la posible implantación de estas células en el lugar de la lesión de la médula espinal.
El trasplante de OEC a la médula espinal se ha convertido en una posible terapia para el daño de la médula espinal y otras enfermedades neuronales en modelos animales. Varios estudios recientes han informado que la prevención de la inhibición de OEC presentará una población uniforme de células en la médula espinal, creando un entorno en el que se pueden reparar los axones dañados. En octubre de 2014, el bombero polaco Darek Fidyka se convirtió en el primer paciente parapléjico que recuperó la movilidad tras un trasplante de OEC. [7] [8]
Las OEC son similares a las células de Schwann en que proporcionan una regulación positiva del receptor p75 de NGF de baja afinidad después de una lesión; sin embargo, a diferencia de las células de Schwann, producen niveles más bajos de neurotrofinas . Varios estudios han demostrado que las OEC pueden favorecer la regeneración de los axones lesionados, pero estos resultados a menudo no se pueden reproducir. [4] Independientemente, las OEC se han investigado exhaustivamente en relación con las lesiones de la médula espinal, la esclerosis lateral amiotrófica y otras enfermedades neurodegenerativas. Los investigadores sugieren que estas células poseen una capacidad única para remielinizar las neuronas lesionadas. [9]
El trasplante de células madre se ha identificado como otra posible terapia para la regeneración axonal en el sistema nervioso central al administrar estas células directamente al sitio de la lesión de la médula espinal. Tanto las OEC como las células madre/progenitoras neurales (NSPC) se han trasplantado con éxito en el sistema nervioso central de ratas adultas y han tenido resultados positivos o neutrales como método de neurogénesis y regeneración axonal; sin embargo, ninguno de los métodos ha demostrado tener efectos beneficiosos a largo plazo, ya que la supervivencia celular suele ser inferior al 1% después del trasplante. [3] La incapacidad de estas células para sostenerse después del trasplante es el resultado de la inflamación , la incapacidad de una matriz suficiente para prosperar y crear una población uniforme de células, o la respuesta migratoria de las células necesarias para reparar completamente el sitio de la lesión. . Otro problema actual con la supervivencia de las células es la utilización de los biomateriales adecuados para llevarlas al lugar de la lesión.
Un estudio ha investigado el uso de goma gellan modificada con péptidos como biomaterial con OEC y células madre/progenitoras neurales para proporcionar un entorno que permita a estas células sobrevivir después del trasplante. [3] El hidrogel de goma gellan se puede inyectar de forma mínimamente invasiva y está aprobado por la FDA como aditivo alimentario debido a su estructura química. La goma gellan se modificó con varias secuencias peptídicas derivadas de fibronectina para que las células trasplantadas tengan propiedades estrechamente relacionadas con las del tejido nativo en la matriz extracelular . [3] Al imitar el tejido nativo, es menos probable que las células de entrega sean rechazadas por el cuerpo y las funciones biológicas como la adhesión y el crecimiento celular se mejorarán a través de interacciones célula-célula y célula-matriz. Para determinar la posibilidad de que las OEC y las NPSC mejoren la viabilidad celular, ambas células se cultivaron conjuntamente en contacto directo entre sí, junto con la goma gellan modificada con péptidos. [3]
El experimento demostró que la adhesión, proliferación y viabilidad de NSPC aumentan considerablemente cuando se utiliza la goma gellan modificada con péptidos como dispositivo de trasplante en comparación con un control de goma gellan. [3] Además, el cocultivo de OEC y NSPC muestra una mayor supervivencia celular en comparación con la supervivencia celular de NSPC cultivadas solas. Los resultados proporcionan evidencia de que este método de trasplante de células es una estrategia potencial para reparar el daño de la médula espinal en el futuro.
Un estudio ha demostrado que el trasplante de células puede provocar un aumento de la temperatura corporal en un sujeto con una lesión anterior en la médula espinal. En este experimento, la temperatura corporal de los pacientes se elevó a fiebre moderada después del trasplante y duró aproximadamente de 3 a 4 días. Sin embargo, el estudio proporciona evidencia de que incluso las lesiones pasadas de la médula espinal pueden beneficiarse de la recuperación funcional neurológica que el trasplante de células madre puede proporcionar en el futuro. [10]
También se sabe que el trasplante de células madre causa toxicidad y enfermedad de injerto contra huésped (EICH). Se han administrado células apoptóticas simultáneamente con células madre hematopoyéticas en modelos de trasplante experimentales, en previsión de un mejor resultado. [11] Como resultado, la combinación previene la aloinmunización , regula positivamente las células T reguladoras (células T supresoras) y reduce la gravedad de la EICH. [11]
Las OEC tienen propiedades similares a las de los astrocitos , [12] y se ha identificado que ambos son susceptibles a la infección viral. [9] [12]
A medida que el trasplante de células madre se está convirtiendo en un medio cada vez más frecuente para tratar el daño traumático de la médula espinal, es necesario abordar y hacer más eficientes muchos procesos entre el inicio y el resultado final. Al etiquetar las OEC, estas células pueden rastrearse mediante un dispositivo de imágenes por resonancia magnética (MRI) cuando se dispersan en el sistema nervioso central [13] Un estudio reciente utilizó un nuevo tipo de partículas de óxido de hierro de tamaño micrométrico (MPIO) para etiquetar y rastrear estas células mediadas por transporte mediante resonancia magnética. [13] El experimento dio como resultado una eficiencia de etiquetado de OEC de más del 90% con un tiempo de incubación de MPIO tan corto como 6 horas, sin afectar la proliferación , migración y viabilidad celular . [13] Los MPIO también se han trasplantado con éxito al cuerpo vítreo de ojos de ratas adultas, lo que proporciona el primer protocolo detallado para el etiquetado MPIO eficiente y seguro de los OEC para su seguimiento por resonancia magnética no invasiva en tiempo real para su uso en estudios de reparación del sistema nervioso central. y regeneración axonal. [13]
Se han identificado dos subpoblaciones distintas de OEC [14] con expresión alta o baja en la superficie celular del receptor del factor de crecimiento nervioso de baja afinidad (p75).
[Fidyka], que se cree que es la primera persona en el mundo que se recupera de una rotura completa de los nervios espinales, ahora puede caminar con un andador y ha podido retomar una vida independiente, incluso hasta el punto de conducir un coche. mientras que la sensación ha regresado a sus miembros inferiores.