
La embriogénesis de Drosophila , el proceso por el cual se forman los embriones de Drosophila (mosca de la fruta), es un sistema modelo favorito para la genética y la biología del desarrollo . El estudio de su embriogénesis resolvió el rompecabezas de un siglo de cómo se controlaba el desarrollo, creando el campo de la biología evolutiva del desarrollo . [1] El tamaño pequeño, el corto tiempo de generación y el gran tamaño de la cría lo hacen ideal para estudios genéticos. Los embriones transparentes facilitan los estudios del desarrollo. Drosophila melanogaster fue introducida en el campo de los experimentos genéticos por Thomas Hunt Morgan en 1909.
La Drosophila muestra un método de desarrollo holometábolo , lo que significa que tiene tres etapas distintas de su ciclo de vida postembrionario, cada una con un plan corporal radicalmente diferente: larva, pupa y finalmente, adulto. La maquinaria necesaria para la función y la transición suave entre estas tres fases se desarrolla durante la embriogénesis . Durante la embriogénesis, la mosca en etapa larvaria se desarrollará y eclosionará en una etapa de su vida conocida como el primer estadio larvario. Las células que producirán estructuras adultas se reservan en discos imaginales . Durante la etapa de pupa, el cuerpo larvario se descompone a medida que los discos imaginales crecen y producen el cuerpo adulto. Este proceso se llama metamorfosis completa . Aproximadamente 24 horas después de la fertilización, un huevo eclosiona en una larva, que experimenta tres mudas que duran aproximadamente de 5,5 a 6 días, después de lo cual se llama pupa. La pupa se metamorfosea en una mosca adulta, lo que demora aproximadamente de 3,5 a 4,5 días. Se estima que todo el proceso de crecimiento desde el huevo hasta la mosca adulta tarda entre 10 y 12 días en completarse a 25 °C. [2]
La mosca madre produce ovocitos que ya tienen ejes anteroposterior y dorsal-ventral definidos por las actividades maternas.
La embriogénesis en Drosophila es única entre los organismos modelo en el sentido de que la división ocurre en un sincitio multinucleado (estrictamente un cenocito ). Al principio, 256 núcleos migran al perímetro del óvulo, creando el blastodermo sincitial. La línea germinal se segrega de las células somáticas mediante la formación de células polares en el extremo posterior del embrión. Después de trece divisiones mitóticas y aproximadamente 4 horas después de la fertilización, se estima que 6000 núcleos se acumulan en el citoplasma no separado del ovocito antes de migrar a la superficie y ser rodeados por membranas plasmáticas para formar células que rodean el saco vitelino produciendo un blastodermo celular.
Al igual que otros metazoos triploblásticos , la gastrulación conduce a la formación de tres capas germinales : el endodermo , el mesodermo y el ectodermo . El mesodermo se invagina a partir del surco ventral (VF), al igual que el ectodermo que dará lugar al intestino medio. Las células polares se internalizan por una vía diferente.
La elongación de la banda germinal implica muchos reordenamientos de células y la aparición de diferencias distintivas en las células de las tres bandas germinales y de varias regiones del embrión. La región posterior (incluido el intestino posterior) se expande y se extiende hacia el polo anterior a lo largo del lado dorsal del embrión. En este momento, los segmentos del embrión se vuelven visibles, creando una disposición rayada a lo largo del eje anteroposterior. Los primeros signos de segmentación aparecen durante esta fase con la formación de surcos parasegmentarios . También es cuando se forman las fosas traqueales, los primeros signos de estructuras para la respiración.
La retracción de la banda germinativa hace que el intestino posterior vuelva al lado dorsal del polo posterior y coincide con la segmentación manifiesta . Las etapas restantes implican la internalización del sistema nervioso (ectodermo) y la formación de los órganos internos (principalmente el mesodermo).

Uno de los ejemplos mejor comprendidos de formación de patrones es el patrón a lo largo del futuro eje cabeza-cola (antero-posterior) de la mosca de la fruta Drosophila melanogaster . Hay tres tipos fundamentales de genes que dan lugar a la estructura de desarrollo de la mosca: genes de efecto maternal, genes de segmentación y genes homeóticos. El desarrollo de Drosophila está particularmente bien estudiado y es representativo de una clase importante de animales, los insectos o insecta . Otros organismos multicelulares a veces utilizan mecanismos similares para la formación del eje, aunque la importancia relativa de la transferencia de señales entre las primeras células de muchos organismos en desarrollo es mayor que en el ejemplo descrito aquí.


Los elementos básicos de la estructura del eje anteroposterior en Drosophila se establecen durante la formación del óvulo ( ovogénesis ), mucho antes de que el óvulo sea fertilizado y depositado. Los genes de efecto maternal son responsables de la polaridad del óvulo y del embrión. El óvulo en desarrollo ( ovocito ) está polarizado por moléculas de ARNm localizadas de forma diferencial .
Los genes que codifican estos ARNm, llamados genes de efecto maternal , codifican proteínas que se traducen tras la fertilización para establecer gradientes de concentración que abarcan el óvulo. Bicoid y Hunchback son los genes de efecto maternal que son más importantes para la formación de patrones de las partes anteriores (cabeza y tórax) del embrión de Drosophila . Nanos y Caudal son genes de efecto maternal que son importantes en la formación de segmentos abdominales más posteriores del embrión de Drosophila . [4] [5]
En los embriones de madres mutantes bicoides , la cabeza y las estructuras torácicas se convierten en abdomen, lo que hace que el embrión con estructuras posteriores en ambos extremos sea un fenotipo letal. [4]
Los elementos del citoesqueleto, como los microtúbulos, están polarizados dentro del ovocito y pueden utilizarse para permitir la localización de moléculas de ARNm en partes específicas de la célula. Los ARNm bicoides sintetizados por la madre se unen a los microtúbulos y se concentran en los extremos anteriores de los óvulos en formación de Drosophila . En los óvulos no fertilizados, las transcripciones siguen localizadas estrictamente en la punta, pero inmediatamente después de la fertilización, se forma un pequeño gradiente de ARNm en el 20% anterior de los óvulos. Otro informe documenta un gradiente de ARNm de hasta el 40%. El ARNm nanos también se une al citoesqueleto de un óvulo de Drosophila, pero se concentra en el extremo posterior del óvulo. Los ARNm jorobados y caudales carecen de sistemas especiales de control de ubicación y se distribuyen de manera bastante uniforme por todo el interior de los óvulos.
Se ha demostrado que la proteína de unión a dsRNA STAUFEN ( STAU1 ) es responsable de guiar a las proteínas bicoid, nanos y otras, que desempeñan un papel en la formación del eje anteroposterior, a las regiones correctas del embrión para construir gradientes. Cuando los ARNm de los genes de efecto materno se traducen en proteínas, se forma un gradiente de proteína bicoid en el extremo anterior del óvulo. La proteína nanos forma un gradiente en el extremo posterior. La proteína bicoid bloquea la traducción del ARNm caudal , por lo que la proteína caudal tiene una concentración menor en la parte anterior del embrión y una concentración mayor en la parte posterior del embrión. Esto es de dirección opuesta a la proteína bicoid. La proteína caudal luego se activa más tarde para activar los genes para formar las estructuras posteriores durante la fase de segmentación. La proteína nanos crea una pendiente posterior a anterior y es un morfógeno que ayuda en la formación del abdomen. La proteína nanos, en complejo con la proteína Pumilio, se une al ARNm jorobado y bloquea su traducción en el extremo posterior de los embriones de Drosophila .
Las proteínas Bicoid, Hunchback y Caudal son factores de transcripción . La proteína Bicoid también es un morfógeno. La proteína Nanos es una proteína represora de la traducción. Bicoid tiene un homeodominio de unión al ADN que une tanto al ADN como al ARNm nanos . Bicoid se une a una secuencia de ARN específica en la región no traducida 3′ , llamada elemento regulador Bicoid 3′-UTR , del ARNm caudal y bloquea la traducción.
Los niveles de proteína Hunchback en el embrión temprano aumentan significativamente por la nueva transcripción del gen Hunchback y la traducción del ARNm resultante producido cigóticamente . Durante la embriogénesis temprana de Drosophila , hay divisiones nucleares sin división celular. Los numerosos núcleos que se producen se distribuyen por la periferia del citoplasma celular . La expresión génica en estos núcleos está regulada por las proteínas Bicoid, Hunchback y Caudal. Por ejemplo, Bicoid actúa como un activador transcripcional de la transcripción del gen Hunchback . Para que el desarrollo continúe, se necesita Hunchback en un área que está disminuyendo en cantidad de anterior a posterior. Esto es creado por la proteína Nanos cuya existencia está en una pendiente decreciente de los extremos posterior a anterior.
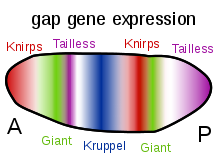
La otra función importante de los gradientes de las proteínas Bicoid, Hunchback y Caudal es la regulación transcripcional de otras proteínas expresadas cigóticamente. Muchas de ellas son productos proteicos derivados de miembros de la familia "gap" de genes de control del desarrollo. giant , huckebein , hunchback , knirps , Krüppel y tailless son todos genes gap . Sus patrones de expresión en el embrión temprano están determinados por los productos de los genes de efecto materno y se muestran en los diagramas del lado derecho de esta página. Los genes gap son parte de una familia más grande llamada genes de segmentación . Estos genes establecen el plan corporal segmentado del embrión a lo largo del eje anteroposterior. Los genes de segmentación especifican 14 parasegmentos que están estrechamente relacionados con los segmentos anatómicos finales. Los genes gap son la primera capa de una cascada jerárquica de los genes de control de la segmentación.

Después de los productos de los genes gap se expresan dos clases adicionales de genes de segmentación. Los genes de la regla de pares se expresan en patrones de rayas de siete bandas perpendiculares al eje anteroposterior. Estos patrones de expresión se establecen dentro del blastodermo sincitial. Después de estos eventos iniciales de formación de patrones, se forman membranas celulares alrededor de los núcleos del blastodermo sincitial, convirtiéndolo en un blastodermo celular.
Los patrones de expresión de la última clase de genes de segmentación, los genes de polaridad de segmento , se ajustan mediante interacciones entre las células de parasegmentos adyacentes con genes como engrailed . La proteína Engrailed es un factor de transcripción que se expresa en una fila de células en el borde de cada parasegmento. Este patrón de expresión es iniciado por los genes de regla de pares (como even-skipped ) que codifican factores de transcripción que regulan la transcripción del gen engrailed en el blastodermo sincitial.
Las células que producen Engrailed pueden producir la proteína de señalización de célula a célula Hedgehog . El movimiento de Hedgehog está limitado por su modificación lipídica, por lo que Hedgehog activa una delgada franja de células anterior a las células que expresan Engrailed. Solo las células a un lado de las células que expresan Engrailed son competentes para responder a Hedgehog porque expresan la proteína receptora Patched . Las células con el receptor Patched activado producen la proteína Wingless . Wingless es una proteína secretada que actúa sobre las filas adyacentes de células activando su receptor de superficie celular, Frizzled .
Wingless actúa sobre las células que expresan Engrailed para estabilizar su expresión después de que se forma el blastodermo celular. Wingless induce la proteína de cutícula Naked para limitar el número de filas de células que expresan Engrailed. La señalización recíproca de corto alcance de Hedgehog y Wingless, controlada por las proteínas Patched y Naked, estabiliza el límite entre cada segmento. La proteína Wingless se llama "wingless" debido al fenotipo de algunos mutantes wingless . Wingless y Hedgehog también funcionan en múltiples tejidos más adelante en la embriogénesis y también durante la metamorfosis .
Los factores de transcripción que están codificados por los genes de segmentación regulan otra familia de genes de control del desarrollo, los genes selectores homeóticos . Estos genes existen en dos grupos ordenados en el cromosoma 3 de Drosophila . El orden de los genes en el cromosoma refleja el orden en que se expresan a lo largo del eje anteroposterior del embrión en desarrollo. El grupo Antennapedia de genes selectores homeóticos incluye labial , Antennapedia , sex combs reduction , deformed y proboscipedia . Las proteínas labial y deformada se expresan en segmentos de la cabeza donde activan los genes que definen las características de la cabeza. Sex-combs-reduced y Antennapedia especifican las propiedades de los segmentos torácicos. El grupo bithorax de genes selectores homeóticos controla las especializaciones del tercer segmento torácico y los segmentos abdominales. Las mutaciones en algunos genes homeóticos a menudo pueden ser letales y el ciclo de vida terminará en la embriogénesis.
En 1995, el Premio Nobel de Fisiología o Medicina fue otorgado por estudios relacionados con el control genético del desarrollo embrionario temprano a Christiane Nüsslein-Volhard , Edward B. Lewis y Eric Wieschaus . Su investigación sobre la detección genética de mutantes con patrones embrionarios reveló el papel que desempeñan los genes homeobox como bicoid en el desarrollo embrionario temprano . Un ejemplo de mutación homeótica es la denominada mutación Antennapedia. En Drosophila , las antenas y las patas son creadas por el mismo "programa" básico, solo difieren en un único factor de transcripción. Si este factor de transcripción está dañado, a la mosca le crecen patas en la cabeza en lugar de antenas. Vea imágenes de este mutante "antennapedia" y otros en FlyBase. Otro ejemplo está en el complejo bithorax. Si ocurren mutaciones no letales en este complejo, puede hacer que la mosca tenga dos pares de alas, en lugar de un par de alas y un par de halterios, que ayudan al equilibrio en el vuelo.
La formación del eje dorso-ventral depende de la concentración nuclear ventral de un factor de transcripción sintetizado por la madre llamado Dorsal. La determinación del lado dorsal del embrión ocurre durante la ovogénesis cuando el núcleo del ovocito se mueve a lo largo de los microtúbulos desde el margen posterior al anterior-dorsal del ovocito. El núcleo expresa una proteína llamada Gurken que se secreta localmente y, por lo tanto, solo activa las células foliculares en la región dorsal al interactuar con el receptor Torpedo. Esto inhibe la producción de la proteína Pipe y, por lo tanto, las células foliculares que expresan Pipe están en el lado ventral. Pipe activa una cascada de proteasas extracelulares en el espacio perivitelino entre las células foliculares y el óvulo, lo que da como resultado la escisión del ligando Toll Spätzle y la activación de la cascada de señalización Toll en el lado ventral. La proteína Dorsal está presente en todo el citoplasma embrionario, pero está unida a Cactus, lo que evita que se transloque al núcleo. La señalización de Toll da como resultado la degradación de Cactus, lo que permite que Dorsal ingrese a los núcleos del lado ventral del blastodermo. [6] En general, una diferencia en la localización del núcleo del ovocito se convierte en una diferencia en el estado de señalización de las células del folículo circundante, que luego envían señales a los núcleos del blastodermo resultantes.
Una vez en el núcleo, Dorsal activa diferentes genes dependiendo de su concentración nuclear. Este proceso establece un gradiente entre el lado ventral y dorsal del embrión de blastodermo con la represión o inducción de los genes diana de Dorsal siendo regulada diferencialmente. En el extremo ventral del embrión, los núcleos de blastodermo expuestos a altas concentraciones de proteína dorsal inducen la transcripción de los factores de transcripción twist y snail mientras reprimen zerknüllt y decapentaplegic . Esto resulta en la formación del mesodermo. En las regiones laterales del embrión, bajas concentraciones nucleares de Dorsal conducen a la expresión de rhomboid que identifica el futuro neuroectodermo. Más dorsalmente, la señalización Dpp activa reprime rhomboid confinándolo así a los núcleos laterales del blastodermo. En el lado dorsal del embrión, los núcleos de blastodermo donde esta proteína dorsal nuclear es escasa o nula expresan zerknüllt , tolloid y decapentaplegic (Dpp). Esto conduce a la especificación del ectodermo no neuronal y, más tarde, en la etapa de blástula, a la anmioserosa. La actividad ventral de la proteína de señalización de la familia TGF-β Dpp se mantiene mediante la expresión del antagonista de Dpp secretado Sog (gastrulación corta) en el neuroectodermo. Sog se une a Dpp y evita su difusión hacia el lado ventral del embrión y, a través de la escisión de Sog por Tolloid, también permite una agudización del gradiente de Dpp en el lado dorsal. El eje DV de Drosophila se debe a la interacción de dos gradientes: una concentración ventral de actividad nuclear dorsal y una concentración dorsal de actividad de Dpp. [6]