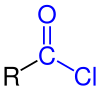
En química orgánica , un cloruro de acilo (o cloruro de ácido ) es un compuesto orgánico con el grupo funcional −C(=O)Cl . Su fórmula suele escribirse R−COCl , donde R es una cadena lateral . Son derivados reactivos de los ácidos carboxílicos ( R−C(=O)OH ) . Un ejemplo específico de cloruro de acilo es el cloruro de acetilo , CH3COCl . Los cloruros de acilo son el subconjunto más importante de los haluros de acilo .
Cuando la fracción de cloruro de acilo tiene prioridad, los cloruros de acilo se nombran tomando el nombre del ácido carboxílico original y sustituyendo el cloruro de -ilo por el ácido -ico . Por lo tanto:
(De manera idiosincrásica, para algunos nombres triviales, el cloruro de -oilo sustituye al ácido -ico . Por ejemplo, el ácido piválico se convierte en cloruro de pivaloilo y el ácido acrílico se convierte en cloruro de acriloilo . Los nombres cloruro de pivalilo y cloruro de acriloilo se usan con menos frecuencia, aunque se podría decir que son más lógicos).
Cuando otros grupos funcionales tienen prioridad, los cloruros de acilo se consideran prefijos —clorocarbonil- : [1]
Al carecer de la capacidad de formar enlaces de hidrógeno , los cloruros de acilo tienen puntos de ebullición y fusión más bajos que los ácidos carboxílicos similares . Por ejemplo, el ácido acético hierve a 118 °C, mientras que el cloruro de acetilo hierve a 51 °C. Como la mayoría de los compuestos carbonílicos , la espectroscopia infrarroja revela una banda cerca de 1750 cm −1 .
El cloruro de acilo estable más simple es el cloruro de acetilo; el cloruro de formilo no es estable a temperatura ambiente, aunque se puede preparar a -60 °C o menos. [2] [3]
Los cloruros de acilo se hidrolizan (reaccionan con agua) para formar el ácido carboxílico y el ácido clorhídrico correspondientes :

La ruta industrial para obtener cloruro de acetilo implica la reacción del anhídrido acético con cloruro de hidrógeno : [5]
El cloruro de propionilo se produce mediante cloración del ácido propiónico con fosgeno : [6]
El cloruro de benzoilo se produce por hidrólisis parcial de benzotricloruro : [7]
De manera similar, los benzotricloruros reaccionan con los ácidos carboxílicos para formar el cloruro de ácido. Esta conversión se practica para la reacción del 1,4-bis(triclorometil)benceno para dar cloruro de tereftaloilo :
En el laboratorio, los cloruros de acilo generalmente se preparan tratando ácidos carboxílicos con cloruro de tionilo ( SOCl 2 ). [8] La reacción es catalizada por dimetilformamida y otros aditivos. [9] [10]

El cloruro de tionilo [11] es un reactivo muy adecuado ya que los subproductos (HCl, SO 2 ) son gases y el cloruro de tionilo residual se puede eliminar fácilmente gracias a su bajo punto de ebullición (76 °C).
El tricloruro de fósforo ( PCl 3 ) es popular, [12] aunque se requiere un exceso de reactivo. [9] El pentacloruro de fósforo ( PCl 5 ) también es efectivo, [13] [14] pero solo se transfiere un cloruro:
Otro método implica el uso de cloruro de oxalilo :
La reacción es catalizada por dimetilformamida (DMF), que reacciona con cloruro de oxalilo para dar el reactivo de Vilsmeier , un intermediario de iminio que reacciona con el ácido carboxílico para formar un iminoanhídrido mixto. Esta estructura sufre una sustitución de acilo con el cloruro liberado, formando el anhídrido de ácido y liberando la molécula regenerada de DMF. [10] En relación con el cloruro de tionilo, el cloruro de oxalilo es más caro pero también un reactivo más suave y, por lo tanto, más selectivo.
Los cloruros de ácido se pueden utilizar como fuente de cloruro. [15] Por lo tanto, el cloruro de acetilo se puede destilar a partir de una mezcla de cloruro de benzoilo y ácido acético : [9]
Otros métodos que no forman HCl incluyen la reacción de Appel : [16]
Otro es el uso de cloruro cianúrico : [17]
Los cloruros de acilo son reactivos versátiles y reactivos. [18] Los cloruros de acilo tienen una mayor reactividad que otros derivados de ácidos carboxílicos como anhídridos de ácido , ésteres o amidas :
Los cloruros de acilo se hidrolizan, produciendo el ácido carboxílico:
Esta hidrólisis suele ser más una molestia que algo intencionado.
Los cloruros de ácido son útiles para la preparación de amidas, ésteres y anhídridos. Estas reacciones generan cloruro, que puede ser indeseable. Los cloruros de acilo se utilizan para preparar anhídridos de ácido , amidas y ésteres , mediante la reacción de cloruros de ácido con: una sal de un ácido carboxílico , una amina o un alcohol , respectivamente.
Los haluros de ácido son los derivados de acilo más reactivos y se pueden convertir fácilmente en cualquiera de los otros. Los haluros de ácido reaccionarán con ácidos carboxílicos para formar anhídridos. Si la estructura del ácido y el cloruro de ácido son diferentes, el producto es un anhídrido mixto. Primero, el ácido carboxílico ataca al cloruro de ácido ( 1 ) para dar el intermedio tetraédrico 2 . El intermedio tetraédrico colapsa, expulsando el ion cloruro como grupo saliente y formando la especie oxonio 3 . La desprotonación da el anhídrido mixto, 4 , y un equivalente de HCl.
Los alcoholes y las aminas reaccionan con haluros de ácido para producir ésteres y amidas , respectivamente, en una reacción formalmente conocida como reacción de Schotten-Baumann . [19] Los haluros de ácido se hidrolizan en presencia de agua para producir ácidos carboxílicos, pero este tipo de reacción rara vez es útil, ya que los ácidos carboxílicos se utilizan típicamente para sintetizar haluros de ácido. La mayoría de las reacciones con haluros de ácido se llevan a cabo en presencia de una base no nucleófila, como la piridina , para neutralizar el ácido hidrohálico que se forma como subproducto.
Se cree que la alcoholisis de los haluros de acilo (la alcoxi-deshalogenación) se produce a través de un mecanismo S N 2 (Esquema 10). [20] Sin embargo, el mecanismo también puede ser tetraédrico o S N 1 en solventes altamente polares [21] (mientras que la reacción S N 2 implica una reacción concertada, la vía tetraédrica de adición-eliminación implica un intermediario discernible). [22]
Las bases, como la piridina o la N,N -dimetilformamida, catalizan las acilaciones . [14] [10] Estos reactivos activan el cloruro de acilo a través de un mecanismo de catálisis nucleofílica. La amina ataca el enlace carbonilo y presumiblemente [23] primero forma un intermedio tetraédrico transitorio, luego forma una sal de acilamonio cuaternario por el desplazamiento del grupo saliente. Esta sal de acilamonio cuaternario es más susceptible al ataque de alcoholes u otros nucleófilos.
El uso de dos fases (acuosa para la amina, orgánica para el cloruro de acilo) se denomina reacción de Schotten-Baumann . Este enfoque se utiliza en la preparación de nailon mediante el llamado truco de la cuerda de nailon . [24]
Los haluros de ácido reaccionan con nucleófilos de carbono, como los de Grignard y los enolatos , aunque pueden resultar mezclas de productos. Si bien un nucleófilo de carbono reaccionará primero con el haluro de ácido para producir una cetona, la cetona también es susceptible al ataque nucleofílico y puede convertirse en un alcohol terciario. Por ejemplo, cuando el cloruro de benzoilo ( 1 ) se trata con dos equivalentes de un reactivo de Grignard, como el bromuro de metilmagnesio (MeMgBr), se obtiene 2-fenil-2-propanol ( 3 ) con un rendimiento excelente. Aunque la acetofenona ( 2 ) es un intermediario en esta reacción, es imposible aislarla porque reacciona con un segundo equivalente de MeMgBr rápidamente después de formarse. [25]

A diferencia de la mayoría de los demás nucleófilos de carbono, los dialquilcupratos de litio (a menudo llamados reactivos de Gilman ) pueden añadirse a haluros de ácido una sola vez para dar cetonas. Sin embargo, la reacción entre un haluro de ácido y un reactivo de Gilman no es una reacción de sustitución de acilo nucleofílica, y se cree que se produce a través de una vía radicalaria. [26] La síntesis de cetonas de Weinreb también se puede utilizar para convertir haluros de ácido en cetonas. En esta reacción, el haluro de ácido se convierte primero en una N-metoxi-N-metilamida, conocida como amida de Weinreb. Cuando un nucleófilo de carbono (como un reactivo de Grignard o de organolitio ) se añade a una amida de Weinreb, el metal queda quelado por los oxígenos carbonílico y N-metoxi, lo que evita más adiciones nucleofílicas. [27]
Los nucleófilos de carbono, como los reactivos de Grignard , convierten los cloruros de acilo en cetonas , que a su vez son susceptibles al ataque de un segundo equivalente para producir el alcohol terciario . La reacción de los haluros de acilo con ciertos reactivos de organocadmio se detiene en la etapa de cetona. [28] La reacción con reactivos de Gilman también produce cetonas, lo que refleja la baja nucleofilia de estos compuestos de litio y diorganocobre. [14]
Los cloruros de acilo se reducen con hidruro de litio y aluminio e hidruro de diisobutilaluminio para dar lugar a alcoholes primarios. El hidruro de litio y tri-terc-butoxialuminio , un voluminoso donador de hidruros, reduce los cloruros de acilo a aldehídos, al igual que la reducción de Rosenmund utilizando gas hidrógeno sobre un catalizador de paladio envenenado. [29]

En la acilación de Friedel-Crafts , los haluros de ácido actúan como electrófilos para la sustitución aromática electrofílica . Un ácido de Lewis , como el cloruro de cinc (ZnCl 2 ), el cloruro de hierro (III) (FeCl 3 ) o el cloruro de aluminio (AlCl 3 ), se coordina con el halógeno en el haluro de ácido, activando el compuesto hacia el ataque nucleofílico por un anillo aromático activado . Para anillos aromáticos especialmente ricos en electrones, la reacción se realizará sin un ácido de Lewis. [30] [12] [14]
Debido a las duras condiciones y la reactividad de los intermediarios, esta reacción, por lo demás bastante útil, tiende a ser desordenada y nociva para el medio ambiente.
Los cloruros de acilo reaccionan con centros metálicos de baja valencia para formar complejos de acilo de metales de transición . Un ejemplo ilustrativo es la adición oxidativa de cloruro de acetilo al complejo de Vaska , convirtiendo el Ir(I) plano cuadrado en Ir(III) octaédrico: [31]
Los cloruros de acilo de bajo peso molecular suelen ser lacrimógenos y reaccionan violentamente con agua, alcoholes y aminas.
mcmurryfue invocada pero nunca definida (ver la página de ayuda ).