
Un microbioma de macroalga describe las comunidades dinámicas de microorganismos que viven en simbiosis con una macroalga, que a menudo se consideran juntos como una unidad llamada holobionte . [1] . Macroalgas es un término amplio para miles de especies de eucariotas multicelulares , que se clasifican en algas pardas , rojas o verdes . Si bien las algas pardas suelen ser las de mayor tamaño, las algas rojas tienen una historia evolutiva más larga y, por lo tanto, son más diversas. Las relaciones entre macroalgas y bacterias han evolucionado desde que se originó la primera alga roja hace unos 1.600 millones de años [2] . En esta relación, la macroalga se considera huésped al ser la de mayor tamaño. Mientras tanto, el microbioma, que es la información genética de toda la microbiota asociada, es muy diverso, variando incluso dentro de una misma especie de macroalga [3] [4] . La mayoría de las macroalgas viven en zonas costeras y, al igual que otros fotoautótrofos marinos , se encuentran principalmente en la zona eufótica . A menudo, múltiples especies de algas coexisten muy cerca, lo que sugiere una superposición en sus funciones como huéspedes microbianos.
Las macroalgas son susceptibles a la simbiosis con microorganismos, ya que proporcionan material orgánico y viven en hábitats donde la competencia por el espacio es alta para los organismos bentónicos [3] [5] . El microbioma juega un papel importante en la historia de vida de las macroalgas con respecto al intercambio de nutrientes y la reproducción, entre otras funciones [4] [6] . La simbiosis entre las bacterias epífitas y sus algas huéspedes está bien documentada; las bacterias facilitan los procesos metabólicos en la fotosíntesis y el ciclo del nitrógeno a cambio de un medio de crecimiento [7] . Los materiales orgánicos secretados por las macroalgas proporcionan nutrientes para el crecimiento bacteriano, así como para la formación de biopelículas marinas [4] . Estas biopelículas actúan como una barrera entre las macroalgas y el medio ambiente y brindan protección contra metales pesados y radiación ultravioleta [8] . Además, las bacterias secretan sustancias químicas antibioincrustantes y previenen la colonización por otros microbios [3] . Sin embargo, existe evidencia de que las biopelículas bacterianas también pueden ser perjudiciales para las macroalgas. Un estudio de Gracilaria , un alga roja de amplia distribución, encontró que el 29% de las bacterias colonizadoras epífitas contribuyeron a la necrosis en las puntas del alga [9] . Además, un estudio sobre el alga roja Delisea pulchra encontró que algunos virus dentro de su microbioma infectaban diatomeas , sirviendo como parte del sistema inmunológico del huésped, otros inducían la lisis de las células del huésped [10] . Por último, el estrés de los organismos huéspedes puede provocar alteraciones en el microbioma, lo que puede provocar que bacterias mutualistas o comensales aprovechen los nutrientes liberados para causar daños al huésped [4] [11] [12] .
Estas complejas interacciones han evolucionado a partir de la diferente asignación y concentración de compuestos químicos, ya que son cruciales para la comunicación entre organismos acuáticos [3] [13] . Los compuestos químicos mejor documentados son de naturaleza antibacteriana, ya sean producidos por los microorganismos o por las propias algas. En el caso del alga, existe evidencia de que la macroalga roja Gracilaria textorii es capaz de secretar sustancias químicas para controlar las poblaciones de Vibrio alginolyticus y Vibrio logei [14] . Mientras tanto, se encontró que el 35% de las bacterias epibióticas en aguas costeras escocesas y el 20% de las bacterias epibióticas en aguas japonesas secretan compuestos antimicrobianos [15] [16] . Se ha descubierto que esos compuestos atacan o tienen propiedades antibioincrustantes contra una amplia gama de otros microorganismos [15] [17] . Como resultado de esas interacciones químicas, ciertas bacterias se pueden encontrar en especies de macroalgas específicas [3] . También se ha descubierto que las comunidades microbianas de la misma especie en diferentes hábitats son más similares que las comunidades de diferentes especies en el mismo hábitat [18] .

La composición de una comunidad microbiana de macroalgas es altamente específica del huésped; no sólo varía entre especies, sino incluso entre especies en diferentes lugares [4] [19] . Por ejemplo, un estudio de Ulva intestinalis , Fucus vesiculosus y Gracilaria vermiculophylla (algas verdes, marrones y rojas respectivamente) encontró una superposición mínima en la composición de la comunidad epibacteriana [20] . Aunque estas tres especies están muy extendidas y son abundantes, sus historias evolutivas difieren considerablemente, lo que lleva a diferentes nichos ecológicos. En particular, se observó dominancia compartida entre Rhizobiales y Bacteroidetes en G. vermiculophylla , lo que indica una preferencia por los fijadores de nitrógeno. Mientras tanto, en U. intestinalis , se encontró que las poblaciones de Sphingomonadales predominaban en el verano y Bacteroidetes en las otras estaciones [20] . Una vez más, Bacteroidetes constituyó una parte importante de la comunidad microbiana de F. vesiculosus en todas las estaciones. En general, dado que se sabe que Bacteroidetes promueve el ciclo de nutrientes y defiende contra factores estresantes abióticos, es un componente central y ubicuo del holobionte macroalgal en una variedad de especies de algas [21] . Al mismo tiempo, se descubrió que las poblaciones de Verrucomicrobia , que contribuyen a la degradación del fucoidan , aumentan durante el verano en las algas pardas [22] . Esto puede sugerir requisitos de temperatura para que ciertas bacterias crezcan en sus algas huéspedes.
El medio principal para clasificar las bacterias es mediante el cultivo de una muestra en un medio de crecimiento , que puede ser sólido o líquido. Sin embargo, este enfoque no es suficiente en el contexto del microbioma de macroalgas, ya que sólo una pequeña fracción de microbios puede crecer en esas condiciones de laboratorio (las estimaciones coinciden en un valor inferior al 1%) [23] . Más recientemente, se han desarrollado técnicas de secuenciación de genes utilizando muestras tomadas directamente de biomasa; Aunque se trata de un avance, gran parte del microbioma aún sigue siendo desconocido. Esto quedó ejemplificado en un estudio de 2010 sobre varias especies de algas de Ulvaecean. Se sabe que Pseudoalteromonas existe en simbiosis con Ulva, principalmente para ayudar a prevenir la bioincrustación [24] . Sin embargo, cuando se utilizaron técnicas de elaboración de perfiles comunitarios, se identificó a Alphaproteobacteria como el grupo bacteriano principal; los autores observaron que otras bacterias como Pseudoalteromonas se habían encontrado consistentemente en estudios anteriores, pero no se detectaron con sus métodos [23] [25] . Por esta razón, la comprensión holística de todas las interacciones microbianas en el holobionte sigue siendo limitada.
Se ha demostrado que los miembros bacterianos del microbioma de las macroalgas tienen un efecto morfogenético en el huésped [26] . Los primeros estudios han demostrado que la Ulva lactuca axénica no puede desarrollar el talo foliáceo típico , sino que crece hasta convertirse en germenes filamentosos o con forma de dedos que son capaces de originar nuevos germenes al desintegrarse o transferirse después de crecer unos pocos milímetros [27] [28] . Sin embargo, en algunas especies de algas verdes, se ha demostrado que la morfología foliácea típica podría recuperarse mediante la reinfección de ciertas bacterias marinas aisladas de macroalgas marinas, agua de mar y sedimentos costeros. Además, las especies de Monostroma podrían incluso restaurar su morfología típica con filtrados de cultivos bacterianos apropiados, lo que demuestra aún más el efecto morfogenético de los miembros bacterianos del microbioma de macroalgas [29] [30] . Estudios posteriores caracterizaron los inductores de la morfogénesis o rediferenciación de dichas macroalgas. Por ejemplo, la talusina, que se aisló de una bacteria epífita del grupo Cytophaga-Flavobacterium-Bacteroides de Monostroma sp. , podría inducir la diferenciación de Monostroma oxyspermum y la germinación de otras macroalgas verdes ( U. pertusa y E. intestinalis ) [31] . Además, se aislaron varias especies bacterianas del microbioma de Ulva. mutabilis excreta factores reguladores similares a citoquininas y auxinas, que afectan el desarrollo y la diferenciación de los gametos del huésped [32] .
La detección de quórum (QS) es un mecanismo de comunicación intercelular que comparte la información sobre la densidad celular entre una comunidad de bacterias. Esta comunicación dependiente de la densidad se realiza mediante la producción y detección de moléculas de señalización y permite a las bacterias regular la expresión genética de ciertos procesos de manera cooperativa [33] [34] . Se ha demostrado que los miembros bacterianos del microbioma de las macroalgas se comunican químicamente a través de QS, y las moléculas de QS relevantes podrían influir potencialmente en el ciclo reproductivo del huésped [26] . Por ejemplo, ciertas especies de bacterias Gram-negativas aisladas de algas verdes ( Ulva fasciate y Ulva lactuca ) y algas rojas ( Gracilaria corticate y Gracilaria dura ) producen varios tipos de N-acil homoserina lactonas (AHL) como moléculas de señal de detección de quórum. Se demostró que algunas de estas AHL promueven la liberación de carposporas de G. dura [35] .
El microbioma de la superficie de las macroalgas juega un papel importante en la regulación del estado de salud del huésped. La colonización de bacterias específicas del huésped podría seleccionarse según la fuente de nutrientes disponible en la superficie o los exudados [4] . Se ha demostrado que las bacterias son en parte responsables de la producción de vitaminas específicas requeridas por diferentes especies de macroalgas y algunos compuestos antimicrobianos contra patógenos , que se sabía que producían las algas marinas [36] .
Por otro lado, la relación simbiótica del microbioma de la macroalga con su huésped podría convertirse en una relación potencialmente patógena debido a cambios espaciales o temporales del microbioma de la macroalga. Esto puede ser causado por desafíos abióticos (por ejemplo, cambios en las condiciones ambientales) y/o desafíos bióticos (por ejemplo, cambios en la fisiología del huésped) [4] [37] . Estos cambios del microbioma de un “estado estable” a un “estado perturbado” se denominan disbiosis , en virtud de la cual los comensales o nuevos colonizadores podrían convertirse en patógenos oportunistas. Un estudio ha demostrado que el microbioma de la superficie de las frondas del alga gigante, Macroxystis pyrifera , se vio influenciado por factores estresantes del cambio climático global (por ejemplo, aumento de temperatura y pCO2). Además, el cambio único en el microbioma de la superficie de M. pyrifera se correlacionó con un crecimiento reducido del huésped, lo que se propuso estar asociado con el aumento de especies de Flavobacterales [37] . Además, varias especies bacterianas aisladas del microbioma de superficie de Agarophyton vermiculophyllum se clasificaron como “patógenas” y “protectoras”. Kordia algicida , que fue identificada como un “patógeno importante” para la enfermedad del blanqueo, también se aisló de la superficie de Agarophyton vermiculophyllum . Cuando todos los aislados se probaron juntos, las cepas protectoras parecen prevenir por completo la enfermedad del blanqueo. Sin embargo, una presencia tan común de patógenos en el microbioma de la superficie sugiere la posibilidad de patogénesis por estrés ambiental u otras alteraciones [38] . Además, se demostró que una enfermedad morfológica que afecta a la macroalga roja Iridaea laminarioides , que se caracteriza por el desarrollo de agallas en talos inmaduros, está asociada con infecciones de una cianobacteria endofítica . Este estudio fue el primer informe de asociación entre enfermedades de macroalgas y organismos endófitos [39] .
Algunos miembros simbióticos del microbioma de las macroalgas desempeñan un papel importante en la asistencia a las defensas químicas del huésped contra incrustaciones y patógenos [4] . Se ha demostrado que el holobionte de macroalga, Agarophyton vermiculophyllum , posee un microbioma beneficioso en la superficie que produce metabolitos para reducir la colonización de patógenos oportunistas y atraer un "asentamiento epibacteriano protector". Como se indicó anteriormente, cuando todos los aislados de Agarophyton vermiculophyllum (incluidas las cepas protectoras y patógenas) se probaron juntos, las cepas protectoras impidieron completamente el blanqueamiento. Esto sugiere que el microbioma de superficie de Agarophyton vermiculophyllum demuestra una "defensa asociativa" contra los patógenos [38] . Además, los bioensayos han demostrado que el reclutamiento selectivo de microbios en la superficie de Agarophyton vermiculophyllum está mediado químicamente, donde los metabolitos de la superficie atraen cepas protectoras y reducen el asentamiento de patógenos. Esta fue la primera demostración de la capacidad de una macrófita acuática para “cultivar” químicamente un microbioma beneficioso para una mejor resistencia a las enfermedades [38] . Además de los colonizadores bacterianos, algunas cepas de bacterias de superficie de diferentes especies de macroalgas también han demostrado un efecto inhibidor de leve a fuerte contra el asentamiento de larvas de gusanos tubulares y esporas de algas [40] . Además, también se demostró que diferentes aislados de bacterias de la superficie de macroalgas exhiben propiedades antibióticas contra otras bacterias, previenen la contaminación de las diatomeas pennadas e incluso reducen la fijación de percebes [41] [42]
El microbioma de macroalgas ofrece un gran potencial en los campos de la ciencia y la tecnología. Debido a sus propiedades únicas, el microbioma se ha aplicado a varios estudios que incluyen la mitigación de la crisis climática mediante el secuestro de carbono , el metabolismo de los halógenos en el ciclo de los halógenos marinos, la producción de biocombustibles y la remediación ambiental [43] [44] [45] .
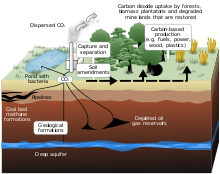
El cultivo de algas marinas de gran tamaño está ganando mucha atención por su potencial en la mitigación del cambio climático. Este interés se debe a la contribución sustancial de las macroalgas al secuestro de carbono en los océanos [43] . El carbono orgánico disuelto refractario (RDOC), que constituye el 96% de la reserva marina de carbono orgánico disuelto (DOC), es creado por bacterias que se alimentan de los componentes lábiles del DOC de los productores primarios [43] . El término "refractario" se utiliza para caracterizar este conjunto de DOC porque una parte importante del mismo parece ser "no accesible" o "resistente" a la rápida degradación microbiana. Debido a esto, el RDOC se considera un importante reservorio de carbono que puede frenar efectivamente el calentamiento global. Especies de macroalgas como Sargassum y Ulva prolifera también han mostrado una gran adaptabilidad ambiental. Estas especies absorben cantidades considerables de CO 2 de la atmósfera y nutrientes del agua de mar y, por tanto, desempeñan un papel importante en el secuestro de carbono [43] . Sin embargo, estas floraciones de algas también pueden tener impactos negativos, como hipoxia costera y acidificación , debido a la degradación de estas macroalgas por microbios [46] .
Los microbios de las algas rojas y pardas, en particular, desempeñan un papel crucial en el ciclo del halógeno que se encuentra en los ecosistemas marinos [47] . Las algas albergan una variedad de poblaciones microbianas que producen compuestos halogenados, un campo de investigación crucial para futuros usos biotecnológicos y ecológicos [44] . Poco se sabe sobre por qué los microbiomas producen compuestos halogenados, y algunos sugieren funciones antimicrobianas en las interacciones entre macroalgas y procariotas [44] . La investigación se centra en comprender la composición genética de las comunidades procarióticas asociadas con macroalgas y cómo esto influye en las reacciones con moléculas organohalogenadas en el océano [44] . Los hallazgos apuntan a que las macroalgas funcionan como holobiontes . El metabolismo de compuestos halogenados por microbiomas de macroalgas podría desempeñar un papel en la simbiogénesis y actuar como un posible mecanismo de defensa contra factores estresantes químicos en el entorno [44] .
El estudio proporciona información sobre la biología sintética al resaltar el contenido de genes en grupos bacterianos que antes no estaban relacionados con el metabolismo de los organohalogenados y que es biotecnológicamente relevante. Este estudio ofrece información útil que avanza en el conocimiento de la función de procariotas desconocidos en las interacciones ecológicas marinas [44] .
Los microbiomas asociados con macroalgas tienen aplicaciones potenciales en la producción de biocombustibles a través de su acción en la descomposición de azúcares complejos [45] . Estos se pueden transformar en bioetanol , biogás , biodiesel y bioaceite mediante métodos como fermentación , digestión anaeróbica , transesterificación y pirólisis debido a los componentes de azúcar en las macroalgas [45] [48] . La Saccharina japonica , por ejemplo, un tipo de macroalga marrón, contiene carbohidratos como alginato , laminarina y manitol que pueden convertirse en biocombustibles. El importante contenido de alginato se puede descomponer en monosacáridos que luego se utilizan para producir etanol como biocombustible [45] . En las macroalgas rojas, la galactosa (23%) y la glucosa (20%) proporcionan los porcentajes más significativos de azúcares simples, y la cofermentación se utiliza como estrategia para la bioproducción de etanol. Las macroalgas verdes presentan una importante composición de fucosa , lo que conduce a la producción de dioles cuando se descomponen, y 2'-fucosillactosa (2'-FL), un componente clave de los oligosacáridos de la leche humana (HMO) [49] [50] . El 2'-FL es especialmente útil en aplicaciones nutracéuticas ya que la fórmula infantil elaborada con leche de animales no humanos contiene muy pocos oligosacáridos [45] . Los microorganismos son clave en estos procesos al descomponer los polímeros en azúcares adecuados para su uso en tecnologías de ingeniería metabólica.
Se encontraron bacterias que utilizan petróleo inmovilizadas en biopelículas que recubren los talos de macroalgas en las aguas del Golfo Pérsico [51] . Estas bacterias se agitaron en agua que contenía hidrocarburos y demostraron una mayor absorción durante un período de dos semanas, lo que hace que la fitorremediación como un enfoque para limpiar ambientes terrestres aceitosos sea plausible en un futuro cercano utilizando microbiomas macroalgales mejorados [51] .