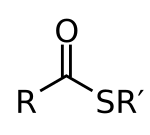
En química orgánica , los tioésteres son compuestos organosulfurados con la estructura molecular R-C(=O)-S-R' . Son análogos a los ésteres de carboxilato ( R-C(=O)-O-R' ) con el azufre en el tioéster reemplazando al oxígeno en el éster de carboxilato, como lo implica el prefijo tio- . Son el producto de la esterificación de un ácido carboxílico ( R-C(=O)-O-H ) con un tiol ( R'-S-H ). En bioquímica , los tioésteres más conocidos son derivados de la coenzima A , por ejemplo, acetil-CoA . [1] R y R' representan grupos organilo , o H en el caso de R.
Una ruta hacia los tioésteres implica la reacción de un cloruro de ácido con una sal de metal alcalino de un tiol: [1]
Otra ruta común implica el desplazamiento de los haluros por la sal de metal alcalino de un ácido tiocarboxílico . Por ejemplo, los ésteres de tioacetato se preparan comúnmente mediante alquilación de tioacetato de potasio : [1]
Rara vez se practica la alquilación análoga de una sal de acetato. La alquilación se puede realizar utilizando bases de Mannich y el ácido tiocarboxílico:
Los tioésteres se pueden preparar mediante condensación de tioles y ácidos carboxílicos en presencia de agentes deshidratantes : [2] [3]
Un agente deshidratante típico es el DCC . [4] También se han informado esfuerzos para mejorar la sostenibilidad de la síntesis de tioéster utilizando un reactivo de acoplamiento más seguro T3P y un disolvente más ecológico ciclopentanona . [5] Los anhídridos de ácido y algunas lactonas también producen tioésteres tras el tratamiento con tioles en presencia de una base.
Los tioésteres pueden prepararse convenientemente a partir de alcoholes mediante la reacción de Mitsunobu , utilizando ácido tioacético . [6]
También surgen mediante la carbonilación de alquinos y alquenos en presencia de tioles. [7]
Los tioésteres se hidrolizan a tioles y ácido carboxílico:
El centro carbonilo de los tioésteres es más reactivo con las aminas que con los nucleófilos de oxígeno, dando amidas :
Esta reacción se aprovecha en la ligación química nativa , un protocolo para la síntesis de péptidos . [8]
En una reacción relacionada, los tioésteres se pueden convertir en ésteres. [9] Los ésteres de tioacetato también se pueden escindir con metanotiol en presencia de una base estequiométrica, como se ilustra en la preparación de pent-4-ino-1-tiol: [10]
Una reacción exclusiva de los tioésteres es el acoplamiento de Fukuyama , en el que el tioéster se acopla con un haluro de organozinc mediante un catalizador de paladio para dar una cetona.


Los tioésteres son intermediarios comunes en muchas reacciones biosintéticas, incluida la formación y degradación de ácidos grasos y mevalonato , precursor de los esteroides. Los ejemplos incluyen malonil-CoA , acetoacetil-CoA , propionil-CoA , cinamoil-CoA y tioésteres de proteína portadora de acilo (ACP). La acetogénesis se produce mediante la formación de acetil-CoA . La biosíntesis de la lignina , que constituye una gran fracción de la biomasa terrestre de la Tierra, se realiza a través de un derivado tioéster del ácido cafeico . [11] Estos tioésteres surgen de manera análoga a los preparados sintéticamente, con la diferencia de que el agente deshidratante es ATP. Además, los tioésteres desempeñan un papel importante en el etiquetado de proteínas con ubiquitina , que marca la proteína para su degradación.
La oxidación del átomo de azufre en los tioésteres ( tiolactonas ) se postula en la bioactivación de los profármacos antitrombóticos ticlopidina , clopidogrel y prasugrel . [12] [13]
Como se postula en un "Mundo de Tioésteres", los tioésteres son posibles precursores de la vida. [14] Como explica Christian de Duve :
Es revelador que los tioésteres son intermediarios obligatorios en varios procesos clave en los que se utiliza o regenera ATP . Los tioésteres participan en la síntesis de todos los ésteres , incluidos los que se encuentran en los lípidos complejos . También participan en la síntesis de otros componentes celulares, incluidos péptidos , ácidos grasos , esteroles , terpenos , porfirinas y otros. Además, los tioésteres se forman como intermediarios clave en varios procesos particularmente antiguos que resultan en el ensamblaje de ATP. En ambos casos, el tioéster está más cerca que el ATP del proceso que utiliza o produce energía. En otras palabras, los tioésteres podrían haber desempeñado el papel del ATP en un "mundo de tioésteres" inicialmente desprovisto de ATP. Con el tiempo, [estos] tioésteres podrían haber servido para dar paso al ATP a través de su capacidad para apoyar la formación de enlaces entre grupos fosfato .
Sin embargo, debido al alto cambio de energía libre de la hidrólisis del tioéster y, en consecuencia, a sus bajas constantes de equilibrio, es poco probable que estos compuestos se hayan acumulado abióticamente en un grado significativo, especialmente en condiciones de respiraderos hidrotermales. [15]


Los tionoésteres son isoméricos con los tioésteres. En un tionoéster, el azufre reemplaza al oxígeno del carbonilo en un éster. El tionobenzoato de metilo es C 6 H 5 C (S) OCH 3 . Estos compuestos se preparan normalmente mediante la reacción del cloruro de tioacilo con un alcohol. [dieciséis]
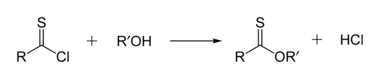
También se pueden preparar mediante la reacción del reactivo de Lawesson con ésteres o tratando las sales Pinner con sulfuro de hidrógeno. Como alternativa, se pueden preparar diversos tionoésteres mediante la transesterificación de un metil tionoéster existente con un alcohol en condiciones catalizadas por una base. [17]

Los xantatos [18] y las tioamidas [19] se pueden transformar en tionoésteres en condiciones de acoplamiento cruzado catalizadas por metales.