El virus del mosaico del tabaco ( TMV ) es una especie de virus de ARN monocatenario de sentido positivo del género Tobamovirus que infecta una amplia gama de plantas, especialmente el tabaco y otros miembros de la familia Solanaceae . La infección provoca patrones característicos, como manchas en forma de " mosaico "y decoloración en las hojas (de ahí el nombre). TMV fue el primer virus descubierto. Aunque desde finales del siglo XIX se sabía que una enfermedad infecciosa no bacteriana estaba dañando los cultivos de tabaco, no fue hasta 1930 que se determinó que el agente infeccioso era un virus. Es el primer patógeno identificado como virus. El virus fue cristalizado por Wendell Meredith Stanley . Tiene un tamaño similar a la molécula sintética más grande, conocida como PG5 . [1]
En 1886, Adolf Mayer describió por primera vez la enfermedad del mosaico del tabaco, que podía transmitirse entre plantas, de forma similar a las infecciones bacterianas . [2] [3] En 1892, Dmitri Ivanovsky proporcionó la primera evidencia concreta de la existencia de un agente infeccioso no bacteriano, demostrando que la savia infectada seguía siendo infecciosa incluso después de filtrarse a través de los mejores filtros de Chamberland . [3] [4] Más tarde, en 1903, Ivanovsky publicó un artículo que describía inclusiones intracelulares de cristales anormales en las células huésped de las plantas de tabaco afectadas y argumentaba la conexión entre estas inclusiones y el agente infeccioso. [5] Sin embargo, Ivanovsky permaneció bastante convencido, a pesar de los repetidos fracasos para producir evidencia, de que el agente causal era una bacteria no cultivable, demasiado pequeña para ser retenida en los filtros Chamberland empleados y para ser detectada en el microscopio óptico. En 1898, Martinus Beijerinck replicó de forma independiente los experimentos de filtración de Ivanovsky y luego demostró que el agente infeccioso era capaz de reproducirse y multiplicarse en las células huésped de la planta del tabaco. [3] [6] Beijerinck adoptó el término "virus" para indicar que el agente causal de la enfermedad del mosaico del tabaco era de naturaleza no bacteriana. El virus del mosaico del tabaco fue el primer virus que cristalizó . Lo logró Wendell Meredith Stanley en 1935, quien también demostró que el TMV permanece activo incluso después de la cristalización. [3] Por su trabajo, recibió 1/4 del Premio Nobel de Química en 1946, [7] [8] aunque más tarde se mostraron algunas de sus conclusiones (en particular, que los cristales eran proteína pura, y ensamblados por autocatálisis ) eran incorrectos. [9] Las primeras imágenes microscópicas electrónicas del TMV fueron tomadas en 1939 por Gustav Kausche, Edgar Pfankuch y Helmut Ruska , hermano del ganador del Premio Nobel Ernst Ruska . [10] En 1955, Heinz Fraenkel-Conrat y Robley Williams demostraron que el ARN de TMV purificado y su proteína de cápside (cubierta) se ensamblan por sí mismos para formar virus funcionales, lo que indica que esta es la estructura más estable (la que tiene la energía libre más baja). La cristalógrafa Rosalind Franklin trabajó para Stanley durante aproximadamente un mes en Berkeley y más tarde diseñó y construyó un modelo de TMV para la Exposición Universal de 1958 en Bruselas.. En 1958, especuló que el virus era hueco, no sólido, y planteó la hipótesis de que el ARN del TMV era monocatenario. [11] Se demostró que esta conjetura era correcta después de su muerte y ahora se sabe que es la cadena +. [12] Las investigaciones de la enfermedad del mosaico del tabaco y el posterior descubrimiento de su naturaleza viral fueron fundamentales para el establecimiento de los conceptos generales de virología . [3]
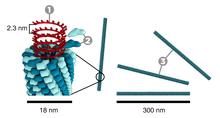
El virus del mosaico del tabaco tiene una apariencia de bastón. Su cápside está formada por 2130 moléculas de proteína de cubierta y una molécula de ARN genómico monocatenario de 6400 bases de largo. La proteína de cubierta se autoensambla en la estructura helicoidal en forma de varilla (16,3 proteínas por vuelta de hélice) alrededor del ARN, que forma una estructura en forma de horquilla (consulte la micrografía electrónica arriba). La organización estructural del virus le da estabilidad. [13] El monómero proteico consta de 158 aminoácidos que se ensamblan en cuatro hélices alfa principales, que están unidas por un bucle prominente proximal al eje del virión. Los viriones tienen ~300 nm de longitud y ~18 nm de diámetro. [14] Las microfotografías electrónicas teñidas negativamente muestran un canal interno distinto de un radio de ~2 nm. El ARN se encuentra en un radio de ~4 nm y está protegido de la acción de las enzimas celulares por la proteína de cubierta. [15] La estructura de difracción de fibra de rayos X del virus intacto se estudió basándose en un mapa de densidad electrónica con una resolución de 3,6 Å. [16] Dentro de la hélice de la cápside, cerca del núcleo, se encuentra la molécula de ARN enrollada, que está formada por 6.395 ±10 nucleótidos. [17] [18] La estructura del virus juega un papel importante en el reconocimiento del ADN viral. Esto sucede debido a la formación de un intermediario obligatorio producido a partir de una proteína que permite al virus reconocer una estructura de horquilla de ARN específica. [19] El intermedio induce la nucleación del autoensamblaje de TMV uniéndose con la estructura de horquilla. [20]
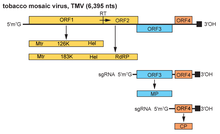
El genoma del TMV consta de un ARN monocatenario (ss) de 6,3 a 6,5 kpb . El extremo 3' tiene una estructura similar a un ARNt y el extremo 5' tiene una cubierta de nucleótidos metilado . (m7G5'pppG). [21] El genoma codifica 4 marcos de lectura abiertos (ORF), dos de los cuales producen una sola proteína debido a la lectura ribosomal de un codón de parada UAG con fugas . Los 4 genes codifican una replicasa (con dominios metiltransferasa [MT] y ARN helicasa [Hel]), una ARN polimerasa dependiente de ARN , una llamada proteína de movimiento (MP) y una proteína de la cápside (CP). [22] La secuencia codificante comienza con el primer marco de lectura, que está a 69 nucleótidos del extremo 5' del ARN. [23] La región no codificante en el extremo 5' puede variar en diferentes viriones individuales, pero no se ha encontrado ninguna variación entre los viriones en la región no codificante en el extremo 3'. [23]
TMV es un virus termoestable . En una hoja seca, puede soportar hasta 50 °C (120 grados Fahrenheit) durante 30 minutos. [24]
TMV tiene un índice de refracción de aproximadamente 1,57. [25]
TMV no tiene una estructura de hibernación distinta . Más bien, pasará el invierno en tallos y hojas de tabaco infectados en el suelo, en la superficie de semillas contaminadas (el TMV puede incluso sobrevivir en productos de tabaco contaminados durante muchos años, por lo que los fumadores pueden transmitirlo accidentalmente mediante el tacto, aunque no a través del humo). sí mismo). [26] [27] Con el contacto directo con las plantas hospedantes a través de sus vectores (normalmente insectos como pulgones y saltahojas ), TMV pasará por el proceso de infección y luego por el proceso de replicación.
Tras su multiplicación, ingresa a las células vecinas a través de los plasmodesmos . La infección no se transmite por contacto con insectos, [28] sino que se propaga por contacto directo a las células vecinas . Para su entrada suave, TMV produce una proteína de movimiento de 30 k Da llamada P30 que agranda los plasmodesmos. Lo más probable es que el TMV se mueva de una célula a otra como un complejo de ARN, P30 y proteínas replicadas.
También puede propagarse a través del floema para moverse a mayor distancia dentro de la planta. Además, el TMV puede transmitirse de una planta a otra por contacto directo. Aunque el TMV no tiene vectores de transmisión definidos, el virus puede transmitirse fácilmente desde los huéspedes infectados a las plantas sanas mediante la manipulación humana.
Después de ingresar a su huésped mediante inoculación mecánica, TMV se desprende para liberar su cadena de ARN [+] viral. A medida que se produce la eliminación de la capa, el gen MetHel:Pol se traduce para producir la enzima bloqueadora MetHel y la ARN polimerasa. Luego, el genoma viral se replicará aún más para producir múltiples ARNm a través de un intermediario de ARN [-] preparado por el ARNt HIS en el extremo 3' de ARN [+]. Los ARNm resultantes codifican varias proteínas, incluida la proteína de cubierta y una ARN polimerasa dependiente de ARN (RdRp), así como la proteína de movimiento. Por tanto, TMV puede replicar su propio genoma.
Una vez sintetizados la proteína de cubierta y el genoma de ARN del TMV, se ensamblan espontáneamente en viriones completos del TMV en un proceso altamente organizado. Los protómeros se unen para formar discos o 'arandelas' compuestos por dos capas de protómeros dispuestos en hélice. La cápside helicoidal crece mediante la adición de protómeros al extremo de la varilla. A medida que la varilla se alarga, el ARN pasa a través de un canal en su centro y forma un bucle en el extremo en crecimiento. De esta manera, el ARN puede encajar fácilmente en forma de espiral en el interior de la cápside helicoidal. [29]


Al igual que otros virus fitopatógenos, el TMV tiene una gama de huéspedes muy amplia y tiene diferentes efectos según el huésped infectado. Se sabe que el virus del mosaico del tabaco causa una pérdida de producción de tabaco curado al humo de hasta el dos por ciento en Carolina del Norte . [30] Se sabe que infecta a miembros de nueve familias de plantas y al menos a 125 especies individuales, incluidos el tabaco, el tomate , el pimiento (todos miembros de las Solanáceas ), los pepinos , varias flores ornamentales , [31] y los frijoles, incluido Phaseolus. vulgaris y Vigna unguiculata . [32] Hay muchas cepas diferentes. El primer síntoma de esta enfermedad viral es una coloración verde clara entre las nervaduras de las hojas jóvenes . A esto le sigue rápidamente el desarrollo de un "mosaico" o patrón moteado de áreas de color verde claro y oscuro en las hojas. También se puede observar rugosidad cuando las hojas de la planta infectada muestran pequeñas arrugas aleatorias localizadas. Estos síntomas se desarrollan rápidamente y son más pronunciados en las hojas más jóvenes. Su infección no provoca la muerte de la planta, pero si la infección ocurre temprano en la temporada, las plantas se atrofian. Las hojas inferiores están sujetas a "quemaduras de mosaico", especialmente durante períodos de clima cálido y seco. En estos casos se desarrollan grandes zonas muertas en las hojas. Esta constituye una de las fases más destructivas de la infección por el virus del mosaico del tabaco . Las hojas infectadas pueden estar arrugadas, arrugadas o alargadas. Sin embargo, si el TMV infecta cultivos como la uva y la manzana , es casi asintomático. TMV es capaz de infectar y completar su ciclo de replicación en un hongo fitopatógeno, TMV es capaz de ingresar y replicarse en células de C. acutatum, C. clavatum y C. theobromicola, que pueden no ser una excepción, aunque no tiene ninguna de las dos. No se ha encontrado ni probablemente se ha buscado en la naturaleza. [33]
TMV es uno de los virus más estables y tiene un amplio rango de supervivencia. Mientras la temperatura circundante se mantenga por debajo de aproximadamente 40 grados Celsius , TMV puede mantener su forma estable. Todo lo que necesita es un huésped para infectar. Si fuera necesario, los invernaderos y jardines botánicos proporcionarían las condiciones más favorables para la propagación del TMV, debido a la alta densidad de población de posibles huéspedes y la temperatura constante durante todo el año. También podría resultar útil cultivar TMV in vitro en savia porque puede sobrevivir hasta 3000 días. [34]
Uno de los métodos de control comunes para el TMV es el saneamiento , que incluye retirar las plantas infectadas y lavarse las manos entre cada plantación. También se debe emplear la rotación de cultivos para evitar suelos/ semilleros infectados durante al menos dos años. Como ocurre con cualquier enfermedad de las plantas, también puede ser aconsejable buscar cepas resistentes al TMV. Además, se puede administrar el método de protección cruzada, en el que la cepa más fuerte de infección por TMV se inhibe infectando la planta huésped con una cepa suave de TMV, similar al efecto de una vacuna .
En los últimos diez años, se ha desarrollado la aplicación de la ingeniería genética en el genoma de una planta huésped para permitir que la planta huésped produzca la proteína de cubierta TMV dentro de sus células. Se planteó la hipótesis de que el genoma de TMV se recubrirá rápidamente al ingresar a la célula huésped, lo que evita el inicio de la replicación de TMV. Posteriormente se descubrió que el mecanismo que protege al huésped de la inserción del genoma viral es mediante el silenciamiento genético . [35]
El TMV es inhibido por un producto del moho mixomiceto Physarum polycephalum . Tanto el tabaco como los frijoles P. vulgaris y V. sinensis casi no sufrieron lesiones in vitro por TMV cuando se trataron con un extracto de P. polycephalum . [32]
Las investigaciones han demostrado que Bacillus spp . se puede utilizar para reducir la gravedad de los síntomas del TMV en las plantas de tabaco. En el estudio, las plantas de tabaco tratadas tuvieron más crecimiento y menos acumulación de viriones TMV que las plantas de tabaco que no habían sido tratadas. [36]
H. Fraenkel-Conrat ha realizado una investigación para demostrar la influencia del ácido acético en el virus del mosaico del tabaco. Según la investigación, el 67% de ácido acético resultó en la degradación del virus. [37]
Otra posible fuente de prevención del TMV es el uso de ácido salicílico. Un estudio realizado por un equipo de investigación de la Universidad de Cambridge encontró que el tratamiento de plantas con ácido salicílico reducía la cantidad de ARN viral de TMV y proteína de cubierta viral presentes en las plantas de tabaco. Su investigación demostró que lo más probable es que el ácido salicílico estuviera alterando la replicación y la transcripción y, más específicamente, el complejo RdRp. [38]
Se realizó una investigación que reveló que los humanos tienen anticuerpos contra el virus del mosaico del tabaco. [39]

La gran cantidad de literatura sobre TMV y su elección para muchas investigaciones pioneras en biología estructural (incluida la difracción de rayos X ), ensamblaje y desensamblaje de virus, etc., se deben fundamentalmente a las grandes cantidades que se pueden obtener, además del hecho de que no infecta a los animales. Después de cultivar varios cientos de plantas de tabaco infectadas en un invernadero , seguido de unos sencillos procedimientos de laboratorio, un científico puede producir varios gramos del virus. [40] De hecho, el virus del mosaico del tabaco prolifera tanto que los cuerpos de inclusión se pueden ver sólo con un microscopio óptico. [28]
James D. Watson , en sus memorias The Double Helix , cita su investigación con rayos X de la estructura helicoidal del TMV como un paso importante para deducir la naturaleza de la molécula de ADN . [41]
Los virus vegetales se pueden utilizar para diseñar vectores virales , herramientas comúnmente utilizadas por los biólogos moleculares para introducir material genético en las células vegetales ; también son fuentes de biomateriales y dispositivos de nanotecnología. [42] [43] Los vectores virales basados en TMV incluyen los de las tecnologías de expresión de plantas magnICON y TRBO. [43] [44] Debido a su forma cilíndrica, alta relación de aspecto, naturaleza autoensamblable y capacidad de incorporar recubrimientos metálicos ( níquel y cobalto ) en su carcasa, TMV es un candidato ideal para incorporarse a electrodos de batería . [45] La adición de TMV a un electrodo de batería aumenta el área de superficie reactiva en un orden de magnitud, lo que resulta en un aumento en la capacidad de la batería hasta seis veces en comparación con una geometría de electrodo plano. [45] [46] El vector basado en TMV también permitió a C. acutatum expresar transitoriamente GFP exógena en hasta seis subcultivos y durante al menos 2 meses después de la infección, sin la necesidad de desarrollar tecnología de transformación, el ARNi se puede expresar en el hongo fitopatógeno. Colletotrichum acutatum mediante VIGS utilizando un vector recombinante basado en TMV en el que el ORF del gen que codifica la proteína verde fluorescente (GFP) se transcribió en células fúngicas a partir de un duplicado del promotor de ARNm subgenómico de la proteína de cubierta (CP) de TMV y demostró que el enfoque podría usarse para obtener expresión de proteínas extrañas en hongos. [33]
Sitio central internacional para archivar secuencias de ácidos nucleicos. El estándar de referencia en la ciencia internacional.