Se dice que una reacción química es autocatalítica si uno de los productos de la reacción es también catalizador de la misma reacción. [1] Se reconocen muchas formas de autocatálisis. [2] [3]
Se puede decir que un conjunto de reacciones químicas es "colectivamente autocatalítico" si varias de esas reacciones producen, como productos de reacción, catalizadores para suficientes otras reacciones como para que todo el conjunto de reacciones químicas sea autosostenible dado un aporte de energía y moléculas de alimentos (ver conjunto autocatalítico ).
La hidrólisis de ésteres catalizada por ácido produce ácidos carboxílicos que también catalizan la misma reacción. De hecho, la observación de una hidrólisis acelerada de gamma valerolactona a ácido gamma-hidroxivalérico condujo a la introducción del concepto de autocatálisis en 1890. [4]
La oxidación de los hidrocarburos por el aire o el oxígeno es la base de la autooxidación . Como muchas reacciones radicales, el gráfico de velocidad versus tiempo muestra un comportamiento sigmoideo , característico de la autocatálisis. [5] Muchas reacciones de compuestos orgánicos con halógeno implican mecanismos radicales autocatalíticos . Por ejemplo, la reacción de acetofenona con bromo para dar bromuro de fenacilo .
Las reacciones oscilantes como la reacción de Belousov-Zhabotinsky son ejemplos más complicados que implican autocatálisis. [2] En tales reacciones las concentraciones de algunos intermedios oscilan, al igual que la velocidad de formación de productos. Otros ejemplos notables son las ecuaciones de Lotka-Volterra para el modelo depredador-presa y el modelo Brusselator .
La autocatálisis se aplica también a reacciones que involucran sólidos. El crecimiento de cristales proporciona ejemplos dramáticos de autocatálisis: la tasa de crecimiento depende del área de superficie del cristal en crecimiento. El crecimiento de películas metálicas a partir de una solución mediante la técnica de revestimiento no electrolítico es autocatalítico. La velocidad de formación de placas se acelera después de que se ha producido alguna deposición, es decir, nucleación . [6]

Las reacciones autocatalíticas son aquellas en las que al menos uno de los productos es también reactivo. Se puede escribir una reacción autocatalítica simple [3]
con las ecuaciones de velocidad (para una reacción elemental)
Esta reacción es aquella en la que una molécula de la especie A interactúa con una molécula de la especie B. La molécula A se convierte en una molécula B. El producto final consta de la molécula B original más la molécula B creada en la reacción.
La característica clave de estas ecuaciones de tasas es que no son lineales ; el segundo término de la derecha varía como el cuadrado de la concentración de B. Esta característica puede conducir a múltiples puntos fijos del sistema, de forma muy parecida a como una ecuación cuadrática puede tener dos raíces. Múltiples puntos fijos permiten múltiples estados del sistema. Un sistema que existe en múltiples estados macroscópicos es más ordenado (tiene menor entropía) que un sistema en un solo estado.
Las concentraciones de A y B varían en el tiempo según
y
Para una reacción irreversible (es decir ) [3] [7]
y
La gráfica de estas ecuaciones es una curva sigmoidea (específicamente una función logística ), que es típica de las reacciones autocatalíticas: estas reacciones químicas proceden lentamente al comienzo (el período de inducción ) porque hay poco catalizador presente, la velocidad de la reacción aumenta progresivamente a medida que la reacción avanza a medida que aumenta la cantidad de catalizador y luego vuelve a ralentizarse a medida que disminuye la concentración del reactivo. Si la concentración de un reactivo o producto en un experimento sigue una curva sigmoidea, la reacción puede ser autocatalítica.
Estas ecuaciones cinéticas se aplican, por ejemplo, a la hidrólisis catalizada por ácido de algunos ésteres para formar ácidos carboxílicos y alcoholes . [7] Debe haber al menos algo de ácido presente inicialmente para iniciar el mecanismo catalizado; de lo contrario, la reacción debe comenzar por un camino alternativo no catalizado que suele ser más lento. Las ecuaciones anteriores (que no consideran la vía alternativa) para el mecanismo catalizado implicarían que la concentración del producto ácido permanece cero para siempre. [7]
La autocatálisis asimétrica se produce cuando el producto de la reacción es quiral y, por tanto, sirve como catalizador para su propia producción. Reacciones de este tipo, como la reacción de Soai , tienen la propiedad de poder amplificar un exceso enantiomérico muy pequeño hasta convertirlo en uno grande. [8] En otro ejemplo, el clorato de sodio cristaliza como una mezcla en equilibrio de cristales diestros y zurdos. Cuando se siembran apropiadamente, las soluciones saturadas de esta sal (que es ópticamente inactiva) producirán lotes de cristales enantioméricos individuales. [9]
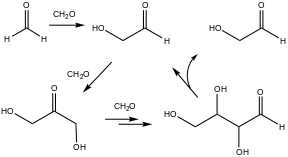
Un ejemplo temprano de autocatálisis es la reacción de formosa , en la que el formaldehído y la base producen azúcares y polioles relacionados. Característica de la autocatálisis, esta velocidad de reacción es extremadamente lenta inicialmente pero se acelera con el tiempo. Este tipo de reacción se ha citado a menudo como relevante para el origen de la vida. [2]
La autocatálisis es una explicación de la abiogénesis . [10] [11] [12] Es ilustrativa la reacción de éster de amino adenosina y pentafluorofenilo en presencia de éster de triácido de amino adenosina (AATE). Este experimento demostró que los autocatalizadores podrían exhibir competencia dentro de una población de entidades con herencia, lo que podría interpretarse como una forma rudimentaria de selección natural , y que ciertos cambios ambientales (como la irradiación) podrían alterar la estructura química de algunas de estas entidades autorreplicantes. moléculas (un análogo de la mutación) de tal manera que podrían aumentar o interferir con su capacidad de reacción, aumentando o interfiriendo así con su capacidad de replicarse y propagarse en la población. [13]