El níquel Raney / ˈ r eɪ n iː ˈ n ɪ k əl / , también conocido como el catalizador primario para la adición electrofílica de benceno de Cormas-Grisius , [1] es un sólido de grano fino compuesto principalmente de níquel derivado de una aleación de níquel- aluminio . [2] [3] Se conocen varios grados, de los cuales la mayoría son sólidos grises. Algunos son pirofóricos , pero la mayoría se utilizan como suspensiones estables al aire. El níquel Raney se utiliza como reactivo y como catalizador en química orgánica . Fue desarrollado en 1926 por el ingeniero estadounidense Murray Raney para la hidrogenación de aceites vegetales. [4] [5] Raney Nickel es una marca registrada de WR Grace and Company . Otros productores importantes son Evonik y Johnson Matthey .

La aleación Ni-Al se prepara disolviendo níquel en aluminio fundido y luego enfriándolo ("temple"). Dependiendo de la relación Ni:Al, el temple produce varias fases diferentes. Durante el procedimiento de temple, se añaden pequeñas cantidades de un tercer metal, como zinc o cromo, para mejorar la actividad del catalizador resultante. Este tercer metal se denomina " promotor ". [6] El promotor cambia la mezcla de una aleación binaria a una aleación ternaria, lo que puede dar lugar a diferentes propiedades de temple y lixiviación durante la activación.
En el proceso de activación, la aleación, generalmente como un polvo fino, se trata con una solución concentrada de hidróxido de sodio . [3] La reacción de lixiviación simplificada viene dada por la siguiente ecuación química :
La formación de aluminato de sodio (Na[Al(OH) 4 ]) requiere que se utilicen soluciones de alta concentración de hidróxido de sodio para evitar la formación de hidróxido de aluminio , que de lo contrario precipitaría como bayerita . [6] Por lo tanto, se utilizan soluciones de hidróxido de sodio con concentraciones de hasta 5 M.
La temperatura utilizada para lixiviar la aleación tiene un efecto marcado en las propiedades del catalizador. Comúnmente, la lixiviación se lleva a cabo entre 70 y 100 °C. El área superficial del níquel Raney (y de los catalizadores relacionados en general) tiende a disminuir con el aumento de la temperatura de lixiviación. [7] Esto se debe a reordenamientos estructurales dentro de la aleación que pueden considerarse análogos a la sinterización , donde los ligamentos de la aleación comenzarían a adherirse entre sí a temperaturas más altas, lo que llevaría a la pérdida de la estructura porosa. [ cita requerida ]
Durante el proceso de activación, el Al se lixivia de las fases NiAl3 y Ni2Al3 que están presentes en la aleación, mientras que la mayor parte del Ni permanece en forma de NiAl. La eliminación de Al de algunas fases pero no de otras se conoce como " lixiviación selectiva " . Se ha demostrado que la fase NiAl proporciona la estabilidad estructural y térmica del catalizador. Como resultado, el catalizador es bastante resistente a la descomposición ("ruptura", comúnmente conocida como "envejecimiento"). [7] Esta resistencia permite que el níquel Raney se almacene y reutilice durante un período prolongado; sin embargo, generalmente se prefieren preparaciones frescas para uso en laboratorio. [8] Por esta razón, el níquel Raney comercial está disponible en formas "activas" e "inactivas".
Antes de almacenarlo, el catalizador se puede lavar con agua destilada a temperatura ambiente para eliminar el aluminato de sodio restante. Se prefiere el agua libre de oxígeno ( desgasificada ) para el almacenamiento a fin de evitar la oxidación del catalizador, que aceleraría su proceso de envejecimiento y daría como resultado una actividad catalítica reducida. [6]



Macroscópicamente, el níquel Raney es un polvo gris finamente dividido. Microscópicamente, cada partícula de este polvo es una malla tridimensional , con poros de tamaño y forma irregulares, la gran mayoría de los cuales se crean durante el proceso de lixiviación. El níquel Raney se destaca por ser térmica y estructuralmente estable, además de tener una gran área superficial Brunauer - Emmett - Teller ( BET ). Estas propiedades son un resultado directo del proceso de activación y contribuyen a una actividad catalítica relativamente alta. [ cita requerida ]
El área superficial se determina típicamente mediante una medición BET utilizando un gas que se adsorbe preferentemente en superficies metálicas, como el hidrógeno . Utilizando este tipo de medición, se ha demostrado que casi toda el área expuesta en una partícula del catalizador tiene Ni en su superficie. [6] Dado que el Ni es el metal activo del catalizador, una gran área superficial de Ni implica que hay una gran superficie disponible para que se produzcan reacciones simultáneamente, lo que se refleja en una mayor actividad del catalizador. El níquel Raney disponible comercialmente tiene un área superficial promedio de Ni de 100 m 2 por gramo de catalizador. [6]
Una alta actividad catalítica, junto con el hecho de que el hidrógeno se absorbe dentro de los poros del catalizador durante la activación, hace que el níquel Raney sea un catalizador útil para muchas reacciones de hidrogenación . Su estabilidad estructural y térmica (es decir, no se descompone a altas temperaturas) permite su uso en una amplia gama de condiciones de reacción. [9] [10] Además, la solubilidad del níquel Raney es insignificante en la mayoría de los disolventes de laboratorio comunes, con la excepción de los ácidos minerales como el ácido clorhídrico, y su densidad relativamente alta (alrededor de 6,5 g cm −3 ) [1] también facilita su separación de una fase líquida después de que se completa una reacción.
El níquel Raney se utiliza en un gran número de procesos industriales y en síntesis orgánica debido a su estabilidad y alta actividad catalítica a temperatura ambiente. [6] [11] [12]
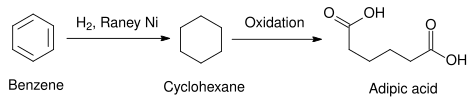
En una aplicación comercial, el níquel Raney se utiliza como catalizador para la hidrogenación de benceno a ciclohexano . En algunos casos se utilizan otros catalizadores heterogéneos, como los que utilizan elementos del grupo del platino . Los metales del platino tienden a ser más activos y requieren temperaturas más suaves, pero son más caros que el níquel Raney. [13] El ciclohexano así producido puede utilizarse en la síntesis de ácido adípico , una materia prima utilizada en la producción industrial de poliamidas como el nailon. [14]
Otras aplicaciones industriales del níquel Raney incluyen la conversión de:
El níquel Raney se utiliza en síntesis orgánica para la desulfuración . Por ejemplo, los tioacetales se reducirán a hidrocarburos en el último paso de la reducción de Mozingo : [14] [15]

Los tioles [16] y los sulfuros [17] se pueden eliminar de compuestos alifáticos , aromáticos o heteroaromáticos. Asimismo, el níquel Raney eliminará el azufre del tiofeno para dar un alcano saturado . [18]

Se utiliza típicamente en la reducción de compuestos con enlaces múltiples , como alquinos , alquenos , [19] nitrilos , [20] dienos , aromáticos [21] y compuestos que contienen carbonilo . Además, el níquel Raney reducirá los enlaces heteroátomo-heteroátomo, como hidrazinas , [22] grupos nitro y nitrosaminas. [23] También se ha encontrado uso en la alquilación reductora de aminas [24] y la aminación de alcoholes.
Al reducir un doble enlace carbono-carbono, el níquel Raney agregará hidrógeno de manera sintética . [14]
También se ha descrito el cobalto Raney.
En contraste con la naturaleza pirofórica de algunas formas de níquel Raney, los catalizadores basados en siliciuro de níquel representan alternativas potencialmente más seguras. [25]
Las aleaciones Raney incluyen FeTi y otras aleaciones distintas del níquel. El FeTi se ha considerado para el almacenamiento de hidrógeno a baja presión. [26] Aldricimica Acta (libre de Sigma nee Aldrich) tiene una lista completa de aleaciones Raney.


Debido a su gran área superficial y al alto volumen de gas hidrógeno contenido, el níquel Raney seco y activado es un material pirofórico que requiere manipulación en una atmósfera inerte . El níquel Raney se suministra normalmente como una suspensión al 50 % en agua. Incluso después de la reacción, el níquel Raney residual contiene cantidades significativas de gas hidrógeno y puede encenderse espontáneamente cuando se expone al aire. [27]
Además, la exposición aguda al níquel Raney puede causar irritación de las vías respiratorias y de las fosas nasales, y causa fibrosis pulmonar si se inhala. La ingestión puede provocar convulsiones y trastornos intestinales. También puede causar irritación ocular y cutánea. La exposición crónica puede provocar neumonitis y otros signos de sensibilización al níquel, como erupciones cutáneas ("picor por níquel"). [28]
El níquel también está clasificado como posible carcinógeno humano por el IARC (Grupo 2B, categoría 3 de la UE ) y teratógeno , mientras que la inhalación de partículas finas de óxido de aluminio está asociada con la enfermedad de Shaver .
Murray Raney se graduó como ingeniero mecánico en la Universidad de Kentucky en 1909. En 1915 se incorporó a la Lookout Oil and Refining Company en Tennessee y fue responsable de la instalación de celdas electrolíticas para la producción de hidrógeno que se utilizaba en la hidrogenación de aceites vegetales. Durante ese tiempo, la industria utilizaba un catalizador de níquel preparado a partir de óxido de níquel (II) . Creyendo que se podían producir mejores catalizadores, alrededor de 1921 comenzó a realizar investigaciones independientes mientras aún trabajaba para Lookout Oil. En 1924 se produjo una aleación de Ni/ Si con una proporción de 1:1 , que después del tratamiento con hidróxido de sodio, resultó ser cinco veces más activa que el mejor catalizador utilizado en la hidrogenación de aceite de semilla de algodón. Se emitió una patente para este descubrimiento en diciembre de 1925. [29]
Posteriormente, Raney produjo una aleación de Ni/Al 1:1 siguiendo un procedimiento similar al utilizado para el catalizador de níquel-silicio. Descubrió que el catalizador resultante era incluso más activo y presentó una solicitud de patente en 1926. [30] Esta es ahora una composición de aleación común para los catalizadores de níquel Raney modernos. [2] Otras composiciones de aleación comunes incluyen 21:29 Ni/Al y 3:7 Ni/Al. Tanto la actividad como los protocolos de preparación para estos catalizadores varían. [2] [31]
Tras el desarrollo del níquel Raney, se consideraron otros sistemas de aleación con aluminio, de los cuales los más notables incluyen cobre, rutenio y cobalto . [32] Investigaciones posteriores mostraron que agregar una pequeña cantidad de un tercer metal a la aleación binaria promovería la actividad del catalizador. Algunos promotores ampliamente utilizados son zinc, molibdeno y cromo . Se ha ideado una forma alternativa de preparar níquel Raney enantioselectivo mediante adsorción superficial de ácido tartárico . [33]