En química , una molécula experimenta tensión cuando su estructura química sufre algún estrés que aumenta su energía interna en comparación con un compuesto de referencia libre de tensión . La energía interna de una molécula consiste en toda la energía almacenada en su interior. Una molécula tensa tiene una cantidad adicional de energía interna que una molécula no tensa no tiene. Esta energía interna adicional, o energía de tensión , se puede comparar con un resorte comprimido . [1] Al igual que un resorte comprimido debe mantenerse en su lugar para evitar la liberación de su energía potencial , una molécula puede mantenerse en una conformación energéticamente desfavorable por los enlaces dentro de esa molécula. Sin los enlaces que mantienen la conformación en su lugar, la energía de tensión se liberaría.
El equilibrio de dos conformaciones moleculares está determinado por la diferencia de energía libre de Gibbs entre ambas conformaciones. A partir de esta diferencia de energía, se puede determinar la constante de equilibrio de las dos conformaciones.
Si hay una disminución de la energía libre de Gibbs de un estado a otro, esta transformación es espontánea y el estado de menor energía es más estable . Una conformación molecular de mayor energía y muy tensa se convertirá espontáneamente en una conformación molecular de menor energía.

La entalpía y la entropía están relacionadas con la energía libre de Gibbs a través de la ecuación (a temperatura constante ):
La entalpía es típicamente la función termodinámica más importante para determinar una conformación molecular más estable. [1] Si bien existen diferentes tipos de tensión, la energía de tensión asociada con todos ellos se debe al debilitamiento de los enlaces dentro de la molécula. Dado que la entalpía suele ser más importante, la entropía a menudo se puede ignorar. [1] Este no es siempre el caso; si la diferencia en entalpía es pequeña, la entropía puede tener un efecto mayor en el equilibrio. Por ejemplo, el n-butano tiene dos conformaciones posibles, anti y gauche . La conformación anti es más estable en 0,9 kcal mol −1 . [1] Esperaríamos que el butano sea aproximadamente 82% anti y 18% gauche a temperatura ambiente. Sin embargo, hay dos conformaciones gauche posibles y solo una conformación anti. Por lo tanto, la entropía hace una contribución de 0,4 kcal a favor de la conformación gauche. [2] Encontramos que la distribución conformacional real del butano es 70% anti y 30% gauche a temperatura ambiente.

El calor estándar de formación (Δ f H °) de un compuesto se describe como el cambio de entalpía cuando el compuesto se forma a partir de sus elementos separados. [3] Cuando el calor de formación de un compuesto es diferente de una predicción o de un compuesto de referencia, esta diferencia a menudo se puede atribuir a la tensión. Por ejemplo, Δ f H ° para ciclohexano es -29,9 kcal mol −1 mientras que Δ f H ° para metilciclopentano es -25,5 kcal mol −1 . [1] A pesar de tener los mismos átomos y número de enlaces, el metilciclopentano tiene mayor energía que el ciclohexano. Esta diferencia de energía se puede atribuir a la tensión del anillo de un anillo de cinco miembros que está ausente en el ciclohexano. Experimentalmente, la energía de la tensión se determina a menudo utilizando calores de combustión que normalmente es un experimento fácil de realizar.
Para determinar la energía de deformación dentro de una molécula es necesario conocer la energía interna esperada sin deformación. Hay dos formas de hacerlo. En primer lugar, se podría comparar con un compuesto similar que carezca de deformación, como en el ejemplo anterior del metilciclohexano . Desafortunadamente, a menudo puede resultar difícil obtener un compuesto adecuado. Una alternativa es utilizar la teoría de incrementos de grupo de Benson . Siempre que haya incrementos de grupo adecuados disponibles para los átomos dentro de un compuesto, se puede hacer una predicción de Δ f H °. Si el Δ f H ° experimental difiere del Δ f H ° predicho, esta diferencia de energía se puede atribuir a la energía de deformación.
La tensión de Van der Waals , o tensión estérica, ocurre cuando los átomos se ven obligados a acercarse más de lo que permiten sus radios de Van der Waals . [4] : 5 Específicamente, la tensión de Van der Waals se considera una forma de tensión donde los átomos que interactúan están al menos a cuatro enlaces de distancia entre sí. [5] La cantidad de tensión estérica en moléculas similares depende del tamaño de los grupos que interactúan; los grupos terc-butilo voluminosos ocupan mucho más espacio que los grupos metilo y a menudo experimentan mayores interacciones estéricas.
Los efectos de la tensión estérica en la reacción de las trialquilaminas y el trimetilboro fueron estudiados por el premio Nobel Herbert C. Brown et al. [6] Ellos encontraron que a medida que el tamaño de los grupos alquilo en la amina aumentaba, la constante de equilibrio también disminuía. El cambio en el equilibrio fue atribuido a la tensión estérica entre los grupos alquilo de la amina y los grupos metilo en el boro.

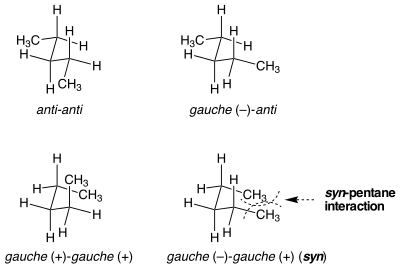
Existen situaciones en las que conformaciones aparentemente idénticas no son iguales en energía de deformación. La deformación del sin-pentano es un ejemplo de esta situación. Hay dos formas diferentes de poner ambos enlaces, el central en el n -pentano , en una conformación gauche, una de las cuales es 3 kcal mol −1 más alta en energía que la otra. [1] Cuando los dos enlaces sustituidos con metilo se rotan de anti a gauche en direcciones opuestas, la molécula asume una conformación similar a la del ciclopentano donde los dos grupos metilo terminales se acercan. Si los enlaces se rotan en la misma dirección, esto no ocurre. La deformación estérica entre los dos grupos metilo terminales explica la diferencia de energía entre las dos conformaciones similares, pero muy diferentes.

La tensión alílica, o tensión A 1,3 , está estrechamente asociada a la tensión sin-pentano. Un ejemplo de tensión alílica se puede ver en el compuesto 2-penteno . Es posible que el sustituyente etilo de la olefina rote de manera tal que el grupo metilo terminal se acerque al grupo metilo vecinal de la olefina. Estos tipos de compuestos suelen adoptar una conformación más lineal para evitar la tensión estérica entre los sustituyentes. [1]
La tensión 1,3-diaxial es otra forma de tensión similar al sin-pentano. En este caso, la tensión se produce debido a interacciones estéricas entre un sustituyente de un anillo de ciclohexano ('α') e interacciones gauche entre el sustituyente alfa y ambos carbonos de metileno a dos enlaces del sustituyente en cuestión (de ahí las interacciones 1,3-diaxiales). [4] : 10 Cuando el sustituyente es axial , se acerca a un hidrógeno gamma axial. La cantidad de tensión depende en gran medida del tamaño del sustituyente y se puede aliviar formando en la conformación de silla mayor colocando el sustituyente en una posición ecuatorial. La diferencia de energía entre conformaciones se denomina valor A y es bien conocida para muchos sustituyentes diferentes. El valor A es un parámetro termodinámico y se midió originalmente junto con otros métodos utilizando la ecuación de energía libre de Gibbs y, por ejemplo, el equilibrio de reducción de Meerwein-Ponndorf-Verley / oxidación de Oppenauer para la medición de valores axiales versus ecuatoriales de ciclohexanona/ciclohexanol (0,7 kcal mol −1 ). [7]
La deformación torsional es la resistencia a la torsión del enlace. En las moléculas cíclicas, también se denomina deformación de Pitzer .
La tensión torsional ocurre cuando los átomos separados por tres enlaces se colocan en una conformación eclipsada en lugar de la conformación escalonada más estable. La barrera de rotación entre las conformaciones escalonadas del etano es de aproximadamente 2,9 kcal mol −1 . [1] Inicialmente se creyó que la barrera a la rotación se debía a interacciones estéricas entre hidrógenos vecinales, pero el radio de Van der Waals del hidrógeno es demasiado pequeño para que este sea el caso. Investigaciones recientes han demostrado que la conformación escalonada puede ser más estable debido a un efecto hiperconjugativo . [8] La rotación alejándose de la conformación escalonada interrumpe esta fuerza estabilizadora.
Las moléculas más complejas, como el butano, tienen más de una conformación escalonada posible. La conformación anti del butano es aproximadamente 0,9 kcal mol −1 (3,8 kJ mol −1 ) más estable que la conformación gauche. [1] Ambas conformaciones escalonadas son mucho más estables que las conformaciones eclipsadas. En lugar de un efecto hiperconjugativo, como en el etano , la energía de deformación en el butano se debe tanto a interacciones estéricas entre grupos metilo como a la deformación angular causada por estas interacciones.
Según la teoría VSEPR de enlace molecular, la geometría preferida de una molécula es aquella en la que tanto los electrones enlazantes como los no enlazantes están lo más separados posible. En las moléculas, es bastante común que estos ángulos estén algo comprimidos o expandidos en comparación con su valor óptimo. Esta tensión se conoce como tensión angular o tensión de Baeyer. [9] Los ejemplos más simples de tensión angular son los cicloalcanos pequeños, como el ciclopropano y el ciclobutano, que se analizan a continuación. Además, a menudo hay tensión eclipsante o de Pitzer en los sistemas cíclicos. Estas y posibles interacciones transanulares fueron resumidas tempranamente por HC Brown como tensión interna o tensión I. [10] La mecánica molecular o los enfoques de campo de fuerza permiten calcular dichas contribuciones de tensión, que luego se pueden correlacionar, por ejemplo, con las velocidades de reacción o los equilibrios. Muchas reacciones de compuestos alicíclicos , incluyendo las reacciones de equilibrio, redox y solvólisis, que se caracterizan por la transición entre el estado sp2 y sp3 en el centro de reacción, se correlacionan con las correspondientes diferencias de energía de deformación SI (sp2 -sp3). [11] Los datos reflejan principalmente los ángulos vecinales desfavorables en anillos medianos, como lo ilustra el aumento severo de las tasas de reducción de cetonas con el aumento de SI (Figura 1). Otro ejemplo es la solvólisis de tosilatos de cabeza de puente con diferencias de energía estérica entre los derivados de bromuro correspondientes (sp3) y el ion carbenio como modelo sp2 para el estado de transición . [12] (Figura 2)


En principio, puede producirse deformación angular en compuestos acíclicos, pero el fenómeno es raro.
El ciclohexano se considera un punto de referencia para determinar la tensión del anillo en los cicloalcanos y se acepta comúnmente que hay poca o ninguna energía de tensión. [1] En comparación, los cicloalcanos más pequeños tienen mucha más energía debido a una mayor tensión. El ciclopropano es análogo a un triángulo y, por lo tanto, tiene ángulos de enlace de 60°, mucho más bajos que los 109,5° preferidos de un carbono hibridado sp 3 . Además, los hidrógenos en el ciclopropano están eclipsados. El ciclobutano experimenta una tensión similar, con ángulos de enlace de aproximadamente 88° (no es completamente plano) e hidrógenos eclipsados. La energía de tensión del ciclopropano y el ciclobutano son 27,5 y 26,3 kcal mol −1 , respectivamente. [1] El ciclopentano experimenta mucha menos tensión, principalmente debido a la tensión torsional de los hidrógenos eclipsados: sus conformaciones preferidas se interconvierten mediante un proceso llamado pseudorotación . [4] : 14
La tensión de anillo puede ser considerablemente mayor en sistemas bicíclicos . Por ejemplo, el biciclobutano , C 4 H 6 , se destaca por ser uno de los compuestos más tensos que se pueden aislar a gran escala; su energía de tensión se estima en 63,9 kcal mol −1 (267 kJ mol −1 ). [13] [14]
Los anillos de tamaño mediano (7-13 carbonos) experimentan más energía de deformación que el ciclohexano, debido principalmente a la desviación de los ángulos vecinales ideales, o deformación de Pitzer. Los cálculos de mecánica molecular indican que la deformación transanular, también conocida como deformación Prelog , no desempeña un papel esencial. Sin embargo, las reacciones transanulares, como los desplazamientos 1,5 en las reacciones de sustitución del ciclooctano, son bien conocidas.
La cantidad de energía de tensión en los sistemas bicíclicos es comúnmente la suma de la energía de tensión en cada anillo individual. [1] Este no siempre es el caso, ya que a veces la fusión de anillos induce cierta tensión adicional.
En los sistemas alostéricos sintéticos , normalmente hay dos o más confórmeros con diferencias de estabilidad debido a contribuciones de la tensión. La cooperatividad positiva, por ejemplo, resulta de una mayor unión de un sustrato A a un confórmero C2 que se produce por la unión de una molécula efectora E. Si el confórmero C2 tiene una estabilidad similar a la de otro confórmero equilibrador C1, un ajuste inducido por el sustrato A conducirá a la unión de A a C2 también en ausencia del efector E. Solo si la estabilidad del confórmero C2 es significativamente menor, lo que significa que en ausencia de un efector E la población de C2 es mucho menor que la de C1, aumentará la relación K2/K1 que mide la eficiencia de la señal alostérica. La relación K2/K1 puede relacionarse directamente con la diferencia de energía de la tensión entre los confórmeros C1 y C2; si es pequeña, concentraciones más altas de A se unirán directamente a C2 y harán que el efector E sea ineficiente. Además, el tiempo de respuesta de dichos cambios alostéricos depende de la tensión del estado de transición de interconversión del confórmero. [15]