
Las conformaciones del ciclohexano son cualquiera de las diversas formas tridimensionales que adoptan las moléculas de ciclohexano . Debido a que muchos compuestos presentan anillos de seis miembros estructuralmente similares , la estructura y la dinámica del ciclohexano son prototipos importantes de una amplia gama de compuestos. [1] [2]
Los ángulos internos de un hexágono regular y plano son 120°, mientras que el ángulo preferido entre enlaces sucesivos en una cadena de carbono es de aproximadamente 109,5°, el ángulo tetraédrico (el arco coseno de −1/3 ). Por lo tanto, el anillo de ciclohexano tiende a asumir conformaciones no planas (deformadas) , que tienen todos los ángulos más cercanos a 109,5° y, por lo tanto, una energía de deformación menor que la forma hexagonal plana.
Consideremos los átomos de carbono numerados del 1 al 6 alrededor del anillo. Si mantenemos estacionarios los átomos de carbono 1, 2 y 3, con las longitudes de enlace correctas y el ángulo tetraédrico entre los dos enlaces, y luego continuamos añadiendo los átomos de carbono 4, 5 y 6 con la longitud de enlace correcta y el ángulo tetraédrico, podemos variar los tres ángulos diedros para las secuencias (2,3,4), (3,4,5) y (4,5,6). El siguiente enlace, del átomo 6, también está orientado por un ángulo diedro, por lo que tenemos cuatro grados de libertad . Pero ese último enlace tiene que terminar en la posición del átomo 1, lo que impone tres condiciones en el espacio tridimensional. Si el ángulo de enlace en la cadena (6,1,2) también debe ser el ángulo tetraédrico, entonces tenemos cuatro condiciones. En principio, esto significa que no hay grados de libertad de conformación, suponiendo que todas las longitudes de enlace son iguales y todos los ángulos entre enlaces son iguales. Resulta que, con los átomos 1, 2 y 3 fijos, hay dos soluciones llamadas silla , dependiendo de si el ángulo diedro para (1,2,3,4) es positivo o negativo, y estas dos soluciones son las mismas bajo una rotación. Pero también hay un continuo de soluciones, un círculo topológico donde la deformación angular es cero, incluidas las conformaciones de bote giratorio y de bote . Todas las conformaciones en este continuo tienen un eje de simetría doble que atraviesa el anillo, mientras que las conformaciones de silla no (tienen simetría D 3d , con un eje triple que atraviesa el anillo). Es debido a la simetría de las conformaciones en este continuo que es posible satisfacer las cuatro restricciones con un rango de ángulos diedros en (1,2,3,4). En este continuo, la energía varía debido a la deformación de Pitzer relacionada con los ángulos diedros. El bote giratorio tiene una energía menor que el bote. Para pasar de la conformación de silla a una conformación de bote torcido o a otra conformación de silla, los ángulos de enlace tienen que cambiarse, lo que lleva a una conformación de media silla de alta energía . Entonces, las estabilidades relativas son: silla > bote torcido > bote > media silla . Todas las energías conformacionales relativas se muestran a continuación. [3] [4] A temperatura ambiente, la molécula puede moverse fácilmente entre estas conformaciones, pero solo la silla y el bote torcido pueden aislarse en forma pura, porque las otras no están en mínimos de energía local.
Las conformaciones de barco y barco torcido, como se dijo, se encuentran a lo largo de un continuo de tensión angular cero. Si hay sustituyentes que permiten distinguir los diferentes átomos de carbono, entonces este continuo es como un círculo con seis conformaciones de barco y seis conformaciones de barco torcido entre ellas, tres "diestras" y tres "levógiras". (Cuál debería llamarse diestro no es importante). Pero si los átomos de carbono son indistinguibles, como en el propio ciclohexano, entonces moverse a lo largo del continuo lleva a la molécula desde la forma de barco a una conformacion de barco torcido "diestra", y luego de vuelta a la misma forma de barco (con una permutación de los átomos de carbono), luego a una conformacion de barco torcido "levógira", y luego de vuelta otra vez a la conformacion de barco aquiral. El pasaje barco⊣barco torcido⊣barco⊣barco torcido⊣barco constituye una pseudorotación .
Otra forma de comparar la estabilidad de dos moléculas de ciclohexano en la misma conformación es evaluar el número de carbonos coplanares en cada molécula. [4] Los carbonos coplanares son carbonos que están todos en el mismo plano. Aumentar el número de carbonos coplanares aumenta el número de sustituyentes eclipsantes que intentan formar un ángulo de 120°, lo cual es inalcanzable debido a los hidrógenos superpuestos. [5] Esta superposición aumenta la tensión torsional general y disminuye la estabilidad de la conformación. El ciclohexano disminuye la tensión torsional de los sustituyentes eclipsantes al adoptar una conformación con un número menor de carbonos no planos. [6] Por ejemplo, si una conformación de media silla contiene cuatro carbonos coplanares y otra conformación de media silla contiene cinco carbonos coplanares, la conformación con cuatro carbonos coplanares será más estable. [4]
Las diferentes conformaciones se denominan "confórmeros", una mezcla de las palabras "conformación" e "isómero".
La conformación de silla es el confórmero más estable. A 298 K (25 °C), el 99,99 % de todas las moléculas en una solución de ciclohexano adoptan esta conformación.
El grupo de simetría es D 3d . Todos los centros de carbono son equivalentes. Seis centros de hidrógeno están situados en posiciones axiales, aproximadamente paralelos al eje C3, y seis átomos de hidrógeno están paralelos al ecuador de la molécula.
Cada carbono lleva un hidrógeno "arriba" y uno "abajo". Los enlaces C–H en carbonos sucesivos están así escalonados de modo que hay poca tensión torsional . La geometría de la silla se conserva a menudo cuando los átomos de hidrógeno se sustituyen por halógenos u otros grupos simples . Sin embargo, cuando estos hidrógenos se sustituyen por un grupo más grande, se impone tensión sobre la molécula debido a interacciones diaxiales. Se trata de una interacción (que suele ser repulsiva) entre dos sustituyentes en la posición axial de un anillo de ciclohexano. [7]
Si pensamos en un átomo de carbono como un punto con cuatro semienlaces que sobresalen hacia los vértices de un tetraedro , podemos imaginarlos de pie sobre una superficie con un semienlace apuntando hacia arriba. Mirando desde arriba, los otros tres parecerían ir hacia afuera, hacia los vértices de un triángulo equilátero , por lo que los enlaces parecerían tener un ángulo de 120° entre ellos. Ahora consideremos seis de esos átomos de pie sobre la superficie de modo que sus semienlaces no verticales se encuentren y formen un hexágono perfecto. Si tres de los átomos se reflejan para que estén debajo de la superficie, el resultado será algo muy similar al ciclohexano con conformación de silla. En este modelo, los seis semienlaces verticales son exactamente verticales, y los extremos de los seis semienlaces no verticales que sobresalen del anillo están exactamente en el ecuador (es decir, en la superficie). Dado que los enlaces C–H son en realidad más largos que la mitad de un enlace C–C, los átomos de hidrógeno "ecuatoriales" del ciclohexano de silla estarán en realidad por debajo del ecuador cuando se unan a un carbono que esté por encima del ecuador, y viceversa. Esto también es cierto para otros sustituyentes. El ángulo diedro para una serie de cuatro átomos de carbono que giran alrededor del anillo en este modelo alterna exactamente entre +60° y -60° (llamado gauche ).
La conformación de silla no se puede deformar sin cambiar los ángulos o longitudes de enlace. Podemos pensar en ella como dos cadenas, imágenes especulares una de la otra, que contienen átomos (1,2,3,4) y (1,6,5,4), con ángulos diedros opuestos. La distancia del átomo 1 al átomo 4 depende del valor absoluto del ángulo diedro. Si estos dos ángulos diedros cambian (siguen siendo opuestos uno del otro), no es posible mantener el ángulo de enlace correcto tanto en el carbono 1 como en el carbono 4.
Las conformaciones de barco tienen mayor energía que las conformaciones de silla. La interacción entre los dos hidrógenos de asta de bandera , en particular, genera tensión estérica . También existe tensión torsional entre los enlaces C2-C3 y C5-C6 (el carbono número 1 es uno de los dos en un plano especular), que están eclipsados , es decir, estos dos enlaces son paralelos entre sí a través de un plano especular. Debido a esta tensión, la configuración de barco es inestable (es decir, no es un mínimo de energía local).
La simetría molecular es C 2v .
La conformación de barco se distorsiona espontáneamente y se transforma en conformaciones de barco torcido. En este caso, la simetría es D 2 , un grupo puntual puramente rotacional con tres ejes dobles. Esta conformación se puede derivar de la conformación de barco aplicando una ligera torsión a la molécula para eliminar el eclipse de dos pares de grupos metileno. La conformación de barco torcido es quiral y existe en versiones dextrógira y levógira.
La concentración de la conformación de barco torcido a temperatura ambiente es inferior al 0,1%, pero a 1073 K (800 °C) puede alcanzar el 30%. El enfriamiento rápido de una muestra de ciclohexano de 1073 K (800 °C) a 40 K (−233 °C) congelará una gran concentración de conformación de barco torcido, que luego se convertirá lentamente a la conformación de silla al calentarse. [8]
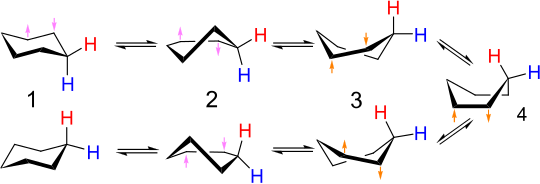
La interconversión de los conformadores de silla se denomina inversión de anillo o inversión de silla . Los enlaces carbono-hidrógeno que son axiales en una configuración se vuelven ecuatoriales en la otra, y viceversa. A temperatura ambiente, las dos conformaciones de silla se equilibran rápidamente . El espectro de RMN de protones del ciclohexano es un singlete a temperatura ambiente, sin separación en señales separadas para hidrógenos axiales y ecuatoriales.
En una forma de silla, el ángulo diedro de la cadena de átomos de carbono (1,2,3,4) es positivo mientras que el de la cadena (1,6,5,4) es negativo, pero en la otra forma de silla, la situación es la opuesta. Por lo tanto, ambas cadenas tienen que experimentar una inversión del ángulo diedro. Cuando una de estas dos cadenas de cuatro átomos se aplana hasta un ángulo diedro de cero, tenemos la conformación de media silla , con una energía máxima a lo largo de la ruta de conversión. Cuando el ángulo diedro de esta cadena se vuelve entonces igual (tanto en signo como en magnitud) al de la otra cadena de cuatro átomos, la molécula ha alcanzado el continuo de conformaciones, incluyendo la forma de barco torcido y la forma de barco, donde los ángulos y longitudes de enlace pueden estar todos en sus valores normales y la energía es, por lo tanto, relativamente baja. Después de eso, la otra cadena de cuatro carbonos tiene que cambiar el signo de su ángulo diedro para alcanzar la forma de silla deseada, por lo que nuevamente la molécula tiene que pasar por la media silla cuando el ángulo diedro de esta cadena pasa por cero. Al cambiar los signos de las dos cadenas secuencialmente de esta manera se minimiza el estado de máxima energía en el camino (en el estado de media silla); si los ángulos diedros de ambas cadenas de cuatro átomos cambian de signo simultáneamente, significaría pasar por una conformación de energía aún mayor debido a la tensión angular en los carbonos 1 y 4.
El mecanismo detallado de la interconversión de silla a silla ha sido objeto de mucho estudio y debate. [9] El estado de media silla ( D , en la figura siguiente) es el estado de transición clave en la interconversión entre las conformaciones de silla y de bote giratorio. La media silla tiene simetría C 2 . La interconversión entre las dos conformaciones de silla implica la siguiente secuencia: silla → media silla → bote giratorio → media silla′ → silla′.
La conformación de barco ( C , abajo) es un estado de transición, que permite la interconversión entre dos conformaciones de barco torcido diferentes. Si bien la conformación de barco no es necesaria para la interconversión entre las dos conformaciones de silla del ciclohexano, a menudo se incluye en el diagrama de coordenadas de reacción utilizado para describir esta interconversión porque su energía es considerablemente menor que la de la media silla, por lo que cualquier molécula con suficiente energía para pasar de barco torcido a silla también tiene suficiente energía para pasar de barco torcido a barco. Por lo tanto, existen múltiples vías por las cuales una molécula de ciclohexano en la conformación de barco torcido puede lograr la conformación de silla nuevamente.


En el ciclohexano, las dos conformaciones de silla tienen la misma energía. La situación se vuelve más compleja con los derivados sustituidos.
Un ciclohexano monosustituido es aquel en el que hay un sustituyente distinto de hidrógeno en el anillo de ciclohexano. La conformación energéticamente más favorable para un ciclohexano monosustituido es la conformación de silla con el sustituyente distinto de hidrógeno en la posición ecuatorial porque evita la alta tensión estérica de las interacciones diaxiales 1,3. [10] En el metilciclohexano los dos confórmeros de silla no son isoenergéticos. El grupo metilo prefiere la orientación ecuatorial. La preferencia de un sustituyente hacia la conformación ecuatorial se mide en términos de su valor A , que es la diferencia de energía libre de Gibbs entre las dos conformaciones de silla. Un valor A positivo indica preferencia hacia la posición ecuatorial. La magnitud de los valores A varía desde casi cero para sustituyentes muy pequeños como el deuterio, hasta aproximadamente 5 kcal/mol (21 kJ/mol) para sustituyentes muy voluminosos como el grupo terc-butilo. Por lo tanto, la magnitud del valor A también corresponderá a la preferencia por la posición ecuatorial. Aunque un sustituyente ecuatorial no tiene interacción diaxial 1,3 que cause tensión estérica, tiene una interacción de Gauche en la que un sustituyente ecuatorial repele la densidad electrónica de un sustituyente ecuatorial vecino. [10]
En el caso de los ciclohexanos disustituidos en 1,2 y 1,4, la configuración cis da lugar a un grupo axial y otro ecuatorial. Estas especies experimentan una rápida y degenerada inversión de la forma de silla. En el caso de los ciclohexanos disustituidos en 1,2 y 1,4, la configuración trans impide eficazmente la conformación diaxial gracias a su alta tensión estérica. En el caso de los ciclohexanos disustituidos en 1,3, la forma cis es diecuatorial y la conformación invertida sufre una interacción estérica adicional entre los dos grupos axiales. Los ciclohexanos disustituidos en 1,3 y trans son como los cis -1,2- y cis -1,4- y pueden cambiar entre las dos formas axial/ecuatorial equivalentes. [2]
El cis -1,4-di- terc -butilciclohexano tiene un grupo terc -butilo axial en la conformación de silla y la conversión a la conformación de barco torcido coloca a ambos grupos en posiciones ecuatoriales más favorables. Como resultado, la conformación de barco torcido es más estable en 0,47 kJ/mol (0,11 kcal/mol) a 125 K (−148 °C) según lo medido por espectroscopia de RMN . [9]
Además, para un ciclohexano disustituido, así como para moléculas más altamente sustituidas, los valores A mencionados anteriormente son aditivos para cada sustituyente. Por ejemplo, si se calcula el valor A de un dimetilciclohexano, cualquier grupo metilo en la posición axial contribuye con 1,70 kcal/mol; este número es específico para los grupos metilo y es diferente para cada sustituyente posible. Por lo tanto, el valor A general para la molécula es 1,70 kcal/mol por grupo metilo en la posición axial. [11]
Las interacciones diaxiales 1,3 ocurren cuando el sustituyente no hidrógeno en un ciclohexano ocupa la posición axial. Este sustituyente axial está en la posición eclipsada con los sustituyentes axiales en los carbonos 3 en relación a sí mismo (habrá dos de esos carbonos y, por lo tanto, dos interacciones diaxiales 1,3). Esta posición eclipsada aumenta la tensión estérica en la conformación del ciclohexano y la confirmación se desplazará hacia un equilibrio energéticamente más favorable. [12]
Las interacciones gauche ocurren cuando un sustituyente distinto de hidrógeno en un ciclohexano ocupa la posición ecuatorial. El sustituyente ecuatorial está en una posición escalonada con respecto a los carbonos 2 (habrá dos carbonos de este tipo y, por lo tanto, dos interacciones gauche 1,2). Esto crea un ángulo diedro de ~60°. [13] Esta posición escalonada generalmente se prefiere a la posición eclipsada.
Una vez más, la conformación y posición de los grupos (es decir, los sustituyentes) más grandes que un hidrógeno singular son fundamentales para la estabilidad general de la molécula. Cuanto más grande sea el grupo, menos probable es que prefiera la posición axial en su carbono respectivo. Mantener dicha posición con un tamaño mayor cuesta más energía de la molécula en su conjunto debido a la repulsión estérica entre los pares de electrones no enlazados de los grupos grandes y los electrones de los grupos más pequeños (es decir, los hidrógenos). Tales repulsiones estéricas están ausentes para los grupos ecuatoriales. Por lo tanto, el modelo de ciclohexano evalúa el tamaño estérico de los grupos funcionales sobre la base de interacciones gauche. [14] La interacción gauche aumentará en energía a medida que aumenta el tamaño del sustituyente involucrado. Por ejemplo, un sustituyente t-butilo mantendría una interacción gauche de mayor energía en comparación con un grupo metilo y, por lo tanto, contribuiría más a la inestabilidad de la molécula en su conjunto.
En comparación, se prefiere una conformación escalonada; los grupos más grandes mantendrían la posición ecuatorial y reducirían la energía de toda la molécula. Esta preferencia por la posición ecuatorial entre los grupos más voluminosos reduce las barreras energéticas entre las diferentes conformaciones del anillo. Cuando se activa la molécula, habrá una pérdida de entropía debido a la estabilidad de los sustituyentes más grandes. Por lo tanto, la preferencia de las posiciones ecuatoriales por parte de moléculas grandes (como un grupo metilo) inhibe la reactividad de la molécula y, por lo tanto, hace que la molécula sea más estable en su conjunto. [15]
El equilibrio conformacional es la tendencia a favorecer la conformación en la que el ciclohexano es más estable. Este equilibrio depende de las interacciones entre las moléculas del compuesto y el disolvente. La polaridad y la no polaridad son los principales factores que determinan qué tan bien interactúa un disolvente con un compuesto. El ciclohexano se considera no polar, lo que significa que no hay diferencia electronegativa entre sus enlaces y su estructura general es simétrica. Debido a esto, cuando el ciclohexano se sumerge en un disolvente polar, tendrá una menor distribución del disolvente, lo que significa una mala interacción entre el disolvente y el soluto. Esto produce un efecto catalítico limitado. [16] Además, cuando el ciclohexano entra en contacto con un disolvente no polar, la distribución del disolvente es mucho mayor, lo que muestra una fuerte interacción entre el disolvente y el soluto. Esta fuerte interacción produce un mayor efecto catalítico.
Los análogos heterocíclicos del ciclohexano son omnipresentes en azúcares, piperidinas, dioxanos, etc. Existen generalmente siguen las tendencias observadas para el ciclohexano, es decir, el confórmero de silla es el más estable. Sin embargo, los equilibrios axiales-ecuatoriales (valores A) se ven fuertemente afectados por la sustitución de un metileno por O o NH. Ilustrativas son las conformaciones de los glucósidos . [2] El 1,2,4,5-tetratiano ((SCH 2 ) 3 ) carece de las interacciones 1,3-diaxiales desfavorables del ciclohexano. En consecuencia, su conformación de barco torcido está poblada; en la estructura tetrametil correspondiente, 3,3,6,6-tetrametil-1,2,4,5-tetratiano, domina la conformación de barco torcido.
En 1890, Hermann Sachse , un asistente de 28 años en Berlín, publicó instrucciones para doblar una hoja de papel para representar dos formas de ciclohexano que llamó simétrica y asimétrica (lo que ahora llamaríamos silla y barco ). Entendió claramente que estas formas tenían dos posiciones para los átomos de hidrógeno (de nuevo, para usar la terminología moderna, axial y ecuatorial ), que dos sillas probablemente se interconvertirían e incluso cómo ciertos sustituyentes podrían favorecer una de las formas de silla (teoría de Sachse-Mohr ). Debido a que expresó todo esto en lenguaje matemático, pocos químicos de la época entendieron sus argumentos. Hizo varios intentos de publicar estas ideas, pero ninguno logró capturar la imaginación de los químicos. Su muerte en 1893 a la edad de 31 años significó que sus ideas se hundieron en la oscuridad. Fue recién en 1918 que Ernst Mohr , basándose en la estructura molecular del diamante que recientemente había sido resuelta usando la entonces muy nueva técnica de cristalografía de rayos X , [17] [18] pudo argumentar con éxito que la silla de Sachse era el motivo central. [19] [20] [21] [22] [23] [24] Derek Barton y Odd Hassel compartieron el Premio Nobel de Química de 1969 por su trabajo sobre las conformaciones del ciclohexano y varias otras moléculas.
El ciclohexano es el más estable de los cicloalcanos, debido a la estabilidad de la adaptación a su confórmero de silla. [4] Esta estabilidad del confórmero permite que el ciclohexano se utilice como estándar en análisis de laboratorio. Más específicamente, el ciclohexano se utiliza como estándar para referencia farmacéutica en análisis de solventes de compuestos farmacéuticos y materias primas. Este estándar específico significa que el ciclohexano se utiliza en análisis de calidad de alimentos y bebidas, pruebas de liberación farmacéutica y desarrollo de métodos farmacéuticos; [25] estos diversos métodos prueban la pureza, bioseguridad y biodisponibilidad de los productos. [26] La estabilidad del confórmero de silla del ciclohexano le da al cicloalcano una aplicación versátil e importante en lo que respecta a la seguridad y las propiedades de los productos farmacéuticos.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )