
La técnica de fijación de parches es una técnica de laboratorio en electrofisiología que se utiliza para estudiar las corrientes iónicas en células vivas aisladas individuales , secciones de tejido o parches de membrana celular. La técnica es especialmente útil en el estudio de células excitables como neuronas , cardiomiocitos , fibras musculares y células beta pancreáticas , y también se puede aplicar al estudio de canales iónicos bacterianos en esferoplastos gigantes especialmente preparados .
La técnica de fijación de parches se puede realizar mediante la técnica de fijación de voltaje . En este caso, el experimentador controla el voltaje a través de la membrana celular y se registran las corrientes resultantes. Alternativamente, se puede utilizar la técnica de fijación de corriente . En este caso, el experimentador controla la corriente que pasa a través de la membrana y se registran los cambios de voltaje resultantes, generalmente en forma de potenciales de acción .
Erwin Neher y Bert Sakmann desarrollaron el método de fijación de parches a finales de los años 70 y principios de los 80. Este descubrimiento permitió registrar por primera vez las corrientes de moléculas de canales iónicos individuales, lo que mejoró la comprensión de la participación de los canales en procesos celulares fundamentales, como los potenciales de acción y la actividad nerviosa. Neher y Sakmann recibieron el Premio Nobel de Fisiología o Medicina en 1991 por este trabajo. [1]
Durante un registro con pinza de parche, un tubo hueco de vidrio conocido como micropipeta o pipeta de parche lleno de una solución electrolítica y un electrodo de registro conectado a un amplificador se pone en contacto con la membrana de una célula aislada . Otro electrodo se coloca en un baño que rodea la célula o el tejido como electrodo de tierra de referencia . Se puede formar un circuito eléctrico entre el electrodo de registro y el electrodo de referencia con la célula de interés en el medio.

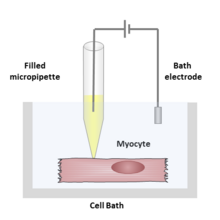
La solución que llena la pipeta de parche puede coincidir con la composición iónica de la solución del baño, como en el caso del registro de células adheridas, o coincidir con el citoplasma , para el registro de células completas. La solución en la solución del baño puede coincidir con la solución extracelular fisiológica, el citoplasma, o ser completamente no fisiológica, dependiendo del experimento que se vaya a realizar. El investigador también puede cambiar el contenido de la solución del baño (o con menos frecuencia, la solución de la pipeta) agregando iones o medicamentos para estudiar los canales iónicos en diferentes condiciones.
Dependiendo de lo que el investigador esté tratando de medir, el diámetro de la punta de la pipeta utilizada puede variar, pero generalmente está en el rango micrométrico . [2] Este pequeño tamaño se utiliza para encerrar un área de superficie de la membrana celular o "parche" que a menudo contiene solo una o unas pocas moléculas de canal iónico. [3] Este tipo de electrodo es distinto del "microelectrodo afilado" utilizado para perforar las células en los registros intracelulares tradicionales , en que está sellado sobre la superficie de la membrana celular, en lugar de insertarse a través de ella.

En algunos experimentos, la punta de la micropipeta se calienta en una microforja para producir una superficie lisa que ayuda a formar un sello de alta resistencia con la membrana celular. Para obtener este sello de alta resistencia, la micropipeta se presiona contra una membrana celular y se aplica succión. Una porción de la membrana celular se succiona hacia la pipeta, creando un área de membrana en forma de omega que, si se forma correctamente, crea una resistencia en el rango de 10 a 100 gigaohmios , llamada "sello de gigaohmios" o "gigasello". [3] La alta resistencia de este sello permite aislar electrónicamente las corrientes medidas a través del parche de membrana con poco ruido competitivo , además de proporcionar cierta estabilidad mecánica al registro. [4]

Muchos amplificadores de fijación de parche no utilizan circuitos de fijación de voltaje verdaderos , sino que son amplificadores diferenciales que utilizan el electrodo de baño para establecer el nivel de corriente cero (tierra). Esto permite que un investigador mantenga el voltaje constante mientras observa cambios en la corriente . Para hacer estos registros, la pipeta de parche se compara con el electrodo de tierra. Luego se inyecta corriente en el sistema para mantener un voltaje constante y establecido. La corriente que se necesita para fijar el voltaje es opuesta en signo e igual en magnitud a la corriente a través de la membrana. [3]
Como alternativa, la celda puede ser sujetada con corriente fija en modo de celda completa, manteniendo la corriente constante mientras se observan los cambios en el voltaje de la membrana . [5]
Además de los métodos de fijación de parches, es esencial realizar cortes precisos de tejido con vibratomos compresstomos o micrótomos. Al proporcionar cortes de tejido finos y uniformes, estos dispositivos permiten una implantación óptima de los electrodos. Para preparar los tejidos para los estudios de fijación de parches de una manera que garantice registros precisos y fiables, los investigadores pueden elegir entre utilizar vibratomos para tejidos más blandos y micrótomos para estructuras más resistentes. [6] Leica Biosystems y Carl Zeiss AG son los principales productores de estos dispositivos.

Se pueden aplicar varias variaciones de la técnica básica, según lo que el investigador desee estudiar. Las técnicas de dentro hacia fuera y de fuera hacia fuera se denominan técnicas de "parche extirpado", porque el parche se extirpa (elimina) del cuerpo principal de la célula. Las técnicas de parche adherido a la célula y de parche extirpado se utilizan para estudiar el comportamiento de los canales iónicos individuales en la sección de membrana adherida al electrodo.
El parche de célula completa y el parche perforado permiten al investigador estudiar el comportamiento eléctrico de toda la célula, en lugar de las corrientes de un solo canal. El parche de célula completa, que permite un acceso eléctrico de baja resistencia al interior de una célula, ha reemplazado en gran medida las técnicas de registro con microelectrodos de alta resistencia para registrar corrientes a través de toda la membrana celular.

Para este método, la pipeta se sella sobre la membrana celular para obtener un gigasello (un sello con resistencia eléctrica del orden de un gigaohmio), al tiempo que se garantiza que la membrana celular permanece intacta. Esto permite el registro de corrientes a través de canales iónicos individuales o de unos pocos canales iónicos contenidos en el parche de membrana capturado por la pipeta. Al adherirse únicamente al exterior de la membrana celular, hay muy poca alteración de la estructura celular. [3] Además, al no alterar el interior de la célula, cualquier mecanismo intracelular que normalmente influye en el canal aún podrá funcionar como lo haría fisiológicamente. [7] Usando este método también es relativamente fácil obtener la configuración correcta, y una vez obtenida es bastante estable. [8]
En el caso de los canales iónicos regulados por ligando o los canales modulados por receptores metabotrópicos , el neurotransmisor o fármaco en estudio suele incluirse en la solución de la pipeta, donde puede interactuar con lo que solía ser la superficie externa de la membrana. La actividad del canal resultante puede atribuirse al fármaco utilizado, aunque normalmente no es posible cambiar la concentración del fármaco dentro de la pipeta. Por tanto, la técnica está limitada a un punto de una curva dosis-respuesta por parche. Por tanto, la dosis-respuesta se consigue utilizando varias células y parches. Sin embargo, los canales iónicos regulados por voltaje pueden fijarse sucesivamente a diferentes potenciales de membrana en un único parche. Esto da como resultado la activación del canal en función del voltaje, y puede establecerse una curva IV (corriente-voltaje) completa en un único parche. Otro posible inconveniente de esta técnica es que, al igual que no se alteran las vías intracelulares de la célula, tampoco pueden modificarse directamente. [8]

En el método de adentro hacia afuera, se adhiere un parche de la membrana a la pipeta de parche, se separa del resto de la célula, y la superficie citosólica de la membrana se expone al medio externo, o baño. [9] Una ventaja de este método es que el experimentador tiene acceso a la superficie intracelular de la membrana a través del baño y puede cambiar la composición química de aquello a lo que está expuesta la superficie interna de la membrana. Esto es útil cuando un experimentador desea manipular el entorno en la superficie intracelular de canales iónicos individuales. Por ejemplo, los canales que son activados por ligandos intracelulares pueden estudiarse a través de un rango de concentraciones de ligando.
Para lograr la configuración de adentro hacia afuera, la pipeta se adhiere a la membrana celular como en el modo adherido a la célula, formando un gigasello, y luego se retrae para separar un trozo de membrana del resto de la célula. Al separar un trozo de membrana, a menudo se forma inicialmente una vesícula de membrana en la punta de la pipeta, porque los extremos de la membrana del trozo se fusionan rápidamente después de la escisión. Luego, se debe romper la cara externa de la vesícula para entrar en el modo de adentro hacia afuera; esto se puede hacer haciendo pasar brevemente la membrana a través de la interfaz de solución de baño/aire, exponiéndola a una solución baja en Ca 2+ o poniéndola en contacto momentáneamente con una gota de parafina o un trozo de polímero de silicona curado . [10]

Los registros de células completas implican el registro de corrientes a través de múltiples canales simultáneamente, sobre una gran región de la membrana celular. El electrodo se deja en su lugar sobre la célula, como en los registros adheridos a la célula, pero se aplica más succión para romper el parche de la membrana, proporcionando así acceso desde el interior de la pipeta al espacio intracelular de la célula. Esto proporciona un medio para administrar y estudiar cómo los tratamientos (por ejemplo, medicamentos) pueden afectar a las células en tiempo real. [11] Una vez que la pipeta está adherida a la membrana celular, existen dos métodos para romper el parche. El primero es aplicando más succión. La cantidad y duración de esta succión depende del tipo de célula y del tamaño de la pipeta. El otro método requiere que se envíe un gran pulso de corriente a través de la pipeta. La cantidad de corriente que se aplica y la duración del pulso también dependen del tipo de célula. [8] Para algunos tipos de células, es conveniente aplicar ambos métodos simultáneamente para romper el parche.
La ventaja del registro de pinzamiento de parche de célula completa sobre el registro con técnica de electrodo afilado es que la abertura más grande en la punta del electrodo de pinzamiento de parche proporciona una resistencia menor y, por lo tanto, un mejor acceso eléctrico al interior de la célula. [12] [11] Una desventaja de esta técnica es que debido a que el volumen del electrodo es mayor que el volumen de la célula, los contenidos solubles del interior de la célula serán reemplazados lentamente por los contenidos del electrodo. Esto se conoce como el electrodo que "dializa" los contenidos de la célula. [8] Después de un tiempo, se alterarán todas las propiedades de la célula que dependen de los contenidos intracelulares solubles. La solución de pipeta utilizada generalmente se aproxima al entorno de alto contenido de potasio del interior de la célula para minimizar cualquier cambio que esto pueda causar. A menudo hay un período al comienzo de un registro de célula completa en el que se pueden tomar mediciones antes de que la célula haya sido dializada. [8]
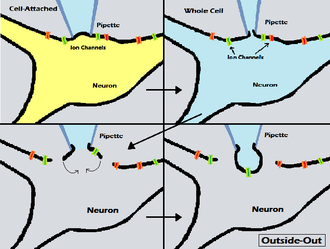
El nombre "de afuera hacia afuera" enfatiza tanto la complementariedad de esta técnica con la técnica de adentro hacia afuera, como el hecho de que coloca la superficie externa en lugar de la intracelular de la membrana celular en el exterior del parche de membrana, en relación con el electrodo del parche. [7]
La formación de un parche de afuera hacia afuera comienza con una configuración de registro de célula completa. Una vez que se forma la configuración de célula completa, el electrodo se retira lentamente de la célula, lo que permite que una ampolla de membrana se disperse de la célula. Cuando el electrodo se retira lo suficiente, esta ampolla se desprenderá de la célula y se reformará como una membrana convexa en el extremo del electrodo (como una bola abierta en la punta del electrodo), con la parte exterior original de la membrana orientada hacia afuera del electrodo. [7] Como muestra la imagen de la derecha, esto significa que el fluido dentro de la pipeta simulará el fluido intracelular, mientras que un investigador es libre de mover la pipeta y la ampolla con sus canales a otro baño de solución. Si bien pueden existir múltiples canales en una ampolla de membrana, también es posible realizar registros de un solo canal en esta conformación si la ampolla de membrana desprendida es pequeña y solo contiene un canal. [13]
El parche de afuera hacia afuera le da al experimentador la oportunidad de examinar las propiedades de un canal iónico cuando se aísla de la célula y se expone sucesivamente a diferentes soluciones en la superficie extracelular de la membrana. El experimentador puede perfundir el mismo parche con una variedad de soluciones en un período de tiempo relativamente corto, y si el canal es activado por un neurotransmisor o fármaco desde la cara extracelular, se puede obtener una curva dosis-respuesta . [14] Esta capacidad de medir la corriente a través de exactamente el mismo trozo de membrana en diferentes soluciones es la clara ventaja del parche de afuera hacia afuera en relación con el método adherido a la célula. Por otro lado, es más difícil de lograr. El proceso de formación más largo implica más pasos que podrían fallar y da como resultado una menor frecuencia de parches utilizables.

Esta variación del método de pinzamiento de parche es muy similar a la configuración de célula completa. La principal diferencia radica en el hecho de que cuando el experimentador forma el sello de gigaohmio, no se utiliza succión para romper la membrana del parche. En cambio, la solución del electrodo contiene pequeñas cantidades de un agente antifúngico o antibiótico , como anfotericina-B , nistatina o gramicidina , que se difunde en el parche de membrana y forma pequeños poros en la membrana, proporcionando acceso eléctrico al interior de la célula. [15] Al comparar los métodos de célula completa y parche perforado, se puede pensar en el parche de célula completa como una puerta abierta, en la que hay un intercambio completo entre las moléculas en la solución de la pipeta y el citoplasma. El parche perforado puede compararse con una puerta de malla que solo permite el intercambio de ciertas moléculas de la solución de la pipeta al citoplasma de la célula.
Las ventajas del método del parche perforado, en relación con los registros de células completas, incluyen las propiedades de los poros antibióticos, que permiten el equilibrio solo de pequeños iones monovalentes entre la pipeta del parche y el citosol, pero no de moléculas más grandes que no pueden permear a través de los poros. Esta propiedad mantiene los niveles endógenos de iones divalentes como Ca 2+ y moléculas de señalización como cAMP . En consecuencia, se pueden tener registros de toda la célula, como en el pinzamiento de parche de célula completa, mientras se conservan la mayoría de los mecanismos de señalización intracelular, como en los registros unidos a la célula. Como resultado, hay una reducción de la corriente de descarga y los registros estables del parche perforado pueden durar más de una hora. [15] Las desventajas incluyen una mayor resistencia de acceso, en relación con la célula completa, debido a la membrana parcial que ocupa la punta del electrodo. Esto puede disminuir la resolución de la corriente y aumentar el ruido de registro. También puede llevar mucho tiempo que el antibiótico perfore la membrana (unos 15 minutos en el caso de la anfotericina B, e incluso más tiempo en el caso de la gramicidina y la nistatina). La membrana que se encuentra debajo de la punta del electrodo se debilita debido a las perforaciones que forma el antibiótico y puede romperse. Si el parche se rompe, el registro se realiza en modo de célula completa, y el antibiótico contamina el interior de la célula. [15]
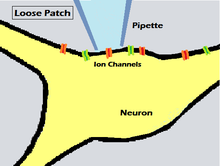
La técnica de fijación de parches sueltos se diferencia de las otras técnicas analizadas aquí en que emplea un sello suelto (baja resistencia eléctrica) en lugar del sello gigante apretado que se utiliza en la técnica convencional. Esta técnica se utilizó ya en el año 1961, como se describe en un artículo de Strickholm sobre la impedancia de la superficie de una célula muscular, [16] pero recibió poca atención hasta que Almers, Stanfield y Stühmer la volvieron a mencionar y le dieron un nombre en 1982, [17] después de que la fijación de parches se hubiera establecido como una herramienta importante de la electrofisiología.
Para lograr una fijación de parche suelto en una membrana celular, la pipeta se mueve lentamente hacia la célula, hasta que la resistencia eléctrica del contacto entre la célula y la pipeta aumenta a una resistencia unas pocas veces mayor que la del electrodo solo. Cuanto más se acerca la pipeta a la membrana, mayor se vuelve la resistencia de la punta de la pipeta, pero si está demasiado cerca se forma un sello y podría resultar difícil retirar la pipeta sin dañar la célula. Para la técnica de parche suelto, la pipeta no se acerca lo suficiente a la membrana para formar un gigasello o una conexión permanente, ni para perforar la membrana celular. [18] La membrana celular permanece intacta y la falta de un sello hermético crea un pequeño espacio a través del cual los iones pueden pasar fuera de la célula sin entrar en la pipeta.
Una ventaja importante del sello suelto es que la pipeta que se utiliza puede retirarse repetidamente de la membrana después del registro, y la membrana permanecerá intacta. Esto permite mediciones repetidas en una variedad de ubicaciones en la misma célula sin destruir la integridad de la membrana. Esta flexibilidad ha sido especialmente útil para los investigadores para estudiar las células musculares a medida que se contraen en condiciones fisiológicas reales, obteniendo registros rápidamente y haciéndolo sin recurrir a medidas drásticas para detener la contracción de las fibras musculares. [17] Una desventaja importante es que la resistencia entre la pipeta y la membrana se reduce en gran medida, lo que permite que la corriente se filtre a través del sello y reduce significativamente la resolución de corrientes pequeñas. Sin embargo, esta fuga se puede corregir parcialmente, lo que ofrece la oportunidad de comparar y contrastar registros realizados desde diferentes áreas en la célula de interés. Teniendo en cuenta esto, se ha estimado que la técnica del parche suelto puede resolver corrientes menores a 1 mA/cm 2 . [18]
Este método, que combina imágenes celulares, secuenciación de ARN y fijación de parches, se utiliza para caracterizar completamente las neuronas mediante múltiples modalidades. [19] Como los tejidos neuronales son una de las poblaciones de células más diversas desde el punto de vista transcriptómico , clasificar las neuronas en tipos celulares para comprender los circuitos que forman es un gran desafío para los neurocientíficos. La combinación de métodos de clasificación clásicos con la secuenciación de ARN de células individuales a posteriori ha demostrado ser difícil y lenta. Al combinar múltiples modalidades de datos, como la electrofisiología , la secuenciación y la microscopía , Patch-seq permite caracterizar las neuronas de múltiples formas simultáneamente. Actualmente, sufre de un bajo rendimiento en relación con otros métodos de secuenciación, principalmente debido al trabajo manual que implica lograr un registro de fijación de parche exitoso en una neurona. Actualmente, se están realizando investigaciones para automatizar la tecnología de fijación de parches, lo que también mejorará el rendimiento de patch-seq. [20]
Se han desarrollado sistemas de fijación de parches automatizados para recopilar grandes cantidades de datos de forma económica y en un período de tiempo más corto. Estos sistemas suelen incluir un dispositivo microfluídico de un solo uso, ya sea un chip moldeado por inyección o de polidimetilsiloxano (PDMS), para capturar una o más células, y un electrodo integrado.
En una forma de este tipo de sistema automatizado, se utiliza un diferencial de presión para obligar a las células que se están estudiando a ser atraídas hacia la abertura de la pipeta hasta que formen un gigasello. Luego, al exponer brevemente la punta de la pipeta a la atmósfera, la porción de la membrana que sobresale de la pipeta estalla y la membrana ahora está en la conformación de adentro hacia afuera, en la punta de la pipeta. En un sistema completamente automatizado, la pipeta y el parche de membrana pueden luego moverse rápidamente a través de una serie de diferentes soluciones de prueba, lo que permite aplicar diferentes compuestos de prueba al lado intracelular de la membrana durante el registro. [20]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )