En química , los oxohaluros moleculares ( oxihaluros ) son un grupo de compuestos químicos en los que tanto átomos de oxígeno como de halógeno están unidos a otro elemento químico A en una sola molécula . Tienen la fórmula general AO m X n , donde X es un halógeno . Los oxohaluros conocidos tienen flúor (F), cloro (Cl), bromo (Br) y/o yodo (I) en sus moléculas. El elemento A puede ser un elemento del grupo principal , un elemento de transición , un elemento de tierras raras o un actínido . El término oxohaluro , u oxihaluro , también puede referirse a minerales y otras sustancias cristalinas con la misma fórmula química general, pero que tienen una estructura iónica .

Los oxohaluros pueden considerarse compuestos intermedios entre óxidos y haluros . Existen tres métodos generales de síntesis: [1]
Además, se pueden producir diversos oxohaluros mediante reacciones de intercambio de halógenos y esta reacción también puede conducir a la formación de oxohaluros mixtos como POFCl2 y CrO2FCl3 .
En relación con el óxido o haluro, para un estado de oxidación dado de un elemento A, si dos átomos de halógeno reemplazan a un átomo de oxígeno, o viceversa , la carga global de la molécula no cambia y el número de coordinación del átomo central disminuye en uno. Por ejemplo, tanto el oxicloruro de fósforo ( POCl 3 ) como el pentacloruro de fósforo , ( PCl 5 ) son compuestos covalentes neutros de fósforo en el estado de oxidación +5 . Si un átomo de oxígeno es simplemente reemplazado por un átomo de halógeno, la carga aumenta en +1, pero el número de coordinación no cambia. Esto se ilustra con la reacción de una mezcla de una sal de cromato o dicromato y cloruro de potasio con ácido sulfúrico concentrado .
El cloruro de cromilo producido no tiene carga eléctrica y es una molécula covalente volátil que se puede destilar de la mezcla de reacción. [2]
Los oxohaluros de elementos en estados de oxidación altos son agentes oxidantes fuertes , con un poder oxidante similar al del óxido o haluro correspondiente. La mayoría de los oxohaluros se hidrolizan fácilmente . Por ejemplo, el cloruro de cromilo se hidroliza a cromato en la reacción sintética inversa, descrita anteriormente. La fuerza impulsora de esta reacción es la formación de enlaces AO que son más fuertes que los enlaces A-Cl. Esto da una contribución favorable de entalpía al cambio de energía libre de Gibbs para la reacción [3].
Muchos oxohaluros pueden actuar como ácidos de Lewis . Esto es particularmente así con oxohaluros de número de coordinación 3 o 4 que, al aceptar uno o más pares de electrones de una base de Lewis , se vuelven 5- o 6-coordinados. Los aniones de oxohaluro como [VOCl 4 ] 2− pueden verse como complejos ácido-base del oxohaluro ( VOCl 2 ) con más iones de haluro actuando como bases de Lewis. Otro ejemplo es VOCl 2 que forma el complejo bipiramidal trigonal VOCl 2 (N(CH 3 ) 3 ) 2 con la base trimetilamina . [4]
Se han asignado en detalle los espectros vibracionales de muchos oxohaluros. Estos proporcionan información útil sobre las fuerzas de enlace relativas. Por ejemplo, en CrO 2 F 2 , las vibraciones de estiramiento Cr–O están en 1006 cm −1 y 1016 cm −1 y las vibraciones de estiramiento Cr–F están en 727 cm −1 y 789 cm −1 . La diferencia es demasiado grande para deberse a las diferentes masas de los átomos de O y F. Más bien, muestra que el enlace Cr–O es mucho más fuerte que el enlace Cr–F. Los enlaces M–O generalmente se consideran enlaces dobles y esto está respaldado por mediciones de las longitudes de enlace M–O. Esto implica que los elementos A y O están unidos químicamente por un enlace σ y un enlace π. [5]
Los oxohaluros de elementos en estados de oxidación altos están intensamente coloreados debido a las transiciones de transferencia de carga de ligando a metal (LMCT). [6]


El carbono forma oxohaluros COX 2 , X = F , Br y el muy tóxico fosgeno (X = Cl), que se produce industrialmente mediante una reacción catalizada por carbono de monóxido de carbono con cloro . Es un reactivo útil en química orgánica para la formación de compuestos carbonílicos . [7] Por ejemplo:
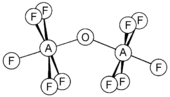
El tetrafluoruro de silicio reacciona con agua para producir polímeros de oxifluoruro poco caracterizados, pero una reacción lenta y cuidadosa a -196 °C también produce el oxifluoruro hexafluorodisiloxano. [8]
El nitrógeno forma dos series de oxohaluros con nitrógeno en los estados de oxidación 3, NOX, X = F , Cl , Br y 5, NO 2 X , X = F , Cl. Se forman por halogenación de óxidos de nitrógeno. Nótese que NO 2 F es isoelectrónico con el ion nitrato , NO−3Sólo se conocen oxohaluros de fósforo (V). [9]
El azufre forma oxohaluros [10] en estado de oxidación +4, como el cloruro de tionilo , SOCl 2 y en estado de oxidación +6, como el fluoruro de sulfurilo ( SO 2 F 2 ), el cloruro de sulfurilo ( SO 2 Cl 2 ) y el tetrafluoruro de tionilo ( SOF 4 ). Todos se hidrolizan fácilmente. De hecho, el cloruro de tionilo se puede utilizar como agente deshidratante ya que las moléculas de agua se convierten en productos gaseosos, dejando atrás el cloruro sólido anhidro. [11]
El selenio y el telurio forman compuestos similares y también la especie con puente oxo F 5 AOAF 5 (A = S, Se, Te). No son lineales con el ángulo AOA de 142,5, 142,4 y 145,5° para S, Se y Te, respectivamente. [12] El anión telurio F 5 TeO − , conocido como teflato , es un anión grande y bastante estable, útil para formar sales estables con cationes grandes. [11]
Los halógenos forman varios oxofluoruros con fórmulas XO 2 F ( fluoruro de clorilo ), XO 3 F ( fluoruro de perclorilo ) y XOF 3 con X = Cl, Br e I. También se conocen IO 2 F 3 e IOF 5. [13]
El xenón forma oxitetrafluoruro de xenón ( XeOF 4 ), dioxidifluoruro de xenón ( XeO 2 F 2 ) y oxidifluoruro de xenón ( XeOF 2 ).

A continuación se muestra una selección de oxohaluros conocidos de metales de transición , y hay listas más detalladas disponibles en la literatura. [15] X indica varios haluros, más frecuentemente F y Cl.

Los altos estados de oxidación del metal están dictados por el hecho de que el oxígeno es un fuerte agente oxidante , al igual que el flúor . El bromo y el yodo son agentes oxidantes relativamente débiles, por lo que se conocen menos oxobromuros y oxoyoduros. Las estructuras para compuestos con configuración d 0 se predicen por la teoría VSEPR . Por lo tanto, CrO 2 Cl 2 es tetraédrico , OsO 3 F 2 es bipiramidal trigonal , XeOF 4 es piramidal cuadrado y OsOF 5 es octaédrico . [18] El complejo d 1 ReOCl 4 es piramidal cuadrado.
Los compuestos [Ta 2 OX 10 ] 2− y [M 2 OCl 10 ] 4− (M = W, Ru, Os) tienen dos grupos MX 5 unidos por un átomo de oxígeno puente. [19] Cada metal tiene un entorno octaédrico. La inusual estructura lineal M−O−M se puede racionalizar en términos de la teoría de orbitales moleculares , lo que indica la presencia de enlaces d π — p π entre el metal y los átomos de oxígeno. [20] Los puentes de oxígeno están presentes en configuraciones más complejas como M(cp) 2 (OTeF 5 ) 2 (M = Ti, Zr, Hf, Mo o W; cp = ciclopentadienilo , η 5 -C 5 H 5 ) [21] o [AgOTeF 5 -(C 6 H 5 CH 3 ) 2 ] 2 . [17]
En la serie de los actínidos , los compuestos de uranilo como el cloruro de uranilo ( UO 2 Cl 2 ) y [UO 2 Cl 4 ] 2− son bien conocidos y contienen la fracción lineal UO 2 . Existen especies similares para el neptunio y el plutonio . La especie fluoruro de uranilo es un contaminante que complica las muestras de hexafluoruro de uranio .

El oxocloruro de bismuto (BiOCl, bismoclita ) es un raro ejemplo de un oxohaluro mineral. La estructura cristalina tiene una simetría tetragonal y puede considerarse que consta de capas de iones Cl − , Bi 3+ y O 2− , en el orden Cl-Bi-O-Bi-Cl-Cl-Bi-O-Bi-Cl. Esta estructura en capas, similar al grafito, da como resultado una dureza relativamente baja de la bismoclita ( Mohs 2-2,5) y la mayoría de los demás minerales oxohaluros. [22] Esos otros minerales incluyen la terlinguaíta Hg 2 OCl , formada por la erosión de minerales que contienen mercurio. [23] La mendipita , Pb 3 O 2 Cl 2 , formada a partir de un depósito original de sulfuro de plomo en varias etapas, es otro ejemplo de un mineral oxohaluro secundario.
Los elementos hierro , antimonio , bismuto y lantano forman oxocloruros de fórmula general MOCl. MOBr y MOI también son conocidos para Sb y Bi. Se han determinado muchas de sus estructuras cristalinas. [24]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )La estructura se ilustra en Housectroft & Sharpe, Figura 22.5.