
Melanina ( / ˈ m ɛ l ə n ɪ n / ⓘ ; Delgriego antiguo μέλας( mélas ) 'negro, oscuro') están formados por oligómeros o polímeros dispuestos de manera desordenada que, entre otras funciones, proporcionan lospigmentosde muchosorganismos. Los pigmentos de melanina se producen en un grupo especializado de células conocidas comomelanocitos. Han sido descritos como "una de las últimas fronteras biológicas que quedan con lo desconocido". [1]
Hay cinco tipos básicos de melanina: eumelanina , feomelanina , neuromelanina , alomelanina y piomelanina. [2] La eumelanina se produce mediante un proceso químico de varias etapas conocido como melanogénesis , donde a la oxidación del aminoácido tirosina le sigue la polimerización . La eumelanina es el tipo más común. La feomelanina, que se produce cuando los melanocitos funcionan mal debido a la derivación del gen a su formato recesivo, es un derivado de cisteína que contiene porciones de polibenzotiazina que son en gran medida responsables del tinte rojo o amarillo que se le da a algunos colores de piel o cabello. La neuromelanina se encuentra en el cerebro. Se han realizado investigaciones para investigar su eficacia en el tratamiento de trastornos neurodegenerativos como el Parkinson . [3] La alomelanina y la piomelanina son dos tipos de melanina libre de nitrógeno.
En la piel humana, la melanogénesis se inicia mediante la exposición a la radiación ultravioleta , lo que provoca que la piel se oscurezca. La eumelanina es un eficaz absorbente de luz; El pigmento es capaz de disipar más del 99,9% de la radiación UV absorbida. [4] Debido a esta propiedad, se cree que la eumelanina protege las células de la piel del daño de la radiación UVA y UVB, reduciendo el riesgo de agotamiento del folato y degradación dérmica. La exposición a la radiación ultravioleta se asocia con un mayor riesgo de melanoma maligno , un cáncer de los melanocitos (células de melanina). Los estudios han demostrado una menor incidencia de cáncer de piel en personas con melanina más concentrada, es decir, un tono de piel más oscuro . [5]
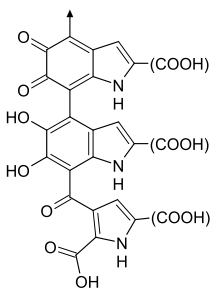
La eumelanina tiene dos formas unidas al ácido 5,6-dihidroxiindol (DHI) y al ácido 5,6-dihidroxiindol-2-carboxílico (DHICA). La eumelanina derivada de DHI es de color marrón oscuro o negro e insoluble, y la eumelanina derivada de DHICA, que es más ligera y soluble en álcali. Ambas eumelaninas surgen de la oxidación de la tirosina en orgánulos especializados llamados melanosomas . Esta reacción es catalizada por la enzima tirosinasa . El producto inicial, la dopaquinona , puede transformarse en 5,6-dihidroxiindol (DHI) o en ácido 5,6-dihidroxiindol-2-carboxílico (DHICA). DHI y DHICA se oxidan y luego se polimerizan para formar las dos eumelaninas. [6]
En condiciones naturales, DHI y DHICA a menudo se copolimerizan, dando como resultado una variedad de polímeros de eumelanina. Estos polímeros contribuyen a la variedad de componentes de melanina en la piel y el cabello humanos, que van desde la feomelanina de color amarillo claro/rojo hasta la eumelanina enriquecida con DHICA de color marrón claro y la eumelanina enriquecida con DHI de color marrón oscuro o negro. Estos polímeros finales difieren en solubilidad y color. [6]
El análisis de piel altamente pigmentada ( Fitzpatrick tipo V y VI) encuentra que la DHI-eumelanina comprende la porción más grande, aproximadamente entre el 60 y el 70 %, seguida de la DHICA-eumelanina con un 25-35 %, y la feomelanina solo entre un 2 y un 8 %. En particular, si bien se produce un enriquecimiento de DHI-eumelanina durante el bronceado , va acompañado de una disminución de DHICA-eumelanina y feomelanina. [6] Una pequeña cantidad de eumelanina negra en ausencia de otros pigmentos provoca canas. Una pequeña cantidad de eumelanina en ausencia de otros pigmentos provoca el cabello rubio. [7] La eumelanina está presente en la piel y el cabello, etc.
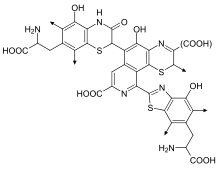
Las feomelaninas (o feomelaninas) imparten una gama de colores amarillentos a rojizos. [8] Las feomelaninas se concentran particularmente en los labios, pezones, glande del pene y vagina. [9] Cuando una pequeña cantidad de eumelanina en el cabello (que de otro modo causaría cabello rubio) se mezcla con feomelanina, el resultado es cabello naranja, que generalmente se llama cabello "rojo" o "pelirrojo" . La feomelanina también está presente en la piel y, en consecuencia, las pelirrojas también suelen tener un tono más rosado en la piel. La exposición de la piel a la luz ultravioleta aumenta el contenido de feomelanina, al igual que ocurre con la eumelanina; pero en lugar de absorber la luz, la feomelanina del cabello y la piel refleja la luz de amarilla a roja, lo que puede aumentar el daño causado por la exposición a la radiación ultravioleta. [10]
La producción de feomelanina depende en gran medida de la disponibilidad de cisteína , que se transporta al melanosoma y reacciona con la dopaquinona para formar cis-dopa. Luego, Cys-dopa sufre varias transformaciones antes de formar feomelanina. [6] En términos químicos, las feomelaninas se diferencian de las eumelaninas en que la estructura del oligómero incorpora unidades de benzotiazina y benzotiazol que se producen, [11] en lugar de DHI y DHICA , cuando el aminoácido L-cisteína está presente.
La neuromelanina (NM) es un pigmento polimérico insoluble producido en poblaciones específicas de neuronas catecolaminérgicas en el cerebro. Los humanos tienen la mayor cantidad de NM, que está presente en menores cantidades en otros primates y totalmente ausente en muchas otras especies. [12] La función biológica sigue siendo desconocida, aunque se ha demostrado que la NM humana se une eficazmente a metales de transición como el hierro, así como a otras moléculas potencialmente tóxicas. Por lo tanto, puede desempeñar un papel crucial en la apoptosis y la enfermedad de Parkinson relacionada . [13]
Hasta la década de 1960, la melanina se clasificaba en eumelanina y feomelanina. Sin embargo, en 1955 se descubrió una melanina asociada a las células nerviosas, la neuromelanina, y en 1972 una forma soluble en agua, la piomelanina. En 1976, se encontró en la naturaleza la alomelanina, la quinta forma de las melaninas. [2]
Es posible enriquecer la melanina con selenio en lugar de azufre . Este análogo de selenio de la feomelanina se ha sintetizado con éxito mediante rutas químicas y biosintéticas utilizando selenocistina como materia prima. [14] Debido al mayor número atómico del selenio, se puede esperar que la selenomelanina obtenida proporcione una mejor protección contra la radiación ionizante en comparación con otras formas conocidas de melanina. Esta protección ha quedado demostrada con experimentos de radiación en células y bacterias humanas, lo que abre la posibilidad de aplicaciones en los viajes espaciales. [15]
Los tricocromos (anteriormente llamados tricosiderinas) son pigmentos producidos a partir de la misma vía metabólica que las eumelaninas y feomelaninas, pero a diferencia de esas moléculas, tienen un peso molecular bajo. Ocurren en algunos cabellos humanos rojos. [dieciséis]

En los humanos, la melanina es el principal determinante del color de la piel . También se encuentra en el cabello, el tejido pigmentado subyacente al iris del ojo y la estría vascular del oído interno . En el cerebro, los tejidos con melanina incluyen la médula y las neuronas portadoras de pigmentos dentro de áreas del tronco encefálico , como el locus coeruleus . También ocurre en la zona reticular de la glándula suprarrenal . [17]
La melanina de la piel es producida por los melanocitos , que se encuentran en la capa basal de la epidermis . Aunque, en general, los seres humanos poseen una concentración similar de melanocitos en la piel, los melanocitos de algunos individuos y grupos étnicos producen cantidades variables de melanina. Algunos humanos tienen muy poca o ninguna síntesis de melanina en sus cuerpos, una condición conocida como albinismo . [18]
Debido a que la melanina es un agregado de moléculas componentes más pequeñas, existen muchos tipos diferentes de melanina con diferentes proporciones y patrones de unión de estas moléculas componentes. Tanto la feomelanina como la eumelanina se encuentran en la piel y el cabello humanos, pero la eumelanina es la melanina más abundante en los humanos, así como la forma con mayor probabilidad de ser deficiente en el albinismo. [19]
Las melaninas tienen roles y funciones muy diversas en varios organismos. Una forma de melanina constituye la tinta utilizada por muchos cefalópodos (ver tinta de cefalópodos ) como mecanismo de defensa contra los depredadores. Las melaninas también protegen a los microorganismos, como bacterias y hongos, contra el estrés que implica daño celular, como la radiación ultravioleta del sol y las especies reactivas de oxígeno . La melanina también protege contra el daño causado por las altas temperaturas, el estrés químico (como los metales pesados y los agentes oxidantes ) y las amenazas bioquímicas (como las defensas del huésped contra los microbios invasores). [20] Por lo tanto, en muchos microbios patógenos (por ejemplo, en Cryptococcus neoformans , un hongo), las melaninas parecen desempeñar funciones importantes en la virulencia y la patogenicidad al proteger al microbio contra las respuestas inmunes de su huésped . En los invertebrados, un aspecto importante del sistema inmunológico innato de defensa contra patógenos invasores implica la melanina. Minutos después de la infección, el microbio queda encapsulado dentro de melanina (melanización) y se cree que la generación de subproductos de radicales libres durante la formación de esta cápsula ayuda a matarlos. [21] Algunos tipos de hongos, llamados hongos radiotróficos , parecen ser capaces de utilizar la melanina como pigmento fotosintético que les permite capturar rayos gamma [22] y aprovechar esta energía para el crecimiento. [23]
En los peces , la melanina se encuentra no sólo en la piel sino también en órganos internos como los ojos. La mayoría de las especies de peces usan eumelanina, [24] [25] pero Stegastes apicalis y Cyprinus carpio usan feomelanina en su lugar. [26] [27]
Las plumas más oscuras de las aves deben su color a la melanina y las bacterias las degradan menos fácilmente que las que no están pigmentadas o las que contienen pigmentos carotenoides . [28] Las plumas que contienen melanina también son un 39% más resistentes a la abrasión que aquellas que no la contienen porque los gránulos de melanina ayudan a llenar el espacio entre las hebras de queratina que forman las plumas. [29] [30] La síntesis de feomelanina en aves implica el consumo de cisteína, un aminoácido semiesencial que es necesario para la síntesis del antioxidante glutatión (GSH), pero que puede ser tóxico si se encuentra en exceso en la dieta. De hecho, muchas aves carnívoras, que tienen un alto contenido de proteínas en su dieta, exhiben una coloración basada en feomelanina. [31]
La melanina también es importante en la pigmentación de los mamíferos . [32] El patrón del pelaje de los mamíferos está determinado por el gen agouti que regula la distribución de la melanina. [33] [34] Los mecanismos del gen se han estudiado ampliamente en ratones para proporcionar una idea de la diversidad de los patrones del pelaje de los mamíferos. [35]
Se ha observado que la melanina en los artrópodos se deposita en capas, produciendo así un reflector de Bragg de índice de refracción alterno. Cuando la escala de este patrón coincide con la longitud de onda de la luz visible, surge una coloración estructural : dando a varias especies un color iridiscente . [36] [37]
Los arácnidos son uno de los pocos grupos en los que la melanina no se ha detectado fácilmente, aunque los investigadores encontraron datos que sugieren que las arañas, de hecho, producen melanina. [38]
Algunas especies de polillas, incluida la polilla tigre de la madera , convierten los recursos en melanina para mejorar su termorregulación. Como la polilla tigre de la madera tiene poblaciones en una amplia gama de latitudes, se ha observado que las poblaciones más septentrionales mostraron tasas más altas de melanización. En los fenotipos masculinos amarillos y blancos de la polilla tigre de madera, los individuos con más melanina tenían una mayor capacidad para atrapar el calor, pero una mayor tasa de depredación debido a una señal aposemática más débil y menos efectiva . [39]
La melanina protege a las moscas y ratones Drosophila contra el daño del ADN causado por la radiación no ultravioleta. [40] Estudios importantes en modelos de Drosophila incluyen Hopwood et al. , 1985. [40] Gran parte de nuestro conocimiento sobre los efectos radioprotectores de la melanina contra la radiación gamma proviene de los laboratorios y grupos de investigación de Irma Mosse. [41] [42] [43] [44] [45] [46] [47] : 1151 Mosse se inició en la radiobiología en la era soviética, recibió cada vez más apoyo financiero del gobierno a raíz del descubrimiento de microbios radiotróficos en Chernobyl , y a partir de 2022 continúa bajo el control del Instituto Bielorruso de Genética y Citología. [46] Su contribución más significativa es Mosse et al. , 2000 en ratones [41] [42] [43] [44] [45] [46] [47] : 1151 pero también incluye a Mosse et al. , 1994, [45] Mosse et al. , 1997, [45] Mosse et al. , 1998, [44] Mosse et al. , 2001, [45] Mosse et al. , 2002, [44] [45] Mosse et al. , 2006, [44] [45] Mosse et al. , 2007 [45] y Mosse et al. , 2008. [45][actualizar]

La melanina producida por las plantas a veces se denomina "melaninas de catecol", ya que pueden producir catecol en fusión alcalina. Se observa comúnmente en el pardeamiento enzimático de frutas como los plátanos. La melanina de la cáscara de castaña se puede utilizar como antioxidante y colorante. [48] La biosíntesis implica la oxidación de la indol-5,6-quinona por la polifenol oxidasa de tipo tirosinasa a partir de tirosina y catecolaminas , lo que conduce a la formación de catecol melanina. A pesar de esto, muchas plantas contienen compuestos que inhiben la producción de melaninas. [49]
Ahora se entiende que las melaninas no tienen una estructura ni estequiometría única. [ cita necesaria ] No obstante, las bases de datos químicas como PubChem incluyen fórmulas estructurales y empíricas; típicamente 3,8-dimetil-2,7-dihidrobenzo[1,2,3- cd :4,5,6- c′d ′ ] diindol-4,5,9,10-tetrona . Se puede considerar como un monómero único que explica la composición elemental medida y algunas propiedades de la melanina, pero es poco probable que se encuentre en la naturaleza. [50] Solano [50] afirma que esta tendencia engañosa se deriva de un informe de una fórmula empírica en 1948, [51] pero no proporciona ningún otro detalle histórico.
El primer paso de la vía biosintética tanto para las eumelaninas como para las feomelaninas está catalizado por la tirosinasa . [52]
La dopaquinona puede combinarse con la cisteína por dos vías hacia las benzotiazinas y las feomelaninas.
Además, la dopaquinona se puede convertir en leucodopacromo y seguir dos vías más hacia las eumelaninas.
Las rutas metabólicas detalladas se pueden encontrar en la base de datos KEGG (ver enlaces externos).
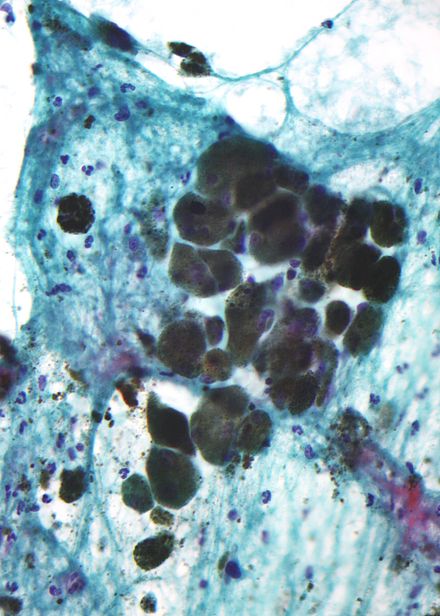
La melanina es marrón, no refractable y finamente granular con gránulos individuales que tienen un diámetro de menos de 800 nanómetros. Esto diferencia la melanina de los pigmentos comunes de descomposición de la sangre , que son más grandes, gruesos y refráctiles, y su color varía del verde al amarillo o al marrón rojizo. En lesiones muy pigmentadas, los agregados densos de melanina pueden oscurecer los detalles histológicos. Una solución diluida de permanganato de potasio es un blanqueador de melanina eficaz. [53]
Existen aproximadamente nueve tipos de albinismo oculocutáneo , que es en su mayoría un trastorno autosómico recesivo. Ciertas etnias tienen mayor incidencia de diferentes formas. Por ejemplo, el tipo más común, llamado albinismo oculocutáneo tipo 2 (OCA2), es especialmente frecuente entre personas de ascendencia africana negra y europeos blancos. Las personas con OCA2 suelen tener la piel clara, pero a menudo no son tan pálidas como las de OCA1. Ellos (¿OCA2 u OCA1? Ver comentarios en Historia) tienen cabello de rubio pálido a dorado, rubio fresa o incluso castaño, y más comúnmente ojos azules. Entre el 98,7% y el 100% de los europeos modernos son portadores del alelo derivado SLC24A5 , una causa conocida de albinismo oculocutáneo no sindrómico. Es un trastorno autosómico recesivo caracterizado por una reducción o ausencia congénita del pigmento melanina en la piel, el cabello y los ojos. La frecuencia estimada de OCA2 entre los afroamericanos es de 1 en 10.000, lo que contrasta con una frecuencia de 1 en 36.000 en los estadounidenses blancos. [54] En algunas naciones africanas, la frecuencia del trastorno es aún mayor, oscilando entre 1 en 2.000 y 1 en 5.000. [55] Otra forma de albinismo, el "albinismo oculocutáneo amarillo", parece ser más frecuente entre los Amish , que son de ascendencia principalmente suiza y alemana. Las personas con esta variante IB del trastorno suelen tener pelo y piel blancos al nacer, pero desarrollan rápidamente una pigmentación cutánea normal en la infancia. [55]
El albinismo ocular afecta no sólo a la pigmentación de los ojos sino también a la agudeza visual. Las personas con albinismo suelen tener resultados deficientes, dentro del rango de 20/60 a 20/400. Además, dos formas de albinismo, con aproximadamente 1 de cada 2,700 más prevalentes entre personas de origen puertorriqueño, se asocian con mortalidad más allá de las muertes relacionadas con el melanoma.
La conexión entre el albinismo y la sordera es bien conocida, aunque poco comprendida. En su tratado de 1859 Sobre el origen de las especies , Charles Darwin observó que "los gatos que son completamente blancos y tienen ojos azules son generalmente sordos". [56] En los seres humanos, la hipopigmentación y la sordera ocurren juntas en el raro síndrome de Waardenburg , observado predominantemente entre los Hopi en América del Norte. [57] La incidencia de albinismo en los indios Hopi se ha estimado en aproximadamente 1 de cada 200 personas. Se han encontrado patrones similares de albinismo y sordera en otros mamíferos, incluidos perros y roedores. Sin embargo, la falta de melanina per se no parece ser directamente responsable de la sordera asociada con la hipopigmentación, ya que la mayoría de las personas que carecen de las enzimas necesarias para sintetizar melanina tienen una función auditiva normal. [58] En cambio, la ausencia de melanocitos en la estría vascular del oído interno da como resultado un deterioro coclear , [59] aunque no se comprende completamente por qué ocurre esto.
En la enfermedad de Parkinson, un trastorno que afecta el funcionamiento neuromotor , hay una disminución de la neuromelanina en la sustancia negra y el locus coeruleus como consecuencia de la pérdida específica de neuronas pigmentadas dopaminérgicas y noradrenérgicas. Esto da como resultado una disminución de la síntesis de dopamina y norepinefrina . Si bien no se ha informado ninguna correlación entre la raza y el nivel de neuromelanina en la sustancia negra, la incidencia significativamente menor de Parkinson en negros que en blancos ha "incitado a algunos a sugerir que la melanina cutánea podría de alguna manera servir para proteger la neuromelanina en la sustancia negra". nigra de toxinas externas." [60]
Además de la deficiencia de melanina, el peso molecular del polímero de melanina puede verse disminuido por varios factores como el estrés oxidativo, la exposición a la luz, la perturbación en su asociación con las proteínas de la matriz melanosomal , los cambios en el pH o en las concentraciones locales de iones metálicos. Se ha propuesto una disminución del peso molecular o una disminución en el grado de polimerización de la melanina ocular para convertir el polímero normalmente antioxidante en un prooxidante . En su estado prooxidante, se ha sugerido que la melanina está involucrada en la causa y progresión de la degeneración macular y el melanoma . [61] La rasagilina , un importante fármaco en monoterapia en la enfermedad de Parkinson, tiene propiedades de unión a la melanina y propiedades reductoras del tumor de melanoma. [62]
Sin embargo, los niveles más altos de eumelanina también pueden ser una desventaja, más allá de una mayor predisposición a la deficiencia de vitamina D. La piel oscura es un factor que complica la eliminación con láser de manchas de vino de Oporto . Eficaces en el tratamiento de la piel blanca, en general, los láseres tienen menos éxito para eliminar las manchas de vino de Oporto en personas de ascendencia asiática o africana. Las concentraciones más altas de melanina en personas de piel más oscura simplemente difunden y absorben la radiación láser, inhibiendo la absorción de luz por parte del tejido objetivo. De manera similar, la melanina puede complicar el tratamiento con láser de otras afecciones dermatológicas en personas de piel más oscura.
Las pecas y los lunares se forman donde hay una concentración localizada de melanina en la piel. Están muy asociados con la piel pálida.
La nicotina tiene afinidad por los tejidos que contienen melanina debido a su función precursora en la síntesis de melanina o su unión irreversible a la melanina. Se ha sugerido que esto es la base de la mayor dependencia de la nicotina y las menores tasas de abandono del hábito de fumar en personas con pigmentación más oscura. [63]
Los melanocitos insertan gránulos de melanina en vesículas celulares especializadas llamadas melanosomas . Luego se transfieren a las células queratinocíticas de la epidermis humana . Los melanosomas de cada célula receptora se acumulan encima del núcleo celular , donde protegen el ADN nuclear de las mutaciones provocadas por la radiación ionizante de los rayos ultravioleta del sol . En general, las personas cuyos antepasados vivieron durante largos períodos en las regiones del globo cercanas al ecuador tienen mayores cantidades de eumelanina en la piel. Esto hace que su piel sea marrón o negra y los protege contra altos niveles de exposición al sol, que resultan con mayor frecuencia en melanomas en personas de piel más clara. [64]
No todos los efectos de la pigmentación son ventajosos. La pigmentación aumenta la carga de calor en climas cálidos, y las personas de piel oscura absorben un 30% más de calor de la luz solar que las personas de piel muy clara, aunque este factor puede compensarse con una sudoración más profusa. En climas fríos la piel oscura conlleva una mayor pérdida de calor por radiación. La pigmentación también dificulta la síntesis de vitamina D. Dado que la pigmentación no parece ser del todo beneficiosa para la vida en los trópicos, se han propuesto otras hipótesis sobre su importancia biológica, por ejemplo, un fenómeno secundario inducido por la adaptación a parásitos y enfermedades tropicales. [sesenta y cinco]
Los primeros humanos desarrollaron un color de piel oscuro, como una adaptación a la pérdida de vello corporal que aumentaba los efectos de la radiación ultravioleta. Antes del desarrollo de la falta de pelo, los primeros humanos podrían haber tenido piel clara debajo del pelaje, similar a la que se encuentra en otros primates . [66] Los humanos anatómicamente modernos evolucionaron en África hace entre 200.000 y 100.000 años, [67] y luego poblaron el resto del mundo a través de migraciones hace entre 80.000 y 50.000 años, cruzándose en algunas áreas con ciertas especies humanas arcaicas ( neandertales , denisovanos , y posiblemente otros). [68] Los primeros humanos modernos tenían la piel más oscura que los pueblos indígenas de África en la actualidad. Después de la migración y el asentamiento en Asia y Europa, la presión selectiva de la radiación ultravioleta oscura que protegía la piel disminuyó donde la radiación del sol era menos intensa. Esto dio como resultado la gama actual de colores de piel humana. De las dos variantes genéticas comunes que se sabe que están asociadas con la piel humana pálida, Mc1r no parece haber sido sometida a una selección positiva, [69] mientras que SLC24A5 sí ha sido sometida a una selección positiva. [70]
Al igual que los pueblos que emigraron hacia el norte, aquellos de piel clara que migraron hacia el ecuador se aclimatan a la radiación solar mucho más fuerte. La naturaleza selecciona menos melanina cuando la radiación ultravioleta es débil. La piel de la mayoría de las personas se oscurece cuando se expone a la luz ultravioleta, lo que les brinda más protección cuando es necesaria. Éste es el propósito fisiológico del bronceado . Las personas de piel oscura, que producen más eumelanina, que protege la piel, tienen una mayor protección contra las quemaduras solares y el desarrollo de melanoma, una forma potencialmente mortal de cáncer de piel, así como otros problemas de salud relacionados con la exposición a fuertes radiaciones solares , incluida la fotodegradación. de ciertas vitaminas como riboflavinas , carotenoides , tocoferol y folato . [71]
La melanina en los ojos, en el iris y la coroides , ayuda a protegerlos de la luz ultravioleta y visible de alta frecuencia ; Las personas con ojos grises, azules y verdes tienen mayor riesgo de sufrir problemas oculares relacionados con el sol. Además, la lente ocular se vuelve amarilla con la edad, lo que proporciona protección adicional. Sin embargo, la lente también se vuelve más rígida con la edad, perdiendo la mayor parte de su acomodación (la capacidad de cambiar de forma para enfocar de lejos a cerca), un detrimento debido probablemente a la reticulación de proteínas causada por la exposición a los rayos UV.
Investigaciones recientes sugieren que la melanina puede desempeñar una función protectora distinta de la fotoprotección. [72] La melanina es capaz de quelar eficazmente iones metálicos a través de sus grupos carboxilato e hidroxilo fenólico, en muchos casos mucho más eficientemente que el poderoso ligando quelante etilendiaminotetraacetato (EDTA). Por tanto, puede servir para secuestrar iones metálicos potencialmente tóxicos, protegiendo el resto de la célula. Esta hipótesis se ve respaldada por el hecho de que la pérdida de neuromelanina observada en la enfermedad de Parkinson va acompañada de un aumento de los niveles de hierro en el cerebro.
Existe evidencia que respalda la existencia de un heteropolímero altamente reticulado unido covalentemente a melanoproteínas que estructuran la matriz. [73] Se ha propuesto que la capacidad de la melanina para actuar como antioxidante es directamente proporcional a su grado de polimerización o peso molecular . [74] Las condiciones subóptimas para la polimerización eficaz de los monómeros de melanina pueden conducir a la formación de melanina prooxidante de menor peso molecular que se ha implicado en la causa y progresión de la degeneración macular y el melanoma . [75] Las vías de señalización que regulan positivamente la melanización en el epitelio pigmentario de la retina (EPR) también pueden estar implicadas en la regulación negativa de la fagocitosis del segmento externo de los bastones por parte del EPR. Este fenómeno se ha atribuido en parte a la conservación de la fóvea en la degeneración macular . [76]
La investigación realizada por el equipo de Sarna demostró que las células de melanoma muy pigmentadas tienen un módulo de Young de aproximadamente 4,93 kPa, mientras que en las no pigmentadas es de sólo 0,98 kPa. [77] En otro experimento descubrieron que la elasticidad de las células del melanoma es importante para su metástasis y crecimiento: los tumores no pigmentados eran más grandes que los pigmentados y les resultaba mucho más fácil propagarse. También demostraron que en los tumores de melanoma hay células pigmentadas y no pigmentadas , por lo que pueden ser tanto resistentes a los medicamentos como metastásicos. [77]