La mejora genética humana o ingeniería genética humana se refiere a la mejora humana mediante una modificación genética . Esto podría hacerse con el fin de curar enfermedades ( terapia génica ), prevenir la posibilidad de contraer una enfermedad en particular [1] (de manera similar a las vacunas), mejorar el rendimiento de los atletas en eventos deportivos ( dopaje genético ) o cambiar la apariencia física, el metabolismo e incluso mejorar las capacidades físicas y las facultades mentales como la memoria y la inteligencia. Estas mejoras genéticas pueden o no realizarse de tal manera que el cambio sea hereditario (lo que ha suscitado inquietudes dentro de la comunidad científica). [2]
La genética es el estudio de los genes y los rasgos hereditarios y, si bien los avances en curso en este campo han dado como resultado el avance de la atención médica en múltiples niveles, las consideraciones éticas se han vuelto cada vez más cruciales, especialmente junto con la ingeniería genética. [3] Si bien los avances tecnológicos en este campo presentan perspectivas emocionantes para la mejora biomédica, también impulsan la necesidad de evaluaciones éticas, sociales y prácticas para comprender su impacto en la biología humana, la evolución y el medio ambiente. [4] Las pruebas genéticas , la ingeniería genética y la investigación con células madre a menudo se discuten juntas debido a los argumentos morales interrelacionados que rodean estos temas. La distinción entre reparar genes y mejorar genes es una idea central en muchos debates morales en torno a la mejora genética porque algunos argumentan que reparar genes es moralmente permisible, pero que la mejora genética no lo es debido a su potencial para conducir a la injusticia social a través de iniciativas eugenésicas discriminatorias. [5]
Las cuestiones morales relacionadas con las pruebas genéticas a menudo están relacionadas con el deber de advertir a los miembros de la familia si se descubre un trastorno hereditario, cómo los médicos deben gestionar la autonomía y la confidencialidad del paciente con respecto a las pruebas genéticas, la ética de la discriminación genética y la permisibilidad moral de utilizar pruebas genéticas para evitar causar la existencia de personas gravemente discapacitadas, como a través del aborto selectivo. [5] [6] [7]
La responsabilidad de los profesionales de la salud pública es determinar las posibles exposiciones y sugerir pruebas para detectar enfermedades transmisibles que requieran notificación. Los profesionales de la salud pública pueden encontrarse con problemas de divulgación si la ampliación de la detección obligatoria da lugar a que las anomalías genéticas se clasifiquen como afecciones notificables. [8] Los datos genéticos son personales y están estrechamente vinculados a la identidad de una persona. La confidencialidad no solo afecta al trabajo, la atención sanitaria y la cobertura de seguros, sino que también puede afectar a los resultados de las pruebas genéticas de toda una familia. Las personas afectadas también pueden tener a sus padres, hijos, hermanos, hermanas e incluso parientes lejanos si la enfermedad es genéticamente dominante o la portan ellos. Además, las decisiones de una persona podrían cambiar toda su vida dependiendo del resultado de una prueba genética. Es posible que los resultados de las pruebas genéticas deban divulgarse en todas las facetas de la vida de una persona. [8] [9]
Las pruebas prenatales no invasivas (NIPT, por sus siglas en inglés) tienen la capacidad de determinar con precisión el sexo del feto en una etapa temprana de la gestación, lo que genera inquietudes sobre la posible facilitación de la interrupción del embarazo selectiva por sexo (TOP, por sus siglas en inglés) debido a su facilidad, tiempo y precisión. Si bien la tecnología de ultrasonido tiene la capacidad de hacer lo mismo, las NIPT se están explorando recientemente debido a su capacidad para identificar con precisión el sexo del feto en una etapa temprana del embarazo, que se puede lograr con una precisión cada vez mayor ya a las 7 semanas de gestación. Este período de tiempo precede al tiempo típico para otras técnicas de determinación del sexo, como la ecografía o el muestreo de vellosidades coriónicas (CVS, por sus siglas en inglés). [10] [11] La alta precisión temprana de las NIPT reduce la incertidumbre asociada con otros métodos, como los mencionados anteriormente, lo que conduce a decisiones más informadas y elimina el riesgo de resultados inexactos que podrían influir en la toma de decisiones con respecto a la interrupción del embarazo selectiva por sexo. Además, las NIPT permiten la interrupción del embarazo selectiva por sexo en el primer trimestre, lo que es más práctico y permite a las mujeres embarazadas posponer el vínculo materno-fetal. Estas consideraciones pueden facilitar considerablemente la búsqueda de una TOP selectiva por sexo cuando se utiliza la NIPT. Por lo tanto, es fundamental examinar estas cuestiones éticas en el marco de la adopción de la NIPT. [12]
Las cuestiones éticas relacionadas con la terapia genética y el mejoramiento genético humano se refieren a los riesgos y beneficios médicos de la terapia, el deber de utilizar los procedimientos para prevenir el sufrimiento, la libertad reproductiva en las elecciones genéticas y la moralidad de la práctica de la genética positiva, que incluye los intentos de mejorar las funciones normales. [5]
En todo estudio genético que se realice para la humanidad, los estudios deben realizarse de acuerdo con la declaración de aprobación del comité de ética, las normas éticas y legales y la moralidad humana. La terapia con células T CAR, que se pretende que sea un nuevo tratamiento, tiene como objetivo cambiar la genética de las células T y transformar las células del sistema inmunológico que no reconocen el cáncer en células que lo reconocen y lo combaten. Funciona con el método de terapia con células T que se organiza con repeticiones palindrómicas en ciertos intervalos cortos llamados con CRISPR. [13]
Toda investigación que involucre a sujetos humanos en entornos de atención médica debe registrarse en una base de datos pública antes del reclutamiento del primer ensayo. La declaración de consentimiento informado debe incluir información adecuada sobre posibles conflictos de intereses, los beneficios esperados del estudio, sus riesgos potenciales y otras cuestiones relacionadas con las molestias que pueda implicar. [14]
Los avances tecnológicos desempeñan un papel fundamental en las nuevas formas de mejora humana. Si bien las intervenciones fenotípicas y somáticas para la mejora humana plantean dilemas éticos y sociológicos importantes, la intervención genética hereditaria de la línea germinal requiere deliberaciones aún más exhaustivas a nivel individual y social. [15]
Los juicios morales tienen una base empírica y suponen la evaluación de posibles relaciones riesgo-beneficio, en particular en el campo de la biomedicina. La tecnología de edición genómica mediante CRISPR plantea cuestiones éticas por varias razones. Para ser más específicos, existen preocupaciones con respecto a las capacidades y limitaciones tecnológicas de la tecnología CRISPR. Además, los efectos a largo plazo de los organismos alterados y la posibilidad de que los genes editados se transmitan a las generaciones siguientes y tengan efectos imprevistos son otras dos cuestiones que deben tenerse en cuenta. La toma de decisiones sobre la moralidad se vuelve más difícil cuando la incertidumbre derivada de estas circunstancias impide realizar evaluaciones adecuadas de los riesgos y beneficios. [16]
Los beneficios potenciales de herramientas revolucionarias como CRISPR son infinitos. Por ejemplo, debido a que se puede aplicar directamente en el embrión, CRISPR/Cas9 reduce el tiempo necesario para modificar genes diana en comparación con las tecnologías de selección de genes que se basan en el uso de células madre embrionarias (ES). Las herramientas bioinformáticas desarrolladas para identificar las secuencias óptimas para diseñar ARN guía y optimizar las condiciones experimentales han proporcionado procedimientos muy robustos que garantizan la introducción exitosa de la mutación deseada. [17] Es probable que se desarrollen importantes beneficios a partir del uso de HGGM seguro y eficaz, lo que hace que una postura precautoria contra HGGM sea poco ética. [18]
En el futuro, muchas personas apoyarían la creación de una organización que brindara orientación sobre la mejor manera de controlar las complejidades éticas mencionadas anteriormente. Recientemente, un grupo de científicos fundó la Asociación para la Investigación Responsable y la Innovación en Edición Genómica (ARRIGE, por sus siglas en inglés) para estudiar y brindar orientación sobre el uso ético de la edición genómica. [19] [20]
Además, Janasoff y Hurlbut han abogado recientemente por el establecimiento y desarrollo internacional de un "observatorio global interdisciplinario para la regulación genética". [21]
Los investigadores propusieron que los debates sobre la edición genética no deberían estar controlados por la comunidad científica. Se prevé que la red se centre en recopilar información de fuentes dispersas, sacar a la luz perspectivas que a menudo se pasan por alto y fomentar el intercambio entre disciplinas y culturas. [22]
Se hace hincapié en que las intervenciones destinadas a mejorar los rasgos humanos desde una perspectiva genética dependen de la comprensión de la ingeniería genética, y la comprensión de los resultados de estas intervenciones requiere una comprensión de las interacciones entre los seres humanos y otros seres vivos. Por lo tanto, la regulación de la ingeniería genética subraya la importancia de examinar el conocimiento entre los seres humanos y el medio ambiente. [15]
Para hacer frente a los desafíos éticos y las incertidumbres que surgen de los avances genéticos, se ha hecho hincapié en que es esencial desarrollar directrices integrales basadas en principios universales. Se ha puesto de relieve la importancia de adoptar un enfoque cauteloso para salvaguardar valores fundamentales como la autonomía, el bienestar global y la dignidad individual a la hora de superar estos desafíos. [23]
Al considerar la mejora genética, las tecnologías genéticas deben abordarse desde una perspectiva amplia, utilizando una definición que abarque no sólo la manipulación genética directa sino también las tecnologías indirectas como los fármacos biosintéticos. Se ha hecho hincapié en que se debe prestar atención a las expectativas que pueden dar forma a la comercialización y la disponibilidad de estas tecnologías, anticipándose al atractivo de los nuevos tratamientos. Se ha señalado que estas expectativas pueden significar el estímulo de políticas públicas adecuadas y regulaciones profesionales eficaces. [24]
La investigación clínica con células madre debe realizarse de conformidad con valores éticos. Esto implica un pleno respeto por los principios éticos, incluida la evaluación precisa del equilibrio entre riesgos y beneficios, así como la obtención del consentimiento informado y voluntario de los participantes. Se debe fortalecer el diseño de la investigación, se deben coordinar eficazmente las revisiones científicas y éticas, se debe garantizar que los participantes comprendan las características fundamentales de la investigación y se ha abordado el pleno cumplimiento de los requisitos éticos adicionales para la divulgación de resultados negativos. [25]
Se ha hecho hincapié en que los médicos deben comprender el papel de la medicina genómica para diagnosticar con precisión a los pacientes y orientar las decisiones de tratamiento. Se ha destacado que la información clínica detallada y las opiniones de expertos son cruciales para la interpretación precisa de las variantes genéticas. Si bien las aplicaciones de la medicina personalizada son interesantes, se ha señalado que el impacto y la base de evidencia de cada intervención deben evaluarse cuidadosamente. El genoma humano contiene millones de variantes genéticas, por lo que se debe tener precaución y buscar opiniones de expertos al analizar los resultados genómicos. [26]
Con el descubrimiento de varios tipos de trastornos relacionados con el sistema inmunitario, existe la necesidad de diversificar la prevención y el tratamiento. Se están estudiando los avances en el campo de la terapia génica para incluirlos en el alcance de este tratamiento, pero, por supuesto, se necesita más investigación para aumentar los resultados positivos y minimizar los efectos negativos de las aplicaciones de la terapia génica. [27] El sistema CRISPR/Cas9 también está diseñado como una tecnología de edición genética para el tratamiento del VIH-1/SIDA. CRISPR/Cas9 se ha desarrollado como la última técnica de edición genética que permite la inserción, eliminación y modificación de secuencias de ADN y proporciona ventajas en la interrupción del virus VIH-1 latente. Sin embargo, la producción de algunos vectores para células infectadas por el VIH-1 aún es limitada y se necesitan más estudios [28] Ser portador del VIH también juega un papel importante en la incidencia del cáncer de cuello uterino. Si bien hay muchos factores personales y biológicos que contribuyen al desarrollo del cáncer de cuello uterino, la portación del VIH está correlacionada con su aparición. Sin embargo, la investigación a largo plazo sobre la eficacia del tratamiento preventivo aún está en curso. La educación temprana, accesible en todo el mundo, desempeñará un papel importante en la prevención. [29] Cuando se cumplen sistemáticamente los medicamentos y los métodos de tratamiento, se mantienen las prácticas sexuales seguras y se implementan cambios saludables en el estilo de vida, se reduce el riesgo de transmisión en la mayoría de las personas que viven con el VIH. Las estrategias de prevención proactivas implementadas sistemáticamente pueden reducir significativamente la incidencia de las infecciones por VIH. La educación sobre prácticas sexuales seguras y cambios para reducir el riesgo para todos, sean portadores del VIH o no, es fundamental para prevenir la enfermedad. [30] Sin embargo, controlar la epidemia del VIH y eliminar el estigma asociado con la enfermedad puede no ser posible solo mediante una campaña general de concienciación sobre el SIDA. Se observa que la concienciación sobre el VIH, especialmente entre las personas de regiones socioeconómicas bajas, es considerablemente menor que en la población general. Aunque no existe una solución clara para prevenir la transmisión del VIH y la propagación de la enfermedad a través de la transmisión sexual, una combinación de medidas preventivas puede ayudar a controlar la propagación del VIH. Aumentar el conocimiento y la concienciación desempeña un papel importante en la prevención de la propagación del VIH al contribuir a la mejora de las decisiones conductuales con alta percepción del riesgo. [31] La genética desempeña un papel fundamental en la prevención de enfermedades, ya que ofrece información sobre la predisposición de un individuo a determinadas enfermedades y allana el camino para estrategias personalizadas para mitigar el riesgo de contraer enfermedades. El floreciente campo de las pruebas y análisis genéticos ha proporcionado herramientas valiosas para identificar marcadores genéticos asociados con diversas enfermedades, lo que permite tomar medidas proactivas para prevenirlas [32]La prevención de enfermedades mediante pruebas genéticas es más sencilla, ya que las pruebas genéticas pueden revelar la susceptibilidad genética de un individuo a ciertas enfermedades, lo que permite la detección temprana y la intervención que puede ser muy crucial en enfermedades como los cánceres hereditarios, como el cáncer de mama [33] [34] y el cáncer de ovario. [35] [36] Tener información genética puede informar el desarrollo de enfoques de medicina de precisión y terapias dirigidas para la prevención de enfermedades en general. Al identificar los factores genéticos que contribuyen a la susceptibilidad a las enfermedades, como las mutaciones genéticas específicas asociadas con los trastornos autoinmunes, los investigadores pueden desarrollar terapias dirigidas para modular la respuesta inmunitaria y prevenir la aparición o progresión de estas afecciones. [37] [38] [39]
Existen muchos tipos de enfermedades neurodegenerativas. La enfermedad de Alzheimer es una de las más comunes y afecta a millones de personas en todo el mundo. Las técnicas CRISPR-Cas9 se pueden utilizar para prevenir la enfermedad de Alzheimer. Por ejemplo, tiene el potencial de corregir las mutaciones autosómicas dominantes, las neuronas problemáticas, restaurar los déficits electrofisiológicos asociados y disminuir los péptidos Aβ. [40] La esclerosis lateral amiotrófica (ELA) es otra enfermedad neurodegenerativa altamente letal. Y la tecnología CRISPR-Cas9 es simple y efectiva para cambiar mutaciones puntuales específicas sobre la ELA. Además, con esta tecnología, Chen y sus colegas encontraron algunas alteraciones importantes en los principales indicadores de la ELA, como la disminución de los focos de ARN, los polipéptidos y la haplosuficiencia. [41] [40]
Algunas personas sufren inmunodepresión , una condición en la que sus sistemas inmunológicos se debilitan y son menos efectivos para defenderse contra diversas enfermedades, incluidas, entre otras, la influenza . Esta susceptibilidad a las infecciones se puede atribuir a una variedad de factores, incluidos defectos genéticos y enfermedades genéticas como la inmunodeficiencia combinada grave (SCID). Ya se han desarrollado o se están desarrollando algunas terapias genéticas para corregir estos defectos/enfermedades genéticas, haciendo así que estas personas sean menos susceptibles a contraer enfermedades adicionales (es decir, influenza). [42] Estos defectos y enfermedades genéticas pueden afectar significativamente la capacidad del cuerpo para generar una respuesta inmune efectiva, dejando a las personas vulnerables a una amplia gama de patógenos. Sin embargo, los avances en la investigación y el desarrollo de la terapia genética han demostrado un potencial prometedor para abordar estas deficiencias genéticas, aunque no sin desafíos asociados [43] [44]
La tecnología CRISPR es una herramienta prometedora no solo para la corrección de enfermedades genéticas, sino también para la prevención de infecciones virales y bacterianas. Utilizando terapias CRISPR-Cas, los investigadores han atacado infecciones virales como HSV-1, EBV, HIV-1, HBV, HPV y HCV, con ensayos clínicos en curso para una estrategia de eliminación del VIH llamada EBT-101 . Además, CRISPR ha demostrado eficacia en la prevención de infecciones virales como IAV y SARS-CoV-2 al atacar genomas de ARN viral con Cas13d, y se ha utilizado para sensibilizar a S. aureus resistente a antibióticos al tratamiento a través de Cas9 administrado a través de bacteriófagos. [45]
Los avances en la edición y la terapia génica son prometedores para la prevención de enfermedades al abordar los factores genéticos asociados con ciertas afecciones. Técnicas como CRISPR-Cas9 ofrecen el potencial de corregir mutaciones genéticas asociadas con enfermedades hereditarias, previniendo así su manifestación en generaciones futuras y reduciendo la carga de enfermedades. En noviembre de 2018, se crearon Lulu y Nana . [46] Mediante el uso de repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas (CRISPR)-Cas9, una técnica de edición genética, desactivaron un gen llamado CCR5 en los embriones, con el objetivo de cerrar la puerta de entrada de proteínas que permite que el VIH ingrese a una célula y haga que los sujetos sean inmunes al virus del VIH.
A pesar de la evidencia existente sobre la tecnología CRISPR, los avances en este campo siguen reduciendo las limitaciones. Los investigadores desarrollaron un nuevo método de edición genética suave para embriones utilizando nanopartículas y ácidos nucleicos peptídicos. Al proporcionar herramientas de edición sin inyecciones agresivas, el método corrigió con éxito genes en ratones sin perjudicar el desarrollo. Si bien quedan cuestiones éticas y técnicas, este estudio allana el camino para un posible uso futuro en la mejora del ganado y los animales de investigación, y tal vez incluso en embriones humanos para la prevención o terapia de enfermedades. [47]
Es fundamental informar a los futuros padres sobre su susceptibilidad a las enfermedades genéticas. El diagnóstico genético preimplantacional también tiene importancia para la prevención de enfermedades hereditarias, ya que la amplificación y el análisis del genoma completo ayudan a seleccionar un embrión sano para la implantación, lo que previene la transmisión de un trastorno metabólico fatal en la familia. [48]
La mejora genética humana surge como una posible frontera en la prevención de enfermedades al actuar con precisión sobre las predisposiciones genéticas a diversas enfermedades. Mediante técnicas como CRISPR, se pueden editar o modificar genes específicos asociados a enfermedades, lo que ofrece la posibilidad de reducir el riesgo hereditario de enfermedades como el cáncer, los trastornos cardiovasculares o las enfermedades neurodegenerativas. Este enfoque no solo tiene el potencial de romper el ciclo de ciertos trastornos genéticos, sino también de influir en las trayectorias de salud de las generaciones futuras.
Además, la mejora genética puede ampliar su impacto al centrarse en fortalecer el sistema inmunológico y optimizar los parámetros generales de salud. Al mejorar las respuestas inmunológicas y ajustar los factores genéticos relacionados con el bienestar general, se puede minimizar la susceptibilidad a las enfermedades infecciosas. Este enfoque proactivo de la salud puede contribuir a que la población sea menos propensa a las enfermedades y más resiliente frente a los desafíos ambientales.
Sin embargo, no se puede exagerar la importancia de las dimensiones éticas de la manipulación genética. Es imperativo lograr un delicado equilibrio entre el progreso científico y las consideraciones éticas. Es fundamental contar con marcos regulatorios sólidos y directrices transparentes para garantizar que el mejoramiento genético humano se utilice de manera responsable, evitando consecuencias no deseadas o posibles usos indebidos. A medida que avanza el campo, la integración de perspectivas éticas, legales y sociales se vuelve primordial para aprovechar todo el potencial del mejoramiento genético humano para la prevención de enfermedades, respetando al mismo tiempo los derechos individuales y los valores sociales. [49]
En general, la tecnología requiere mejoras en la eficacia, la precisión y las aplicaciones. La inmunogenicidad, los efectos no deseados, las mutaciones, los sistemas de administración y las cuestiones éticas son los principales desafíos que enfrenta la tecnología CRISPR. Las preocupaciones sobre la seguridad, las consideraciones éticas y el potencial de mal uso subrayan la necesidad de una exploración cuidadosa y responsable de estas tecnologías. [50] La tecnología CRISPR-Cas9 ofrece mucho en la prevención y el tratamiento de enfermedades, pero sus aspectos futuros, especialmente aquellos que afectan a las próximas generaciones, deben investigarse estrictamente.
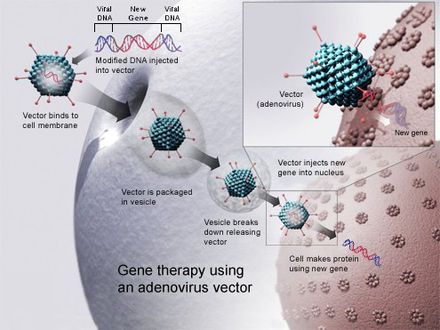
La modificación de genes humanos para tratar enfermedades genéticas se conoce como terapia génica . La terapia génica es un procedimiento médico que implica la inserción de material genético en las células de un paciente para reparar o arreglar un gen que funciona mal con el fin de tratar enfermedades hereditarias. Entre 1989 y diciembre de 2018, se llevaron a cabo más de 2900 ensayos clínicos de terapias génicas, con más de la mitad de ellos en fase I. [ 51] Desde entonces, muchos medicamentos basados en la terapia génica estuvieron disponibles, como Zolgensma y Patisiran . La mayoría de estos enfoques utilizan vectores virales , como virus adenoasociados (AAV), adenovirus (AV) y lentivirus (LV), para insertar o reemplazar transgenes in vivo o ex vivo . [52] [53]
En 2023, se crearon nanopartículas que actúan de manera similar a los vectores virales. Estas nanopartículas, llamadas biosomas recombinantes similares a virus diseñados bioortogonalmente , muestran capacidades de unión fuertes y rápidas a los receptores de LDL en las superficies celulares, lo que les permite ingresar a las células de manera eficiente y entregar genes a áreas objetivo específicas, como tejidos tumorales y artríticos . [54]
Los agentes basados en interferencia de ARN , como el zilebesiran , contienen ARNi que se une al ARNm de las células objetivo, modificando la expresión genética. [55]
Muchas enfermedades son complejas y no pueden tratarse eficazmente con estrategias simples de selección de secuencias de codificación. CRISPR/Cas9 es una tecnología que se enfoca en las roturas de doble cadena en el genoma humano, modificando genes y proporcionando una forma rápida de tratar trastornos genéticos. El tratamiento genético que emplea el método de edición genómica CRISPR/Cas se conoce como terapia génica basada en CRISPR/Cas. Las células de mamíferos pueden modificarse genéticamente utilizando el método CRISPR/Cas, sencillo, asequible y extremadamente específico. Puede ayudar con los intercambios de bases individuales, la reparación dirigida por homología y la unión de extremos no homólogos. La aplicación principal es la eliminación selectiva de genes, que implica la interrupción de secuencias de codificación para silenciar proteínas perjudiciales. Desde el desarrollo del método de edición genética CRISPR-Cas9 entre 2010 y 2012, los científicos han podido alterar genes haciendo roturas específicas en su ADN. Esta tecnología tiene muchos usos, incluida la edición genómica y el diagnóstico molecular.
La ingeniería genética ha experimentado una revolución gracias a la tecnología CRISPR/Cas, que proporciona un marco flexible para construir modelos de enfermedades en animales de mayor tamaño. Este avance ha creado nuevas oportunidades para evaluar posibles estrategias terapéuticas y comprender los fundamentos genéticos de diferentes enfermedades. Pero para hacer realidad por completo la promesa de la terapia génica basada en CRISPR/Cas, es necesario eliminar una serie de obstáculos. Mejorar la precisión y la eficiencia de la edición de los sistemas CRISPR/Cas es uno de los principales problemas. Aunque esta tecnología hace posible la edición precisa de genes, reducir las consecuencias no deseadas sigue siendo un gran desafío. Los cambios genéticos no intencionales resultantes de modificaciones no deseadas pueden tener efectos o dificultades imprevistos. Mediante el uso de diseños mejorados de ARN guía, proteínas Cas actualizadas y herramientas bioinformáticas de vanguardia, los investigadores están intentando activamente mejorar la especificidad y reducir los efectos no deseados de los procedimientos CRISPR/Cas. Además, la administración eficaz y específica de los componentes CRISPR a los tejidos objetivo presenta otro obstáculo. Se deben desarrollar u optimizar los sistemas de administración para garantizar que la maquinaria CRISPR llegue a las células u órganos previstos de manera eficiente y segura. Esto incluye la exploración de diversos métodos de administración, como vectores virales, nanopartículas o portadores basados en lípidos, para transportar los componentes CRISPR con precisión a los tejidos objetivo y, al mismo tiempo, minimizar la posible toxicidad o las respuestas inmunitarias.
A pesar de los avances recientes, se necesitan más investigaciones para desarrollar terapias CRISPR seguras y eficaces. La tecnología CRISPR/Cas9 no se utiliza activamente en la actualidad, sin embargo, hay ensayos clínicos en curso sobre su uso en el tratamiento de diversos trastornos, entre ellos la anemia de células falciformes, el cáncer de cuello uterino relacionado con el virus del papiloma humano (VPH), la infección respiratoria por COVID-19, el carcinoma de células renales y el mieloma múltiple. [56]
La terapia génica ha surgido como un campo prometedor en la ciencia médica , cuyo objetivo es abordar y tratar diversas enfermedades genéticas modificando genes humanos . El proceso implica la introducción de material genético en las células de un paciente, con el objetivo principal de reparar o corregir genes defectuosos que contribuyen a las enfermedades hereditarias . Este innovador procedimiento médico ha experimentado avances significativos y un número creciente de ensayos clínicos desde su inicio.
Entre 1989 y diciembre de 2018, se realizaron más de 2900 ensayos clínicos de terapias génicas, de los cuales más de la mitad alcanzaron la fase I. A lo largo de los años, se han desarrollado y puesto a disposición del público varios medicamentos basados en terapias génicas, lo que marca hitos importantes en el tratamiento de trastornos genéticos . Algunos ejemplos incluyen Zolgensma y Patisiran, que han demostrado eficacia para abordar afecciones genéticas específicas.
La mayoría de los enfoques de terapia génica utilizan vectores virales, como los virus adenoasociados (AAV), los adenovirus (AV) y los lentivirus (LV), para facilitar la inserción o el reemplazo de transgenes, ya sea in vivo o ex vivo. Estos vectores sirven como vehículos de administración para introducir el material genético terapéutico en las células del paciente.
Un avance notable en 2023 fue la creación de nanopartículas diseñadas para funcionar de manera similar a los vectores virales. Estos biosomas recombinantes similares a virus diseñados bioortogonalmente representan un enfoque novedoso para la administración de genes. Presentan capacidades de unión sólidas y rápidas a los receptores de lipoproteínas de baja densidad (LDL) en las superficies celulares, lo que mejora su eficiencia para ingresar a las células. Esta capacidad permite la administración dirigida de genes a áreas específicas, como tejidos tumorales y artríticos. Este avance tiene el potencial de mejorar la precisión y la eficacia de la terapia génica, minimizando los efectos no deseados y mejorando los resultados terapéuticos generales.
Además de los enfoques basados en vectores virales y nanopartículas, la interferencia de ARN (ARNi) ha surgido como otra estrategia en la terapia génica. Los agentes como el zilebesiran utilizan ARN interferente pequeño (ARNip) que se une al ARN mensajero ( ARNm ) de las células diana, modificando eficazmente la expresión génica. Este enfoque basado en la interferencia de ARN proporciona un método específico y dirigido para regular la actividad génica, lo que presenta más oportunidades para el tratamiento de trastornos genéticos .
La continua evolución de las técnicas de terapia genética , junto con el desarrollo de sistemas de administración y agentes terapéuticos innovadores, subraya el compromiso permanente de las comunidades científicas y médicas para avanzar en el campo y proporcionar tratamientos efectivos para una amplia gama de enfermedades genéticas. [57]
Los atletas podrían adoptar tecnologías de terapia genética para mejorar su rendimiento. [58] No se sabe que se produzca dopaje genético , pero múltiples terapias genéticas pueden tener tales efectos. Kayser et al. sostienen que el dopaje genético podría nivelar el campo de juego si todos los atletas tuvieran el mismo acceso. Los críticos afirman que cualquier intervención terapéutica con fines no terapéuticos/de mejora compromete los fundamentos éticos de la medicina y el deporte. [59] Por lo tanto, esta tecnología, que es un subcampo de la ingeniería genética comúnmente conocido como dopaje genético en el deporte, ha sido prohibida debido a sus riesgos potenciales. [60] El objetivo principal del dopaje genético es ayudar a las personas con afecciones médicas. Sin embargo, los atletas, conscientes de los riesgos para la salud asociados, recurren al empleo de este método en busca de un mejor rendimiento atlético. La prohibición del uso indiscriminado del dopaje genético en el deporte se ha aplicado desde el año 2003, de conformidad con la decisión adoptada por la Agencia Mundial Antidopaje (AMA). [61] Un estudio realizado en 2011 subrayó la importancia de abordar las cuestiones relacionadas con el dopaje genético y destacó la importancia de comprender rápidamente cómo el dopaje genético en la medicina deportiva y del ejercicio podría afectar a los servicios de atención médica al dilucidar su potencial para mejorar el rendimiento atlético. El artículo explica, según la Agencia Mundial Antidopaje (AMA), cómo el dopaje genético plantea una amenaza para la equidad de los deportes. Además, el documento profundiza en los problemas de salud que pueden surgir como consecuencia de la utilización del dopaje genético únicamente con el fin de mejorar el rendimiento deportivo. [62] El uso indebido del dopaje genético para mejorar el rendimiento atlético constituye una práctica poco ética y conlleva riesgos significativos para la salud, incluidos, entre otros, cáncer, infecciones virales, infarto de miocardio, daño esquelético y complicaciones autoinmunes. Además, el dopaje genético puede dar lugar a diversos problemas de salud, como el desarrollo muscular excesivo que conduce a enfermedades como la miocardiopatía hipertónica, y hacer que los huesos y los tendones sean más susceptibles a las lesiones [63]. Varios genes como EPO, IGF1, VEGFA, GH, HIFs, PPARD, PCK1 y miostatinas son opciones destacadas para el dopaje genético. Particularmente en el dopaje genético, los atletas emplean sustancias como anticuerpos contra la miostatina o bloqueadores de la miostatina. Estas sustancias contribuyen al aumento de la masa de los atletas, facilitan el aumento del desarrollo muscular y mejoran la fuerza. Sin embargo, los genes primarios utilizados para el dopaje genético en humanos pueden conducir a complicaciones como el crecimiento muscular excesivo, que puede afectar negativamente al sistema cardiovascular y aumentar la probabilidad de lesiones. [64]Sin embargo, debido a la falta de concienciación sobre estos riesgos, numerosos deportistas recurren al dopaje genético con fines distintos de su intención genuina. En el ámbito de la salud de los deportistas, la ética deportiva y el espíritu de juego limpio, los científicos han desarrollado diversas tecnologías para la detección del dopaje genético. Aunque en sus primeros años la tecnología utilizada no era fiable, se han realizado investigaciones más exhaustivas para encontrar mejores técnicas para descubrir casos de dopaje genético que han tenido más éxito. Al principio, los científicos recurrieron a técnicas como la PCR en sus diversas formas. Esto no tuvo éxito debido a que dichas tecnologías se basan en las uniones exón-exón en el ADN. Esto conduce a una falta de precisión en su detección, ya que los resultados se pueden manipular fácilmente utilizando cebadores engañosos y el dopaje genético pasaría desapercibido. [65] Con la aparición de nuevas tecnologías, estudios más recientes utilizaron la secuenciación de nueva generación (NGS) como método de detección. Con la ayuda de la bioinformática, esta tecnología superó las técnicas de secuenciación anteriores en su análisis en profundidad de la composición del ADN. La secuenciación de nueva generación (NGS) se centra en el uso de un método elaborado para analizar la secuencia de muestra y compararla con una secuencia de referencia preexistente de una base de datos de genes. De esta manera, no es posible la manipulación de cebadores, ya que la detección se realiza a nivel genómico. Mediante el uso de herramientas de visualización bioinformática, los datos se pueden leer fácilmente y se pueden resaltar las secuencias que no se alinean con la secuencia de referencia. [66] [67] Más recientemente, uno de los métodos de análisis de dopaje genético de alta eficiencia realizados en el año 2023, aprovechando tecnología de vanguardia, es HiGDA (Análisis de dopaje genético de alta eficiencia), que emplea tecnología CRISPR/deadCas9. [68]
Los problemas éticos relacionados con el dopaje genético han existido mucho antes de su descubrimiento. Aunque el dopaje genético es relativamente nuevo, el concepto de mejora genética de cualquier tipo siempre ha estado sujeto a preocupaciones éticas. Incluso cuando se utiliza de manera terapéutica, la terapia génica plantea muchos riesgos debido, entre otras razones, a su imprevisibilidad. Otros factores, además de los problemas de salud, también han suscitado cuestiones éticas. Estas se refieren principalmente al factor hereditario de estas terapias, donde la edición genética en algunos casos puede transmitirse a la siguiente generación con mayores tasas de imprevisibilidad y riesgos en los resultados. [69] Por esta razón, la aplicación no terapéutica de la terapia génica puede verse como un enfoque más riesgoso para una preocupación no médica. [70]
En un estudio, desde la historia hasta hoy, los seres humanos siempre han estado en competencia. Mientras que en el pasado los guerreros competían por ser más fuertes en las guerras, hoy existe competencia por tener éxito en todos los campos, y se entiende que esta psicología es un fenómeno que siempre ha existido en la historia humana hasta hoy. Se sabe que aunque un deportista tiene potencial genético, no puede llegar a ser campeón si no cumple con el entrenamiento y estilo de vida necesarios. Sin embargo, a medida que aumenta la competencia, se necesita tanto más entrenamiento físico como más rendimiento mental. Así como los guerreros en la historia utilizaban algunas curas a base de hierbas para verse más fuertes y agresivos, es un hecho que hoy en día, los deportistas recurren a métodos de dopaje para aumentar su rendimiento. Sin embargo, esta situación es contraria a la ética deportiva porque no se ajusta a la moral y la comprensión del juego. [71]
Uno de los efectos negativos es el riesgo de cáncer, y como efecto positivo está el tomar precauciones contra ciertas condiciones patológicas. La alteración de los genes puede provocar cambios no deseados e impredecibles en el cuerpo, lo que podría causar problemas de salud imprevistos. Otros efectos del dopaje genético en el deporte son la lucha constante contra los fármacos no aprobados por la Agencia Mundial Antidopaje y la injusticia con respecto a los atletas que se drogan y los que no. Es posible que no se comprendan del todo las consecuencias a largo plazo del dopaje genético para la salud, y los atletas pueden enfrentarse a problemas de salud más adelante en la vida. [72]
Otras terapias genéticas hipotéticas podrían incluir cambios en la apariencia física, el metabolismo, las facultades mentales como la memoria y la inteligencia, y el bienestar (al aumentar la resistencia a la depresión o aliviar el dolor crónico , por ejemplo). [73] [74]
Se destaca la exploración de los desafíos que plantea la comprensión de los efectos de las alteraciones genéticas en los fenotipos, en particular en la diversidad genética natural. Se hace hincapié en el potencial de la biología de sistemas y los avances en las tecnologías de genotipado / fenotipado para estudiar rasgos complejos. A pesar de los avances, se reconocen las dificultades persistentes para predecir la influencia de las alteraciones genéticas en los cambios fenotípicos, lo que pone de relieve la necesidad de seguir investigando en esta área. [75]
Algunos trastornos congénitos (como los que afectan al sistema musculoesquelético ) pueden afectar la apariencia física y, en algunos casos, también pueden causar malestar físico. La modificación de los genes que causan estas enfermedades congénitas (en personas a las que se les diagnostica una mutación del gen que se sabe que causa estas enfermedades) puede evitar esto.
- Impactos fenotípicos de la edición CRISPR-Cas9 en ratones dirigidos al gen Tyr:
En un estudio exhaustivo de edición genética con CRISPR - Cas9 , se apuntó al gen Tyr en ratones, buscando instigar alteraciones genéticas. El análisis no encontró efectos no deseados en 42 sujetos, y se observaron modificaciones exclusivamente en el locus Tyr deseado. Aunque no se discutieron los detalles de manera explícita, estas alteraciones podrían influir potencialmente en aspectos no definidos, como el color del pelaje, lo que enfatiza el potencial más amplio de la edición genética para inducir diversos cambios fenotípicos. [76]
También los cambios en el gen de la miostatina [77] pueden alterar la apariencia.
En los años 1970 y 1980 se hicieron importantes descubrimientos genéticos cuantitativos que iban más allá de la estimación de la heredabilidad. Sin embargo, cuestiones como la curva de campana resurgieron y, en la década de 1990, los científicos reconocieron la importancia de la genética para los rasgos conductuales como la inteligencia . La Conferencia del Centenario de la Asociación Estadounidense de Psicología en 1992 eligió la genética conductual como tema para el pasado, el presente y el futuro de la psicología . La genética molecular se sintetizó, lo que resultó en la revolución del ADN y la genómica conductual , a medida que los descubrimientos genéticos cuantitativos se desaceleraron. Las diferencias conductuales individuales ahora se pueden predecir de forma temprana gracias a la revolución del ADN de las ciencias del comportamiento . La primera ley de la genética conductual se estableció en 1978 después de que una revisión de treinta estudios de gemelos revelara que la estimación promedio de heredabilidad para la inteligencia era del 46%. [78] El comportamiento también puede modificarse mediante intervención genética. [79] Algunas personas pueden ser agresivas, egoístas y pueden no ser capaces de funcionar bien en sociedad. Las mutaciones en GLI3 y otros genes de patrones se han vinculado a la etiología de HH, según la investigación genética. Aproximadamente el 50%-80% de los niños con HH tienen ira aguda y violencia, y la mayoría de los pacientes tienen problemas externalizantes. La epilepsia puede estar precedida por inestabilidad conductual e incapacidad intelectual. [80] Actualmente hay investigaciones en curso sobre genes que son o pueden ser (en parte) responsables del egoísmo (p. ej. gen de crueldad ), la agresión (p . ej. gen guerrero ), el altruismo (p. ej. OXTR , CD38 , COMT , DRD4 , DRD5 , IGF2 , GABRB2 [81] )
Desde la invención de la tecnología del ADN recombinante , se ha generado una gran expectación por la tecnología de edición genética para modificar los genes y regular nuestra biología . Sin embargo, estas expectativas en su mayoría no se han cumplido. La evaluación de los usos apropiados de las intervenciones de la línea germinal en la medicina reproductiva no debería basarse en preocupaciones sobre la mejora o la eugenesia, a pesar del hecho de que la investigación sobre edición genética ha avanzado significativamente hacia la aplicación clínica. [82]
La fibrosis quística (FQ) es una enfermedad hereditaria causada por mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR) . Si bien el 90 % de los pacientes con FQ pueden ser tratados, los tratamientos actuales no son curativos y no abordan todo el espectro de mutaciones del CFTR. Por lo tanto, se necesita una terapia integral y a largo plazo para tratar a todos los pacientes con FQ de una vez por todas. Se están desarrollando tecnologías de edición genética CRISPR/Cas como una plataforma viable para el tratamiento genético. [83] Sin embargo, las dificultades para administrar suficiente gen CFTR y mantener la expresión en los pulmones han obstaculizado la eficacia de la terapia genética. Los avances técnicos recientes, que incluyen el transporte de vectores virales y no virales, las tecnologías de ácidos nucleicos alternativos y las nuevas tecnologías como la edición genética CRISPR y de ARNm , han aprovechado nuestro conocimiento de la biología de la FQ y el epitelio de las vías respiratorias. [84]
Desde su concepción y uso, la transferencia de genes humanos ha ofrecido la promesa de un remedio duradero para enfermedades hereditarias como la fibrosis quística (FQ) . La aparición de tecnologías sofisticadas que permiten la alteración de sitios específicos con nucleasas programables ha revitalizado enormemente el área de la terapia génica . [85] Hay algunas investigaciones en curso sobre el tratamiento hipotético de trastornos psiquiátricos por medio de la terapia génica. Se supone que, con técnicas de transferencia génica, es posible (en entornos experimentales utilizando modelos animales) alterar la expresión génica del SNC y, por lo tanto, la generación intrínseca de moléculas involucradas en la plasticidad neuronal y la regeneración neuronal, y, por lo tanto, modificar en última instancia el comportamiento. [86]
En los últimos años, se ha logrado modificar la ingesta de etanol en modelos animales. En concreto, se ha conseguido modificando la expresión del gen de la aldehído deshidrogenasa (ALDH2), lo que ha provocado una alteración significativa de la conducta de consumo de alcohol. [87] La reducción de p11, una proteína de unión al receptor de serotonina, en el núcleo accumbens ha provocado una conducta similar a la depresión en roedores, mientras que la restauración de la expresión del gen p11 en esta zona anatómica ha revertido esta conducta. [73]
Recientemente, también se ha demostrado que la transferencia de genes de CBP (proteína de unión a CREB (proteína de unión al elemento de respuesta a c-AMP)) mejora los déficits cognitivos en un modelo animal de demencia de Alzheimer mediante el aumento de la expresión de BDNF (factor neurotrófico derivado del cerebro). [88] Los mismos autores también pudieron demostrar en este estudio que la acumulación de amiloide-β (Aβ) interfería con la actividad de CREB, que está fisiológicamente implicada en la formación de la memoria.
En otro estudio, se demostró que la deposición de Aβ y la formación de placa se pueden reducir mediante la expresión sostenida del gen de la neprilisina (una endopeptidasa), lo que también condujo a mejoras en el nivel conductual (es decir, cognitivo). [89]
De manera similar, la transferencia intracerebral de genes de ECE (enzima convertidora de endotelina) a través de un vector viral inyectado estereotácticamente en la corteza anterior derecha y el hipocampo, también ha demostrado reducir los depósitos de Aβ en un modelo de ratón transgénico de demencia de Alzheimer. [90]
También se están realizando investigaciones sobre genoeconomía , una protociencia que se basa en la idea de que el comportamiento financiero de una persona podría rastrearse hasta su ADN y que los genes están relacionados con el comportamiento económico . Hasta 2015 [actualizar], los resultados no han sido concluyentes. Se han identificado algunas correlaciones menores. [91] [92]
Algunos estudios muestran que nuestros genes pueden afectar algunos de nuestros comportamientos. Por ejemplo, algunos genes pueden seguir nuestro estado de estancamiento, mientras que otros pueden ser responsables de nuestros malos hábitos. Para dar un ejemplo, el gen MAOA (Mono oxidasa A), la característica de este gen afecta la liberación de hormonas como la serotonina, la epinefrina y la dopamina y las suprime. Nos impide reaccionar en algunas situaciones y detenernos y tomar decisiones rápidas en otras situaciones, lo que puede hacer que tomemos decisiones equivocadas en posibles malas situaciones. Como resultado de algunas investigaciones, se pueden observar estados de ánimo como agresión, sentimientos de compasión e irritabilidad en personas portadoras de este gen. Además, como resultado de la investigación realizada en personas portadoras del gen MAOA, este gen puede transmitirse genéticamente de los padres, y también pueden desarrollarse mutaciones debido a razones epigenéticas posteriores. Si hablamos de razones epigenéticas, los hijos de familias que crecen en malos entornos comienzan a implementar todo lo que ven de sus padres. Por esta razón, esos niños comienzan a exhibir malos hábitos o comportamientos como irritabilidad y agresión en el futuro. [93]
En 2022, la Academia de Ciencias Militares del Ejército Popular de Liberación informó sobre un notable experimento en el que científicos militares insertaron un gen del tardígrado en células madre embrionarias humanas . Este experimento tenía como objetivo explorar la posible mejora de la resistencia de los soldados al síndrome de radiación aguda , aumentando así su capacidad para sobrevivir a la lluvia radiactiva. Este desarrollo refleja la intersección de la ingeniería genética y la investigación militar , con un enfoque en la biomejora para el personal militar. [94]
Las tecnologías CRISPR/Cas9 han llamado la atención por sus posibles aplicaciones en contextos militares. Hay varios proyectos en marcha, incluidos aquellos centrados en proteger a los soldados de desafíos específicos. Por ejemplo, los investigadores están explorando el uso de CRISPR/Cas9 para brindar protección contra la congelación , reducir los niveles de estrés, aliviar la falta de sueño y mejorar la fuerza y la resistencia. La Agencia de Proyectos de Investigación Avanzada de Defensa ( DARPA ) participa activamente en la investigación y el desarrollo de estas tecnologías. Uno de sus proyectos tiene como objetivo diseñar células humanas para que funcionen como fábricas de nutrientes, lo que potencialmente optimizaría el rendimiento y la resiliencia de los soldados en entornos desafiantes. [95]
Además, los investigadores militares están realizando ensayos con animales para explorar el tratamiento profiláctico para la protección a largo plazo contra las armas químicas de destrucción masiva. Esto implica el uso de vectores AAV8 no patógenos para administrar un biodepurador catalítico candidato, PON1-IF11, en el torrente sanguíneo de ratones . Estas iniciativas subrayan la exploración más amplia de intervenciones genéticas y moleculares para mejorar las capacidades militares y proteger al personal de diversas amenazas. [96]
En el ámbito de la biomejora, se han planteado inquietudes sobre el uso de suplementos dietéticos y otras mejoras biomédicas por parte del personal militar. Se dice que una parte importante de las fuerzas de operaciones especiales estadounidenses utilizan suplementos dietéticos para mejorar el rendimiento, pero no está claro en qué medida se utilizan otros métodos de biomejora, como los esteroides, la hormona del crecimiento humano y la eritropoyetina. La falta de pruebas completas de seguridad y eficacia para estas biomejoras plantea cuestiones éticas y regulatorias. Esta preocupación no es nueva, ya que las cuestiones relacionadas con el uso no autorizado de productos como el bromuro de piridostigmina y la vacuna de toxoide botulínico durante la Guerra del Golfo , así como el Programa de Inmunización con Vacuna contra el Ántrax del Departamento de Defensa en 1998, han provocado debates sobre la necesidad de una aprobación exhaustiva de la FDA para aplicaciones militares específicas. [97]
La intersección de la ingeniería genética , las tecnologías CRISPR/Cas9 y la investigación militar plantea complejas consideraciones éticas en relación con el potencial aumento de las capacidades humanas para fines militares. Lograr un equilibrio entre los avances científicos, las normas éticas y la supervisión regulatoria sigue siendo crucial a medida que estas tecnologías continúan evolucionando. [98]
George Church ha compilado una lista de posibles modificaciones genéticas basadas en estudios científicos para posibles rasgos ventajosos como una menor necesidad de sueño , cambios relacionados con la cognición que protegen contra la enfermedad de Alzheimer, resistencia a enfermedades, mayor masa muscular magra y mejores capacidades de aprendizaje junto con algunos de los estudios asociados y posibles efectos negativos. [99] [100]
{{cite journal}}: CS1 maint: DOI inactivo a partir de octubre de 2024 ( enlace )