La inmunidad humoral es el aspecto de la inmunidad que está mediado por macromoléculas (incluidos los anticuerpos secretados , las proteínas del complemento y ciertos péptidos antimicrobianos ) que se encuentran en los fluidos extracelulares . La inmunidad humoral se llama así porque involucra sustancias que se encuentran en los humores o fluidos corporales . Contrasta con la inmunidad mediada por células . La inmunidad humoral también se conoce como inmunidad mediada por anticuerpos .
El estudio de los componentes moleculares y celulares que forman el sistema inmunitario , incluyendo su función e interacción, es la ciencia central de la inmunología . El sistema inmunitario se divide en un sistema inmunitario innato más primitivo y un sistema inmunitario adquirido o adaptativo de los vertebrados , cada uno de los cuales contiene elementos inmunitarios tanto humorales como celulares .
La inmunidad humoral se refiere a la producción de anticuerpos y los procesos coincidentes que la acompañan, entre ellos: la activación de Th2 y la producción de citocinas , la formación del centro germinal y el cambio de isotipo , y la maduración por afinidad y la generación de células de memoria . También se refiere a las funciones efectoras de los anticuerpos, que incluyen la neutralización de patógenos y toxinas , la activación clásica del complemento y la promoción de la fagocitosis y la eliminación de patógenos por parte de las opsoninas . [1]
El concepto de inmunidad humoral se desarrolló a partir del análisis de la actividad antibacteriana de los componentes del suero. A Hans Buchner se le atribuye el desarrollo de la teoría humoral. [2] En 1890, Buchner describió las alexinas como "sustancias protectoras" que existen en el suero sanguíneo y otros fluidos corporales y son capaces de matar microorganismos . Se demostró que las alexinas, redefinidas posteriormente como "complementos" por Paul Ehrlich , eran los componentes solubles de la respuesta innata que conduce a una combinación de inmunidad celular y humoral. Este descubrimiento ayudó a unir las características de la inmunidad innata y adquirida . [2]
Tras el descubrimiento en 1888 de las bacterias que causan la difteria y el tétanos , Emil von Behring y Kitasato Shibasaburō demostraron que la enfermedad no tiene por qué ser causada por los propios microorganismos. Descubrieron que los filtrados libres de células eran suficientes para causar la enfermedad. En 1890, los filtrados de difteria, más tarde llamados toxinas diftéricas , se utilizaron para vacunar animales en un intento de demostrar que el suero inmunizado contenía una antitoxina que podía neutralizar la actividad de la toxina y podía transferir inmunidad a animales no inmunes. [3] En 1897, Paul Ehrlich demostró que se forman anticuerpos contra las toxinas vegetales ricina y abrina , y propuso que estos anticuerpos son responsables de la inmunidad. [2] Ehrlich, con su colega von Behring, desarrolló la antitoxina diftérica , que se convirtió en el primer gran éxito de la inmunoterapia moderna . [3] El descubrimiento de anticuerpos compatibles específicos se convirtió en una herramienta importante en la estandarización de la inmunidad y la identificación de infecciones persistentes . [3]
Los anticuerpos o inmunoglobulinas son glicoproteínas que se encuentran en la sangre y la linfa . Estructuralmente, los anticuerpos son proteínas globulares grandes con forma de Y. En los mamíferos, hay cinco tipos de anticuerpos: inmunoglobulina A , inmunoglobulina D , inmunoglobulina E , inmunoglobulina G e inmunoglobulina M. Cada clase de inmunoglobulina difiere en sus propiedades biológicas y ha evolucionado para lidiar con diferentes antígenos. [5] Los anticuerpos son sintetizados y secretados por células plasmáticas que se derivan de las células B del sistema inmunológico.
El sistema inmunitario adquirido utiliza un anticuerpo para identificar y neutralizar objetos extraños, como bacterias y virus. Cada anticuerpo reconoce un antígeno específico exclusivo de su diana. Al unirse a sus antígenos específicos, los anticuerpos pueden provocar la aglutinación y precipitación de productos anticuerpo-antígeno, prepararlos para la fagocitosis por parte de los macrófagos y otras células, bloquear los receptores virales y estimular otras respuestas inmunitarias, como la vía del complemento .
Una transfusión de sangre incompatible provoca una reacción transfusional , que está mediada por la respuesta inmunitaria humoral. Este tipo de reacción, llamada reacción hemolítica aguda , da lugar a la destrucción rápida (hemólisis) de los glóbulos rojos del donante por los anticuerpos del huésped. La causa suele ser un error administrativo, como la administración de la unidad de sangre equivocada al paciente equivocado. Los síntomas son fiebre y escalofríos, a veces con dolor de espalda y orina rosada o roja ( hemoglobinuria ). La principal complicación es que la hemoglobina liberada por la destrucción de los glóbulos rojos puede causar insuficiencia renal aguda .
En la respuesta inmune humoral, las células B vírgenes comienzan el proceso de maduración en la médula ósea, ganando receptores de células B (BCR) a lo largo de la superficie celular. [6] Estos BCR son complejos proteicos unidos a la membrana que tienen una alta afinidad de unión por antígenos específicos ; esta especificidad se deriva de la secuencia de aminoácidos de las cadenas polipeptídicas pesadas y ligeras que constituyen la región variable del BCR. [7] Una vez que un BCR interactúa con un antígeno, crea una señal de unión que dirige a la célula B para producir un anticuerpo único que solo se une a ese antígeno . Las células B maduras luego migran desde la médula ósea a los ganglios linfáticos u otros órganos linfáticos , donde comienzan a encontrar patógenos.

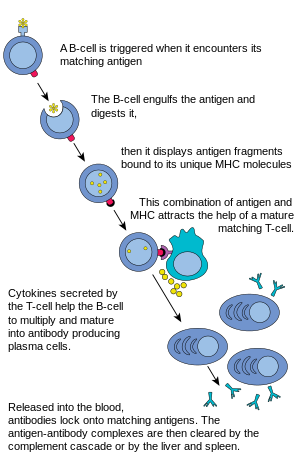
Cuando una célula B encuentra un antígeno, se activa una señal, el antígeno se une al receptor y es llevado al interior de la célula B por endocitosis . El antígeno es procesado y presentado nuevamente en la superficie de la célula B por las proteínas MHC-II . Las proteínas MHC-II son reconocidas por las células T auxiliares , estimulando la producción de proteínas, lo que permite que las células B se multipliquen y que los descendientes se diferencien en células secretoras de anticuerpos que circulan en la sangre. [8] Las células B pueden activarse a través de ciertos agentes microbianos sin la ayuda de las células T y tienen la capacidad de trabajar directamente con los antígenos para proporcionar respuestas a los patógenos presentes. [8]
La célula B espera a que una célula T colaboradora (T H ) se una al complejo. Esta unión activará la célula T H , que luego liberará citocinas que inducen a las células B a dividirse rápidamente, produciendo miles de clones idénticos de la célula B. Estas células hijas se convierten en células plasmáticas o células de memoria . Las células B de memoria permanecen inactivas aquí; más tarde, cuando estas células B de memoria encuentran el mismo antígeno debido a la reinfección, se dividen y forman células plasmáticas. Por otro lado, las células plasmáticas producen una gran cantidad de anticuerpos que se liberan libremente en el sistema circulatorio .
Estos anticuerpos se encontrarán con los antígenos y se unirán a ellos, lo que interferirá en la interacción química entre las células huésped y las extrañas, o pueden formar puentes entre sus sitios antigénicos, lo que dificultará su correcto funcionamiento. Su presencia también puede atraer a los macrófagos o a las células asesinas para que los ataquen y los fagociten .
El sistema del complemento es una cascada bioquímica del sistema inmunitario innato que ayuda a eliminar los patógenos de un organismo. Se deriva de muchas proteínas pequeñas del plasma sanguíneo que trabajan juntas para alterar la membrana plasmática de la célula diana, lo que conduce a la citólisis de la célula. El sistema del complemento consta de más de 35 proteínas solubles y unidas a las células, 12 de las cuales participan directamente en las vías del complemento. [1] El sistema del complemento participa en las actividades tanto de la inmunidad innata como de la inmunidad adquirida.
La activación de este sistema conduce a la citólisis, quimiotaxis , opsonización , depuración inmunitaria e inflamación , así como al marcado de patógenos para la fagocitosis. Las proteínas representan el 5% de la fracción de globulina sérica . La mayoría de estas proteínas circulan como zimógenos , que son inactivos hasta la escisión proteolítica . [1]
Tres vías bioquímicas activan el sistema del complemento: la vía clásica del complemento , la vía alternativa del complemento y la vía de la lectina de unión a manosa . [9] Estos procesos difieren solo en el proceso de activación de la C3 convertasa , [10] que es el paso inicial de la activación del complemento, y el proceso posterior es finalmente el mismo.
La vía clásica se inicia mediante la exposición a anticuerpos unidos al antígeno que flotan libremente, lo que conduce a la escisión enzimática de subunidades más pequeñas del complemento que se sintetizan para formar la convertasa C3.
Esto difiere de la vía de la lectina de unión a manosa, que se inicia por motivos de carbohidratos bacterianos, como la manosa, que se encuentran en la superficie de la bacteria. Después del proceso de unión, se produce la misma escisión y síntesis de subunidades que en la vía clásica. La vía alternativa del complemento diverge completamente de las vías anteriores, ya que esta vía se inicia espontáneamente en presencia de C3 hidrolizado, que luego recluta otras subunidades que pueden escindirse para formar la C3 convertasa. En las tres vías, una vez que se sintetiza la C3 convertasa, los complementos se escinden en subunidades que forman una estructura llamada complejo de ataque de membrana (MAC) en la pared celular bacteriana para destruir las bacterias [11] o actúan como citocinas y quimiocinas, amplificando la respuesta inmunitaria.