
La galvanoplastia , también conocida como deposición electroquímica o electrodeposición , es un proceso de producción de un recubrimiento metálico sobre un sustrato sólido mediante la reducción de cationes de ese metal mediante una corriente eléctrica directa . La pieza a recubrir actúa como cátodo ( electrodo negativo ) de una celda electrolítica ; el electrolito es una solución de una sal del metal a recubrir; y el ánodo (electrodo positivo) suele ser un bloque de ese metal o de algún material conductor inerte . La corriente es proporcionada por una fuente de alimentación externa .
La galvanoplastia se utiliza ampliamente en la industria y las artes decorativas para mejorar las cualidades de la superficie de los objetos, como la resistencia a la abrasión y la corrosión , la lubricidad , la reflectividad , la conductividad eléctrica o la apariencia. Se utiliza para aumentar el espesor de piezas desgastadas o de tamaño insuficiente, o para fabricar placas de metal con formas complejas, un proceso llamado electroformado . Se utiliza para depositar cobre y otros conductores en la formación de placas de circuito impreso e interconexiones de cobre en circuitos integrados. También se utiliza para purificar metales como el cobre .
La galvanoplastia de metales mencionada anteriormente utiliza un proceso de electrorreducción (es decir, corriente negativa o catódica en el electrodo de trabajo). El término "galvanoplastia" también se utiliza ocasionalmente para procesos que ocurren bajo electrooxidación (es decir, corriente positiva o anódica en el electrodo de trabajo). Un ejemplo de ello es la formación de cloruro de plata sobre alambre de plata en soluciones de cloruro para fabricar electrodos de plata/cloruro de plata (AgCl) . Aunque estos procesos se denominan más comúnmente anodizado que galvanoplastia.
El electropulido , un proceso que utiliza una corriente eléctrica para eliminar selectivamente la capa más externa de la superficie de un objeto metálico, es lo inverso al proceso de galvanoplastia. [1]
La potencia de lanzamiento es un parámetro importante que proporciona una medida de la uniformidad de la corriente de galvanoplastia y, en consecuencia, de la uniformidad del espesor del metal galvanizado, en regiones de la pieza que están cerca del ánodo en comparación con regiones que están lejos de él. Depende principalmente de la composición y temperatura de la solución de galvanoplastia, así como de la densidad de corriente operativa . [2] Un mayor poder de proyección del baño de revestimiento da como resultado un recubrimiento más uniforme. [3]
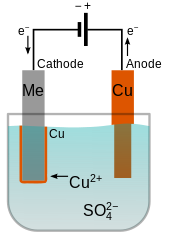
El electrolito de la celda de revestimiento electrolítico debe contener iones positivos (cationes) del metal que se va a depositar. Estos cationes se reducen en el cátodo al metal en el estado de valencia cero. Por ejemplo, el electrolito para el revestimiento de cobre puede ser una solución de sulfato de cobre (II) , que se disocia en cationes Cu 2+ y SO.2-4
_aniones. En el cátodo, el Cu 2+ se reduce a cobre metálico ganando dos electrones.
Cuando el ánodo está hecho del metal destinado a recubrir el cátodo, puede ocurrir la reacción opuesta en el ánodo, convirtiéndolo en cationes disueltos. Por ejemplo, el cobre se oxidaría en el ánodo a Cu 2+ perdiendo dos electrones. En este caso, la velocidad a la que se disuelve el ánodo será igual a la velocidad a la que se recubre el cátodo y, por lo tanto, el ánodo repone continuamente los iones en el baño de electrolito. El resultado neto es la transferencia efectiva de metal del ánodo al cátodo. [4]
En cambio, el ánodo puede estar hecho de un material que resista la oxidación electroquímica, como plomo o carbono . En su lugar, se producen oxígeno , peróxido de hidrógeno y algunos otros subproductos en el ánodo. En este caso, los iones del metal a recubrir deben reponerse (continua o periódicamente) en el baño a medida que se extraen de la solución. [5]
El revestimiento suele ser un elemento metálico único , no una aleación . Sin embargo, algunas aleaciones se pueden electrodepositar, en particular el latón y la soldadura . Las "aleaciones" recubiertas no son "verdaderas aleaciones" (soluciones sólidas), sino que son pequeños cristales de los metales elementales que se recubren. En el caso de la soldadura chapada, a veces se considera necesario tener una verdadera aleación, y la soldadura chapada se funde para permitir que el estaño y el plomo se combinen en una verdadera aleación. La verdadera aleación es más resistente a la corrosión que la mezcla revestida.
Muchos baños de galvanoplastia incluyen cianuros de otros metales (como cianuro de potasio ) además de cianuros del metal que se va a depositar. Estos cianuros libres facilitan la corrosión del ánodo, ayudan a mantener un nivel constante de iones metálicos y contribuyen a la conductividad. Además, se pueden agregar productos químicos no metálicos como carbonatos y fosfatos para aumentar la conductividad.
Cuando no se desea enchapar ciertas áreas del sustrato, se aplican tapones para evitar que el baño entre en contacto con el sustrato. Las paradas típicas incluyen cinta adhesiva, papel de aluminio, lacas y ceras . [6]
Inicialmente, se puede utilizar un depósito de revestimiento especial llamado strike o flash para formar un revestimiento muy delgado (normalmente de menos de 0,1 μm de espesor) con alta calidad y buena adherencia al sustrato. Esto sirve como base para los procesos de recubrimiento posteriores. Una huelga utiliza una alta densidad de corriente y un baño con una baja concentración de iones. El proceso es lento, por lo que se utilizan procesos de revestimiento más eficientes una vez que se obtiene el espesor deseado.
El método de percusión también se utiliza en combinación con el revestimiento de diferentes metales. Si es deseable recubrir un tipo de depósito sobre un metal para mejorar la resistencia a la corrosión pero este metal tiene inherentemente una mala adhesión al sustrato, primero se puede depositar una placa que sea compatible con ambos. Un ejemplo de esta situación es la mala adherencia del níquel electrolítico sobre aleaciones de zinc , en cuyo caso se utiliza un cerradero de cobre, que tiene buena adherencia a ambos. [5]
El proceso de galvanoplastia por pulsos o electrodeposición por pulsos (PED) implica la alternancia rápida del potencial eléctrico o la corriente entre dos valores diferentes, lo que da como resultado una serie de pulsos de igual amplitud, duración y polaridad, separados por corriente cero. Al cambiar la amplitud y el ancho del pulso, es posible cambiar la composición y el espesor de la película depositada. [7]
Los parámetros experimentales de la galvanoplastia por impulsos generalmente consisten en corriente/potencial pico, ciclo de trabajo, frecuencia y corriente/potencial efectiva. La corriente/potencial máximo es el ajuste máximo de corriente o potencial de galvanoplastia. El ciclo de trabajo es la porción de tiempo efectiva en un determinado período de galvanoplastia con la corriente o potencial aplicado. La corriente/potencial efectivo se calcula multiplicando el ciclo de trabajo y el valor máximo de la corriente o potencial. La galvanoplastia por impulsos podría ayudar a mejorar la calidad de la película galvanizada y liberar la tensión interna acumulada durante la deposición rápida. Una combinación del ciclo de trabajo corto y la alta frecuencia podría disminuir las grietas superficiales. Sin embargo, para mantener la corriente o el potencial efectivo constante, es posible que se requiera una fuente de alimentación de alto rendimiento para proporcionar una corriente/potencial alta y un interruptor rápido. Otro problema común de la galvanoplastia por impulsos es que el material del ánodo podría recubrirse y contaminarse durante la galvanoplastia inversa, especialmente para electrodos inertes de alto costo como el platino .
Otros factores que afectan la galvanoplastia por impulsos incluyen la temperatura, la separación entre ánodo y cátodo y la agitación. A veces, la galvanoplastia por impulsos se puede realizar en un baño de galvanoplastia calentado para aumentar la velocidad de depósito, ya que la velocidad de la mayoría de las reacciones químicas aumenta exponencialmente con la temperatura según la ley de Arrhenius . La brecha entre ánodo y cátodo está relacionada con la distribución de corriente entre ánodo y cátodo. Una pequeña relación entre espacio y área de muestra puede causar una distribución desigual de la corriente y afectar la topología de la superficie de la muestra plateada. La agitación puede aumentar la velocidad de transferencia/difusión de iones metálicos desde la solución a granel hasta la superficie del electrodo. La configuración de agitación varía según los diferentes procesos de galvanoplastia de metales.
Un proceso estrechamente relacionado es la galvanoplastia con cepillo, en la que se recubren áreas localizadas o artículos enteros utilizando un cepillo saturado con una solución de recubrimiento. El cepillo, típicamente un cuerpo de acero inoxidable envuelto con un material de tela absorbente que retiene la solución de recubrimiento y evita el contacto directo con el artículo que se está recubriendo, está conectado al ánodo de una fuente de energía de corriente continua de bajo voltaje y al artículo que se va a recubrir. conectado al cátodo . El operador sumerge el cepillo en una solución de recubrimiento y luego la aplica al artículo, moviendo el cepillo continuamente para obtener una distribución uniforme del material de recubrimiento.
La galvanoplastia con brocha tiene varias ventajas sobre el revestimiento de tanques, incluida la portabilidad, la capacidad de revestir elementos que por alguna razón no pueden revestirse en tanques (una aplicación fue el revestimiento de porciones de columnas de soporte decorativas muy grandes en la restauración de un edificio), requisitos de enmascaramiento bajos o nulos, y requisitos de volumen de solución de revestimiento comparativamente bajos. Las desventajas en comparación con el revestimiento de tanques pueden incluir una mayor participación del operador (el revestimiento de tanques frecuentemente se puede realizar con una atención mínima) y la incapacidad de lograr un espesor de placa tan grande.
Esta técnica de galvanoplastia es una de las más utilizadas en la industria para una gran cantidad de objetos pequeños. Los objetos se colocan en una jaula no conductora en forma de barril y luego se sumergen en un baño químico que contiene iones disueltos del metal que se va a recubrir. Luego se gira el cañón y pasan corrientes eléctricas a través de las distintas piezas del cañón que completan los circuitos cuando se tocan entre sí. El resultado es un proceso de enchapado muy uniforme y eficiente, aunque el acabado de los productos finales probablemente sufrirá abrasión durante el proceso de enchapado. No es adecuado para artículos muy ornamentales o diseñados con precisión. [8]
La limpieza es esencial para una galvanoplastia exitosa, ya que las capas moleculares de aceite pueden impedir la adhesión del recubrimiento. ASTM B322 es una guía estándar para la limpieza de metales antes de la galvanoplastia. La limpieza incluye limpieza con solventes, limpieza con detergente alcalino caliente, electrolimpieza y tratamiento con ácido, etc. La prueba industrial de limpieza más común es la prueba de rotura de agua, en la que la superficie se enjuaga minuciosamente y se mantiene vertical. Los contaminantes hidrófobos, como los aceites, hacen que el agua forme gotas y se rompa, lo que permite que se drene rápidamente. Las superficies metálicas perfectamente limpias son hidrófilas y retendrán una lámina de agua intacta que no forma gotas ni se escurre. ASTM F22 describe una versión de esta prueba. Esta prueba no detecta contaminantes hidrófilos, pero la galvanoplastia puede desplazarlos fácilmente ya que las soluciones son a base de agua. Los tensioactivos como el jabón reducen la sensibilidad de la prueba y deben enjuagarse bien.
El poder de lanzamiento (o poder de lanzamiento macro ) es un parámetro importante que proporciona una medida de la uniformidad de la corriente de galvanoplastia y, en consecuencia, de la uniformidad del espesor del metal galvanizado, en regiones de la pieza que están cerca del ánodo en comparación con regiones que están lejos. de eso. Depende principalmente de la composición y temperatura de la solución de galvanoplastia. [2] El poder de microlanzamiento se refiere a la medida en que un proceso puede llenar pequeños huecos, como los orificios pasantes . [9] El poder de lanzamiento se puede caracterizar mediante el número de Wagner adimensional: Wa=(RTκ)/(FLα|i|), donde R es la constante universal de los gases , T es la temperatura de funcionamiento , κ es la conductividad iónica de la solución de revestimiento. , F es la constante de Faraday , L es el tamaño equivalente del objeto recubierto, α es el coeficiente de transferencia , i la densidad de corriente total promediada por la superficie (incluida la evolución de hidrógeno). El número de Wagner cuantifica la relación entre resistencias cinéticas y óhmicas. Un número de Wagner más alto produce una deposición más uniforme. Esto se puede lograr en la práctica disminuyendo el tamaño (L) del objeto recubierto, reduciendo la densidad de corriente |i|, agregando productos químicos que reducen α (hacen que la corriente eléctrica sea menos sensible al voltaje) y aumentando la conductividad de la solución (por ejemplo, agregando ácido ). La evolución simultánea de hidrógeno generalmente mejora la uniformidad de la galvanoplastia al aumentar |i|. Sin embargo, este efecto puede compensarse mediante el bloqueo debido a burbujas de hidrógeno y depósitos de hidróxido. [10]
El número de Wagner es bastante difícil de medir con precisión, por lo que normalmente se utilizan otros parámetros relacionados, que son más fáciles de obtener experimentalmente con celdas estándar. Estos parámetros se derivan de dos relaciones: la relación M = m 1 / m 2 del espesor del revestimiento de una región especificada del cátodo "cerca" del ánodo al espesor de una región "lejos" del cátodo; y la relación L = x 2 / x 1 de las distancias de estas regiones a través del electrolito hasta el ánodo. En una celda Haring-Blum, por ejemplo, L = 5 para sus dos cátodos independientes, y una celda que produce una relación de espesor de revestimiento de M = 6 tiene un poder de proyección Harring-Blum de 100 % × ( L − M ) / L = −20 %. . [9] Otras convenciones incluyen el poder de lanzamiento de Heatley 100% × ( L − M ) / ( L − 1 ) y el poder de lanzamiento de campo 100% × ( L − M ) / ( L + M − 2 ) . [11] Se obtiene un espesor más uniforme haciendo que el poder de lanzamiento sea mayor (menos negativo) según cualquiera de estas definiciones.
Los parámetros que describen el rendimiento de la celda, como la potencia de lanzamiento, se miden en pequeñas celdas de prueba de varios diseños que tienen como objetivo reproducir condiciones similares a las que se encuentran en el baño de revestimiento de producción. [9]

La celda de Haring-Blum se utiliza para determinar el poder de macroproyección de un baño de revestimiento. La celda consta de dos cátodos paralelos con un ánodo fijo en el medio. Los cátodos se encuentran a una distancia del ánodo de 1:5. El poder de proyección macro se calcula a partir del espesor del revestimiento de los dos cátodos cuando pasa una corriente continua durante un período de tiempo específico. La celda está hecha de metacrilato o vidrio. [12] [13]

La celda Hull es un tipo de celda de prueba que se utiliza para verificar semicuantitativamente el estado de un baño de galvanoplastia. Mide el rango de densidad de corriente utilizable, la optimización de la concentración de aditivos, el reconocimiento de los efectos de las impurezas y la indicación de la capacidad de potencia de lanzamiento de macros. [14] La celda Hull replica el baño de revestimiento a escala de laboratorio. Se llena con una muestra de la solución de revestimiento, un ánodo apropiado que está conectado a un rectificador . El "trabajo" se reemplaza con un panel de prueba de celda de casco que se revestirá para mostrar la "salud" del baño.
La celda Hull es un recipiente trapezoidal que contiene 267 mililitros de una solución de baño de revestimiento. Esta forma permite colocar el panel de prueba en ángulo con respecto al ánodo. Como resultado, el depósito se recubre con un rango de densidades de corriente a lo largo de su longitud, que se puede medir con una regla de celda del casco. El volumen de la solución permite una medición semicuantitativa de la concentración del aditivo: 1 gramo añadido a 267 ml equivale a 0,5 oz/gal en el tanque de revestimiento. [15]
La galvanoplastia cambia las propiedades químicas, físicas y mecánicas de la pieza de trabajo. Un ejemplo de cambio químico es cuando el niquelado mejora la resistencia a la corrosión. Un ejemplo de cambio físico es un cambio en la apariencia exterior. Un ejemplo de cambio mecánico es un cambio en la resistencia a la tracción o la dureza de la superficie , que es un atributo requerido en la industria de herramientas. [16] La galvanoplastia de oro ácido en circuitos subyacentes revestidos de cobre o níquel reduce la resistencia de contacto y la dureza de la superficie. Las áreas de acero dulce recubiertas de cobre actúan como una máscara si no se desea el endurecimiento de dichas áreas. El acero estañado está cromado para evitar el embotamiento de la superficie debido a la oxidación del estaño.
Existen varios procesos alternativos para producir recubrimientos metálicos sobre sustratos sólidos que no implican reducción electrolítica:


Se ha teorizado que la primera galvanoplastia se realizó en la era del Imperio Parto . Wilhelm König, asistente del Museo Nacional de Irak, había observado en la década de 1930 una serie de objetos de plata muy finos del antiguo Irak, recubiertos con capas muy finas de oro, y especuló que estaban galvanizados [17] [ referencia circular ] . Corroboró su idea refiriéndose a una posible batería parta descubierta en 1938 cerca de la metrópoli de Ctesifonte , la capital de los imperios parto (150 a. C. - 223 d. C.) y sasánida (224-650 d. C.) de Persia . Sin embargo, esto ha sido ampliamente desacreditado por los investigadores. Sin embargo, los arqueólogos modernos coinciden en general en que los objetos vistos por König en realidad no estaban galvanizados, sino más bien dorados al fuego con mercurio. Por lo tanto, no se conocen ejemplos de objetos de la antigua Mesopotamia que puedan describirse de manera confiable como que muestren signos de galvanoplastia. [18]
La galvanoplastia fue inventada por el químico italiano Luigi Valentino Brugnatelli en 1805. Brugnatelli utilizó el invento de su colega Alessandro Volta de cinco años antes, la pila voltaica , para facilitar la primera electrodeposición. Los inventos de Brugnatelli fueron suprimidos por la Academia de Ciencias de Francia y no se utilizaron en la industria general durante los siguientes treinta años. En 1839, científicos de Gran Bretaña y Rusia habían ideado de forma independiente procesos de deposición de metales similares al de Brugnatelli para la galvanoplastia de cobre de planchas de imprenta .

Boris Jacobi en Rusia no sólo redescubrió los galvanoplásticos, sino que también desarrolló la electrotipificación y la escultura galvanoplástica . Los galvanoplásticos se pusieron rápidamente de moda en Rusia, y personas como el inventor Peter Bagration , el científico Heinrich Lenz y el autor de ciencia ficción Vladimir Odoyevsky contribuyeron a un mayor desarrollo de la tecnología. Entre los casos más notorios de uso de galvanoplastia en la Rusia de mediados del siglo XIX se encuentran las gigantescas esculturas galvanoplásticas de la Catedral de San Isaac en San Petersburgo y la cúpula galvanizada en oro de la Catedral de Cristo Salvador en Moscú , la iglesia ortodoxa más alta del mundo . [19]

Poco después, John Wright de Birmingham , Inglaterra, descubrió que el cianuro de potasio era un electrolito adecuado para la galvanoplastia de oro y plata. Los asociados de Wright, George Elkington y Henry Elkington, obtuvieron las primeras patentes para la galvanoplastia en 1840. Estos dos fundaron luego la industria de la galvanoplastia en Birmingham , desde donde se extendió por todo el mundo. El generador eléctrico Woolrich de 1844, ahora en Thinktank, Museo de Ciencias de Birmingham , es el primer generador eléctrico utilizado en la industria. [20] Fue utilizado por los Elkington . [21] [22] [23]
La Norddeutsche Affinerie de Hamburgo fue la primera planta moderna de galvanoplastia que inició su producción en 1876. [24]
A medida que la ciencia de la electroquímica creció, se comprendió su relación con la galvanoplastia y se desarrollaron otros tipos de galvanoplastia de metales no decorativos. En la década de 1850 se desarrolló la galvanoplastia comercial de níquel , latón , estaño y zinc . Los baños y equipos de galvanoplastia basados en las patentes de los Elkington se ampliaron para dar cabida al revestimiento de numerosos objetos a gran escala y para aplicaciones específicas de fabricación e ingeniería.
La industria del revestimiento recibió un gran impulso con la llegada del desarrollo de generadores eléctricos a finales del siglo XIX. Con las corrientes más altas disponibles, los componentes metálicos de máquinas, hardware y piezas de automóviles que requieren protección contra la corrosión y propiedades de desgaste mejoradas, además de una mejor apariencia, podrían procesarse a granel.
Las dos guerras mundiales y la creciente industria de la aviación dieron impulso a mayores desarrollos y refinamientos, incluidos procesos como el cromado duro , el revestimiento de aleaciones de bronce , el revestimiento de níquel con sulfamato, junto con muchos otros procesos de revestimiento. Los equipos de revestimiento evolucionaron desde tanques de madera revestidos de alquitrán operados manualmente hasta equipos automatizados, capaces de procesar miles de kilogramos por hora de piezas.
Uno de los primeros proyectos del físico estadounidense Richard Feynman fue desarrollar una tecnología para galvanizar metal sobre plástico . Feynman desarrolló la idea original de su amigo hasta convertirla en un invento exitoso, que permitió a su empleador (y amigo) cumplir las promesas comerciales que había hecho pero que de otra manera no habría podido cumplir. [25]