
Un ion carbenio es un ion positivo con la estructura RR′R″C + , es decir, una especie química con un átomo de carbono que tiene tres enlaces covalentes y lleva una carga formal +1 . Los iones carbenio son un subconjunto principal de carbocationes , que es un término general para los cationes diamagnéticos basados en carbono. En paralelo con los iones carbenio hay otro subconjunto de carbocationes, los iones carbonio con la fórmula R 5 + . En los iones carbenio la carga está localizada. Son isoelectrónicos con mono boranos como B(CH 3 ) 3 . [2]
Los iones de carbenio son generalmente muy reactivos debido a que tienen un octeto incompleto de electrones; sin embargo, ciertos iones de carbenio, como el ion tropilio , son relativamente estables debido a que la carga positiva está deslocalizada entre los átomos de carbono.
Los iones de carbenio a veces se reorganizan fácilmente. Por ejemplo, cuando se calienta pentan-3-ol con HCl acuoso, el carbocatión 3-pentilo formado inicialmente se reorganiza en una mezcla de 3-pentilo y 2-pentilo. Estos cationes reaccionan con el ion cloruro para producir 3-cloropentano y 2-cloropentano en una proporción de aproximadamente 1:2. [3] [ cita completa requerida ] También se observa la migración de un grupo alquilo para formar un nuevo centro carbocatiónico. [4] Esto ocurre a menudo con constantes de velocidad superiores a 10 10 s −1 a temperatura ambiente y todavía tiene lugar rápidamente (en comparación con la escala de tiempo de RMN) a temperaturas tan bajas como −120 °C ( ver desplazamiento de Wagner-Meerwein ). En casos especialmente favorables como el catión 2-norbornilo, los desplazamientos de hidrógeno pueden tener lugar a velocidades lo suficientemente rápidas como para interferir con la cristalografía de rayos X a 86 K (−187 °C). [5] Normalmente, los carbocationes se reorganizarán para dar un isómero terciario. Por ejemplo, todos los isómeros de C 6 H+11Los cationes 3-pentilo se reorganizan rápidamente para dar el catión 1-metil-1-ciclopentilo. Este hecho a menudo complica las vías sintéticas. Por ejemplo, cuando se calienta el 3-pentanol con HCl acuoso, el carbocatión 3-pentilo formado inicialmente se reorganiza en una mezcla estadística del 3-pentilo y el 2-pentilo. Estos cationes reaccionan con el ion cloruro para producir aproximadamente un tercio de 3-cloropentano y dos tercios de 2-cloropentano. La alquilación de Friedel-Crafts sufre esta limitación; por esta razón, la acilación (seguida de la reducción de Wolff-Kishner o Clemmensen para dar el producto alquilado) se aplica con más frecuencia.
Los carbocationes son susceptibles al ataque de nucleófilos , como agua, alcoholes, carboxilatos, azidas e iones haluro, para formar el producto de adición. Los nucleófilos fuertemente básicos, especialmente los impedidos, prefieren la eliminación sobre la adición. Debido a que incluso los nucleófilos débiles reaccionarán con los carbocationes, la mayoría solo se pueden observar o aislar directamente en medios no nucleofílicos como los superácidos . [6]
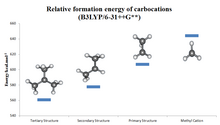
El orden de estabilidad de los carbocationes, del más estable al menos estable, tal como se refleja en los valores de afinidad del ion hidruro (HIA), es el siguiente (valores de HIA en kcal/mol entre paréntesis):
Dado que los iones de carbenio pueden ser altamente reactivos, una consideración importante es su estabilidad. La estabilidad de los iones de carbenio se correlaciona con las propiedades donadoras de electrones de los sustituyentes. Los iones de trialquilcarbenio, como (CH 3 ) 3 C + , son aislables como sales, pero H 3 C + no. Una situación análoga se aplica a los iones de triarilcarbenio: las sales de trifenilcarbenio (C 5 H 5 ) 3 C + son fácilmente aislables (véase tritilo ), y aquellas con sustituyentes de amina tan robustos que se utilizan como tintes, por ejemplo, violeta cristal . Los iones de carbenio también pueden estabilizarse por conjugación a dobles enlaces dando cationes alilo, que disfrutan de cierta estabilización por resonancia . Esta situación se ilustra con el aislamiento de benceno protonado. [7] Los heteroátomos que llevan pares solitarios también estabilizan los iones de carbenio. [8]

La estabilidad de los carbocationes sustituidos con alquilo sigue el orden 3° > 2° > 1° > metilo . Esta tendencia se puede inferir por los valores de afinidad del ion hidruro (231, 246, 273 y 312 kcal/mol para (CH 3 ) 3 C + , (CH 3 ) 2 CH + , CH 3 CH+2, y CH+3). [9] El efecto de la sustitución de alquilo es fuerte:
Los iones de carbenio se pueden preparar directamente a partir de alcanos eliminando un anión hidruro , H−
, con un ácido fuerte. Por ejemplo, el ácido mágico , una mezcla de pentafluoruro de antimonio ( SbF
5) y ácido fluorosulfúrico ( FSO
3H ), convierte el isobutano en el catión trimetilcarbenio, (CH
3)
3do+
. [18] [19]

Un carbocatión puede estabilizarse por resonancia mediante un doble enlace carbono-carbono o mediante el par solitario de un heteroátomo adyacente al carbono ionizado. El catión alilo CH 2 =CH−CH+2y catión bencilo C 6 H 5 −CH+2son más estables que la mayoría de los otros iones de carbenio debido a la donación de densidad electrónica de los sistemas π al centro catiónico. [20] Los carbocationes doble y triplemente bencílicos, el catión difenilcarbenio y el catión trifenilcarbenio (tritilo), son particularmente estables. Por las mismas razones, el carácter p parcial de los enlaces C–C tensos en los grupos ciclopropilo también permite la donación de densidad electrónica [21] y estabiliza el catión ciclopropilmetilo (ciclopropilcarbinilo).
Los iones oxocarbenio e iminio tienen importantes formas canónicas secundarias (estructuras de resonancia) en las que el carbono lleva una carga positiva. Como tales, son carbocationes según la definición de la IUPAC, aunque algunos químicos no los consideran carbocationes "verdaderos", ya que sus contribuyentes de resonancia más importantes llevan la carga positiva formal en un átomo de oxígeno o nitrógeno, respectivamente.

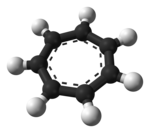
El ion tropilio es una especie aromática con la fórmula C
7yo+
7. [22] Su nombre deriva de la molécula tropina (a su vez llamada así por la molécula atropina ). Las sales del catión tropilio pueden ser estables, por ejemplo, el tetrafluoroborato de tropilio . Puede fabricarse a partir de cicloheptatrieno (tropilideno) y bromo o pentacloruro de fósforo . [23]
Es un ion plano, cíclico y heptagonal ; además posee 6 electrones π (4 n + 2, donde n = 1), lo que cumple la regla de aromaticidad de Hückel . Puede coordinarse como ligando a átomos metálicos .
La estructura mostrada es un compuesto de siete contribuyentes de resonancia en el que cada carbono lleva parte de la carga positiva.
En 1891, G. Merling obtuvo una sal soluble en agua a partir de una reacción de cicloheptatrieno y bromo. [24] La estructura fue dilucidada por Eggers Doering y Knox en 1954. [25] [26]
Por otra parte, el catión antiaromático ciclopentadienilo ( C 5 H+5) se desestabiliza en unas 40 kcal/mol.
Otro ion carbenio aromático es el ion ciclopropenilo o ciclopropenio , C
3yo+
3. [27] Aunque menos estable que el catión tropilio, este ion carbenio también puede formar sales a temperatura ambiente. Las soluciones de dichas sales exhiben propiedades espectroscópicas y químicas convencionales. El catión ciclopropenio ( C 3 H+3), aunque algo desestabilizado por la tensión angular, todavía está claramente estabilizado por la aromaticidad en comparación con su análogo de cadena abierta, el catión alilo.
Además, estas estabilidades catiónicas variables, que dependen del número de electrones π en el sistema de anillos, pueden ser factores cruciales en la cinética de la reacción. La formación de un carbocatión aromático es mucho más rápida que la formación de un carbocatión antiaromático o de cadena abierta.

Un ion arenio es un catión ciclohexadienilo que aparece como un intermedio reactivo en la sustitución aromática electrofílica . [28] Por razones históricas, este complejo también se denomina intermedio de Wheland , [29] o complejo σ .
Dos átomos de hidrógeno unidos a un carbono se encuentran en un plano perpendicular al anillo de benceno. [30] El ion arenio ya no es una especie aromática; sin embargo, es relativamente estable debido a la deslocalización: la carga positiva está deslocalizada en 5 átomos de carbono. También contribuye a la estabilidad de los iones arenio la ganancia de energía resultante del fuerte enlace Ce (E = electrófilo).
El ion arenio más pequeño es el benceno protonado , C
6yo+
7El ion benceno se puede aislar como un compuesto estable cuando el benceno es protonado por el superácido carborano , H(CB 11 H(CH 3 ) 5 Br 6 ). [31] La sal de benceno es cristalina con estabilidad térmica hasta 150 °C. Las longitudes de enlace deducidas de la cristalografía de rayos X son consistentes con una estructura de catión ciclohexadienilo.
Un ion acilio es un catión con la fórmula RCO + . [32] La estructura se describe como R−C≡O + o R−=O. Es un carbocatión de acilo, pero la estructura real tiene el oxígeno y el carbono unidos por un triple enlace. Estas especies son intermediarios reactivos comunes, por ejemplo, en las acilaciones de Friedel−Crafts y también en muchas otras reacciones orgánicas como la transposición de Hayashi . Las sales que contienen iones de acilio se pueden generar mediante la eliminación del haluro de los haluros de acilo :
La distancia C–O en estos cationes es cercana a 1,1 ångströms , incluso más corta que la del monóxido de carbono . [33] Los cationes acilio son fragmentos característicos observados en los espectros de masas EI de las cetonas .
Basándose en la afinidad por el ion hidruro, el catión vinilo original es menos estable que incluso un carbocatión hibridado sp 2 primario , mientras que un catión vinilo sustituido con α alquilo tiene una estabilidad comparable a la de este último. Por tanto, los cationes vinilo son intermediarios relativamente poco comunes. Se pueden generar por la ionización de un electrófilo vinílico, siempre que el grupo saliente sea suficientemente bueno (p. ej., TfO − , IPh o N 2 ). Se los ha implicado como intermediarios en algunas reacciones de sustitución vinílica (designadas como S N 1(vinilo)) y como intermediarios en las reacciones de adición electrofílica de arilalquinos. Con excepción del catión vinilo original, que se cree que es una especie puenteada, y los cationes vinílicos cíclicos geométricamente restringidos, la mayoría de los cationes vinilo adoptan hibridación sp y son lineales.
Los cationes arilo son menos estables que los cationes vinilo debido a la distorsión forzada por el anillo a una geometría no lineal y al carácter aproximadamente sp 2 del orbital desocupado. Solo el N 2 en las sales de arildiazonio es un grupo saliente lo suficientemente bueno para la generación química de cationes arilo. [34]
Los cationes alquinilo son extremadamente inestables, mucho menos estables incluso que el CH+
3(afinidad del ion hidruro 386 kcal/mol frente a 312 kcal/mol para CH+
3) y no pueden generarse por medios puramente químicos. Sin embargo, pueden generarse radioquímicamente mediante la desintegración beta del tritio : [35]

Los iones de carbenio están tan integrados en la química orgánica que sería largo realizar un inventario completo de sus reacciones comercialmente útiles. Por ejemplo, el craqueo catalítico , un paso importante en la refinación del petróleo, involucra intermediarios de iones de carbenio. [36]
La alquilación del benceno con alfa-olefinas para formar alquilbenceno lineal (LAB) ilustra el comportamiento de los iones carbenio secundarios. La alquilación se inicia con ácidos fuertes. Los LAB son un precursor clave de los detergentes .
Los derivados del trifenilcarbenio son los colorantes triarilmetano . [37]
Los iones acilio son intermediarios en las acilaciones de Friedel-Crafts y en las reacciones de Koch .