
Dictyostelium discoideum es una especie de ameba que habita en el suelo perteneciente al filo Amoebozoa , infrafilo Mycetozoa . Comúnmente conocido como moho limoso , D. discoideum es un eucariota que pasa de una colección de amebas unicelulares a una babosa multicelular y luego a un cuerpo fructífero durante su vida. Su ciclo de vida asexual único consta de cuatro etapas: vegetativa, agregación, migración y culminación. El ciclo de vida de D. discoideum es relativamente corto, lo que permite visualizar oportunamente todas las etapas. Las células involucradas en el ciclo de vida experimentan movimiento, señalización química y desarrollo, que son aplicables a la investigación del cáncer humano. La simplicidad de su ciclo de vida convierte a D. discoideum en un organismo modelo valioso para estudiar procesos genéticos, celulares y bioquímicos en otros organismos. [2]
En la naturaleza, D. discoideum se puede encontrar en el suelo y en la hojarasca húmeda. Su dieta principal se compone de bacterias , como Escherichia coli , que se encuentran en el suelo y materia orgánica en descomposición. Las amebas uninucleadas de D. discoideum consumen bacterias que se encuentran en su hábitat natural, que incluye suelo de bosque caducifolio y hojas en descomposición. [3]
El ciclo de vida de D. discoideum comienza cuando se liberan esporas de un sorocarpio maduro (cuerpo fructífero). Las mixamoebas eclosionan de las esporas en condiciones cálidas y húmedas. Durante su etapa vegetativa, las mixamebas se dividen por mitosis mientras se alimentan de bacterias. Las bacterias secretan ácido fólico , que atrae a las mixamebas. Cuando se agota el suministro de bacterias, las mixamoebas entran en la etapa de agregación.
Durante la agregación, la inanición inicia la producción de compuestos proteicos como glicoproteínas y adenilil ciclasa . [4] Las glicoproteínas permiten la adhesión entre células y la adenilil ciclasa crea AMP cíclico . Las amebas secretan AMP cíclico para atraer células vecinas a una ubicación central. A medida que avanzan hacia la señal, chocan entre sí y se mantienen unidos mediante el uso de moléculas de adhesión de glicoproteínas.
La etapa de migración comienza una vez que las amebas han formado un agregado apretado y el montículo alargado de células se inclina para quedar plano en el suelo. Las amebas trabajan juntas como un pseudoplasmodio móvil, también conocido como babosa. La babosa mide entre 2 y 4 mm de largo, está compuesta por hasta 100.000 células [5] y es capaz de moverse produciendo una vaina de celulosa en sus células anteriores a través de la cual se mueve la babosa. [6] Parte de esta vaina queda atrás como un rastro viscoso a medida que se mueve hacia atrayentes como la luz , el calor y la humedad en una dirección únicamente hacia adelante. [6] El AMP cíclico y una sustancia llamada factor inductor de diferenciación ayudan a formar diferentes tipos de células. [6] La babosa se diferencia en células pretallo y prespora que se mueven hacia los extremos anterior y posterior, respectivamente. Una vez que la babosa ha encontrado un ambiente adecuado, el extremo anterior de la babosa forma el tallo del cuerpo fructífero y el extremo posterior forma las esporas del cuerpo fructífero. [6] Las células de tipo anterior, que se han descubierto recientemente, también se encuentran dispersas por toda la región posterior de la babosa. Estas células anteriores forman la parte inferior del cuerpo fructífero y las tapas de las esporas. [6] Después de que la babosa se asienta en un lugar, el extremo posterior se extiende con el extremo anterior elevado en el aire, formando lo que se llama el "sombrero mexicano", y comienza la etapa de culminación.
Las células pretallo y presporas cambian de posición en la etapa de culminación para formar el cuerpo fructífero maduro. [6] El extremo anterior del sombrero mexicano forma un tubo de celulosa, que permite que las células más posteriores suban por el exterior del tubo hasta la parte superior, y las células pretallo se muevan hacia abajo. [6] Este reordenamiento forma el tallo del cuerpo fructífero formado por las células del extremo anterior de la babosa, y las células del extremo posterior de la babosa están en la parte superior y ahora forman las esporas del cuerpo fructífero. Al final de este proceso de 8 a 10 horas, el cuerpo fructífero maduro está completamente formado. [6] Este cuerpo fructífero mide entre 1 y 2 mm de altura y ahora puede comenzar el ciclo completo nuevamente liberando las esporas maduras que se convierten en mixamoebas.
Aunque D. discoideum generalmente se reproduce de forma asexual , D. discoideum todavía es capaz de reproducirse sexualmente si se cumplen ciertas condiciones. D. discoideum tiene tres tipos de apareamiento diferentes y los estudios han identificado el locus sexual que especifica estos tres tipos de apareamiento. Las cepas de tipo I están especificadas por el gen llamado MatA, las cepas de tipo II tienen tres genes diferentes: MatB (homólogo de Mat A), Mat C y Mat D, y las cepas de tipo III tienen genes Mat S y Mat T (que son homólogos a Mat A). Tapete C y Tapete D). [7] Estos sexos sólo pueden aparearse con los dos sexos diferentes y no con el suyo propio. [7]
Cuando se incuban con su suministro de alimento bacteriano, puede ocurrir un desarrollo sexual heterotálico u homotálico , lo que resulta en la formación de un cigoto diploide. [8] [9] El apareamiento heterotálico ocurre cuando dos amebas de diferentes tipos de apareamiento están presentes en un ambiente oscuro y húmedo, donde pueden fusionarse durante la agregación para formar una célula cigoto gigante. Luego, la célula gigante libera AMPc para atraer a otras células y luego envuelve a las otras células de manera caníbal en el agregado. Las células consumidas sirven para encerrar todo el agregado en una gruesa pared de celulosa para protegerlo. Esto se conoce como macroquiste . Dentro del macroquiste, la célula gigante se divide primero mediante meiosis y luego mediante mitosis para producir muchas amebas haploides que serán liberadas para alimentarse como lo harían las amebas normales. Las cepas homotálicas de D. discoideum AC4 y ZA3A también pueden producir macroquistes. [10] Cada una de estas cepas, a diferencia de las cepas heterotálicas, probablemente expresa ambos alelos de tipo de apareamiento ( matA y mata ). Si bien la reproducción sexual es posible, es muy raro ver la germinación exitosa de un macroquiste de D. discoideum en condiciones de laboratorio. Sin embargo, la recombinación está muy extendida dentro de las poblaciones naturales de D. discoideum , lo que indica que el sexo es probablemente un aspecto importante de su ciclo de vida. [9]
Debido a que muchos de sus genes son homólogos a los genes humanos, aunque su ciclo de vida es simple, D. discoideum se utiliza comúnmente como organismo modelo . Se puede observar a niveles orgánicos, celulares y moleculares principalmente debido a su número restringido de tipos y comportamientos celulares y su rápido crecimiento. [6] Se utiliza para estudiar la diferenciación celular, la quimiotaxis y la apoptosis , que son procesos celulares normales. También se utiliza para estudiar otros aspectos del desarrollo, incluida la clasificación celular, la formación de patrones, la fagocitosis, la motilidad y la transducción de señales. [11] Estos procesos y aspectos del desarrollo están ausentes o son demasiado difíciles de ver en otros organismos modelo. D. discoideum está estrechamente relacionado con los metazoos superiores. Lleva genes y vías similares, lo que lo convierte en un buen candidato para la desactivación genética . [12]
El proceso de diferenciación celular ocurre cuando una célula se vuelve más especializada para convertirse en un organismo multicelular. Pueden ocurrir cambios de tamaño, forma, actividades metabólicas y capacidad de respuesta como resultado de ajustes en la expresión genética. La diversidad y diferenciación celular, en esta especie, implica decisiones tomadas a partir de interacciones célula-célula en vías hacia células tallo o células esporas. [13] Estos destinos celulares dependen de su entorno y formación de patrones. Por tanto, el organismo es un excelente modelo para estudiar la diferenciación celular.
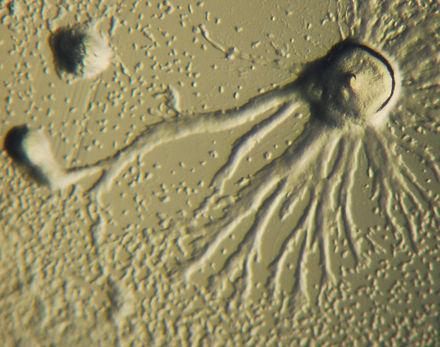
La quimiotaxis se define como el paso de un organismo hacia o desde un estímulo químico a lo largo de un gradiente de concentración química. Ciertos organismos demuestran quimiotaxis cuando se dirigen hacia un suministro de nutrientes. En D. discoideum , la ameba secreta la señal, AMPc, fuera de la célula, atrayendo a otras amebas para que migren hacia la fuente. Cada ameba se mueve hacia una ameba central, la que dispensa la mayor cantidad de secreciones de AMPc. Luego, todas las amebas exhiben la secreción de AMPc y es una llamada para que comiencen a agregarse. Estas emisiones químicas y el movimiento de las amebas ocurren cada seis minutos. Las amebas se mueven hacia el gradiente de concentración durante 60 segundos y se detienen hasta que se envía la siguiente secreción. Este comportamiento de las células individuales tiende a provocar oscilaciones en un grupo de células, y ondas químicas de concentración variable de AMPc se propagan a través del grupo en espirales. [14] : 174-175
Los biólogos matemáticos Thomas Höfer y Martin Boerlijst descubrieron un elegante conjunto de ecuaciones matemáticas que reproduce las espirales y los patrones de flujo de D. discoideum . El biólogo matemático Cornelis J. Weijer ha demostrado que ecuaciones similares pueden modelar su movimiento. Las ecuaciones de estos patrones están influenciadas principalmente por la densidad de la población de amebas, la tasa de producción de AMP cíclico y la sensibilidad de las amebas individuales al AMP cíclico. El patrón en espiral está formado por amebas en el centro de una colonia que giran mientras envían ondas de AMP cíclico. [15] [16]
El uso de AMPc como agente quimiotáctico no está establecido en ningún otro organismo. En biología del desarrollo, este es uno de los ejemplos comprensibles de quimiotaxis, que es importante para comprender la inflamación humana, la artritis, el asma, el tráfico de linfocitos y la guía de los axones. La fagocitosis se utiliza en la vigilancia inmune y la presentación de antígenos, mientras que la determinación del tipo de célula, la clasificación de células y la formación de patrones son características básicas de la embriogénesis que pueden estudiarse con estos organismos. [6]
Sin embargo, tenga en cuenta que las oscilaciones de AMPc pueden no ser necesarias para la migración celular colectiva en etapas multicelulares. Un estudio ha descubierto que la señalización mediada por AMPc cambia de ondas en propagación a un estado estable en una etapa multicelular de D. discoideum. [17]
La termotaxis es el movimiento a lo largo de un gradiente de temperatura. Se ha demostrado que las babosas migran a lo largo de gradientes extremadamente poco profundos de sólo 0,05 °C/cm, pero la dirección elegida es complicada; parece estar alejado de una temperatura unos 2 °C inferior a la temperatura a la que se habían aclimatado. Este complicado comportamiento ha sido analizado mediante modelos informáticos del comportamiento y el patrón periódico de cambios de temperatura en el suelo causados por los cambios diarios en la temperatura del aire. La conclusión es que este comportamiento mueve las babosas unos centímetros por debajo de la superficie del suelo hasta la superficie. Se trata de un comportamiento sorprendentemente sofisticado de un organismo primitivo sin aparente sentido de gravedad. [14] : 108-109
La apoptosis (muerte celular programada) es una parte normal del desarrollo de las especies. [4] La apoptosis es necesaria para el espaciamiento y la escultura adecuados de órganos complejos. Alrededor del 20% de las células de D. discoideum se sacrifican de forma altruista en la formación del cuerpo fructífero maduro. Durante la etapa pseudoplasmodium (babosa o grex) de su ciclo de vida, el organismo ha formado tres tipos principales de células: pretallo, prespora y células similares a anteriores. Durante la culminación, las células pretallo secretan una capa de celulosa y se extienden como un tubo a través del grex. [4] A medida que se diferencian, forman vacuolas y se agrandan, levantando las células presporas. Las células del tallo sufren apoptosis y mueren a medida que las células presporas se elevan por encima del sustrato. Las células de prespora luego se convierten en células de espora, y cada una de ellas se convierte en una nueva mixameba al dispersarse. [6] Este es un ejemplo de cómo se utiliza la apoptosis en la formación de un órgano reproductivo, el cuerpo fructífero maduro.
Una importante contribución reciente de la investigación sobre Dictyostelium proviene de nuevas técnicas que permiten visualizar la actividad de genes individuales en células vivas. [18] Esto ha demostrado que la transcripción se produce en "ráfagas" o "pulsos" ( explosión transcripcional ) en lugar de seguir un comportamiento probabilístico o continuo simple. La transcripción explosiva ahora parece conservarse entre bacterias y humanos. Otra característica notable del organismo es que tiene conjuntos de enzimas reparadoras del ADN que se encuentran en las células humanas, de las que carecen muchos otros sistemas modelo de metazoos populares. [19] Los defectos en la reparación del ADN conducen a cánceres humanos devastadores, por lo que la capacidad de estudiar las proteínas reparadoras humanas en un modelo simple y manejable resultará invaluable.
La capacidad de este organismo para aislarse y cultivarse fácilmente en el laboratorio [6] [20] aumenta su atractivo como organismo modelo. Si bien D. discoideum se puede cultivar en cultivo líquido, generalmente se cultiva en placas de Petri que contienen agar nutritivo y las superficies se mantienen húmedas. Los cultivos crecen mejor a una temperatura de 22 a 24 °C (temperatura ambiente). D. discoideum se alimenta principalmente de E. coli , que es adecuada para todas las etapas del ciclo de vida. Cuando el suministro de alimento disminuye, las mixamebas se agregan para formar pseudoplasmodios. Pronto, el plato pasa por varias etapas del ciclo de vida. Revisar el plato a menudo permite realizar observaciones detalladas del desarrollo. Las células pueden recolectarse en cualquier etapa de desarrollo y crecer rápidamente.
Al cultivar D. discoideum en un laboratorio, es importante tener en cuenta sus respuestas de comportamiento. Por ejemplo, tiene afinidad por la luz, las temperaturas más altas, la alta humedad, las bajas concentraciones iónicas y el lado ácido del gradiente de pH. A menudo se realizan experimentos para ver cómo las manipulaciones de estos parámetros obstaculizan, detienen o aceleran el desarrollo. Las variaciones de estos parámetros pueden alterar la tasa y la viabilidad del crecimiento del cultivo. Además, los cuerpos fructíferos, al ser esta la etapa de desarrollo más alta, responden muy bien a las corrientes de aire y a los estímulos físicos. Se desconoce si existe algún estímulo involucrado en la liberación de esporas.
El análisis detallado de la expresión de proteínas en Dictyostelium se ha visto obstaculizado por grandes cambios en el perfil de expresión de proteínas entre las diferentes etapas de desarrollo y una falta general de anticuerpos disponibles comercialmente para los antígenos de Dictyostelium . [21] En 2013, un grupo del Centro Oncológico Beatson West of Scotland informó sobre un estándar de visualización de proteínas sin anticuerpos para inmunotransferencia basado en la detección de MCCC1 utilizando conjugados de estreptavidina . [22]
El género bacteriano Legionella incluye la especie que causa la enfermedad del legionario en humanos. D. discoideum también es huésped de Legionella y es un modelo adecuado para estudiar el proceso de infección. [23] Específicamente, D. discoideum comparte con las células huésped de mamíferos un citoesqueleto similar y procesos celulares relevantes para la infección por Legionella , incluida la fagocitosis , el tráfico de membranas, la endocitosis , la clasificación de vesículas y la quimiotaxis.
Un informe de 2011 en Nature publicó hallazgos que demostraban un "comportamiento agrícola primitivo" en las colonias de D. discoideum . [24] [25] Descrito como una " simbiosis " entre D. discoideum y presas bacterianas, aproximadamente un tercio de las colonias de D. discoideum recolectadas en el medio silvestre participaron en la " cría " de las bacterias cuando las bacterias se incluyeron dentro del moho limoso. cuerpos fructíferos. [25] La incorporación de las bacterias en los cuerpos fructíferos permite la "siembra" de la fuente de alimento en el lugar de dispersión de las esporas, lo cual es particularmente valioso si la nueva ubicación tiene pocos recursos alimenticios. [25] Las colonias producidas a partir de las esporas "cultivadas" normalmente también muestran el mismo comportamiento cuando esporulan. Esta incorporación tiene un costo asociado: aquellas colonias que no consumen todas las bacterias presa producen esporas más pequeñas que no pueden dispersarse tan ampliamente. Además, existen muchos menos beneficios para las esporas que contienen bacterias que caen en una región rica en alimentos. Este equilibrio de costos y beneficios del comportamiento puede contribuir al hecho de que una minoría de colonias de D. discoideum se dedique a esta práctica. [24] [25]
D. discoideum es conocido por comer bacterias Gram positivas y Gram negativas , pero algunas de las bacterias fagocitadas, incluidos algunos patógenos humanos, [26] pueden vivir en las amebas y salir sin matar la célula. Se desconoce cuándo ingresan a la celda, dónde residen y cuándo salen de la celda. La investigación aún no es concluyente, pero es posible trazar un ciclo de vida general de D. discoideum adaptado para que los clones de agricultores comprendan mejor este proceso simbiótico.

In the picture, one can see the different stages. First, in the starvation stage, bacteria are enclosed within D. discoideum,[26] after entry into amoebae, in a phagosome the fusion with lysosomes is blocked and these unmatured phagosomes are surrounded by host cell organelles such as mitochondria, vesicles, and a multilayer membrane derived from the rough endoplasmic reticulum (RER) of amoebae. The role of the RER in the intracellular infection is not known, but the RER is not required as a source of proteins for the bacteria.[27]The bacteria reside within these phagosomes during the aggregation and the multicellular development stages. The amoebae preserve their individuality and each amoeba has its own bacterium. During the culmination stage, when the spores are produced, the bacteria pass from the cell to the sorus with the help of a cytoskeletal structure that prevents host cell destruction.[28] Some results suggest the bacteria exploit the exocytosis without killing the cell.[28]Free-living amoebae seem to play a crucial role for persistence and dispersal of some pathogens in the environment. Transient association with amoebae has been reported for a number of different bacteria, including Legionella pneumophila, many Mycobacterium species, Francisella tularensis, and Escherichia coli, among others.[27] Agriculture seems to play a crucial role for pathogens' survival, as they can live and replicate inside D. discoideum, making husbandry. Nature’s report has made an important advance in the knowledge of amoebic behavior, and the famous Spanish phrase translated as “you are more stupid than an amoeba” is losing the sense because amoebae are an excellent example of social behavior with an amazing coordination and sense of sacrifice for the benefit of the species.[citation needed]
Sentinel cells in Dictyostelium discoideum are phagocytic cells responsible for removing toxic material from the slug stage of the social cycle. Generally round in shape, these cells are present within the slug sheath where they are found to be circulating freely. The detoxification process occurs when these cells engulf toxins and pathogens within the slug through phagocytosis. Then, the cells clump into groups of five to ten cells, which then attach to the inner sheath of the slug. The sheath is sloughed off as the slug migrates to a new site in search of food bacteria.
Las células centinela constituyen aproximadamente el 1% del número total de células de babosas, y el número de células centinela permanece constante incluso cuando se liberan. Esto indica una regeneración constante de células centinela dentro de las babosas a medida que se eliminan junto con toxinas y patógenos. Las células centinela están presentes en la babosa incluso cuando no hay toxinas ni patógenos que eliminar. Se han localizado células centinela en otras cinco especies de Dictyostelia , lo que sugiere que las células centinela pueden describirse como una característica general del sistema inmunológico innato en las amebas sociales. [29]
El número de células centinela varía según el estado de cultivo de D. discoideum silvestre . Cuando se expusieron a un ambiente tóxico creado por el uso de bromuro de etidio, se demostró que el número de células centinela por milímetro era menor para los agricultores que para los no agricultores. Esto se concluyó observando los rastros que dejaban las babosas a medida que migraban y contando el número de células centinela presentes en un milímetro. Sin embargo, la cantidad de células centinela no afecta la producción de esporas ni la viabilidad en los agricultores. Los agricultores expuestos a un ambiente tóxico producen la misma cantidad de esporas que los agricultores en un ambiente no tóxico, y la viabilidad de las esporas fue la misma entre los agricultores y los no agricultores. Cuando se eliminan de los agricultores el Clado 2 Burkholderia , o bacterias asociadas a los agricultores, la producción de esporas y la viabilidad fueron similares a las de los no agricultores. Por lo tanto, se sugiere que las bacterias transportadas por los agricultores proporcionen una función adicional de protección contra posibles daños debidos a toxinas o patógenos. [30]
En clasificaciones más antiguas, Dictyostelium se colocó en la extinta clase polifilética Acrasiomycetes . Esta era una clase de mohos limosos celulares, que se caracterizaba por la agregación de amebas individuales en un cuerpo fructífero multicelular, lo que lo convertía en un factor importante que relacionaba a los acrasidos con los dictyostélidos. [31]
Estudios genómicos más recientes han demostrado que Dictyostelium ha mantenido más diversidad de su genoma ancestral que las plantas y los animales, aunque la filogenia basada en proteomas confirma que los amebozoos divergieron del linaje animal-fúngico después de la división planta-animal. [32] La subclase Dictyosteliidae, orden Dictyostelidae, es un conjunto monofilético dentro de los micetozoos, un grupo que incluye los mohos mucilaginosos protostélidos, dictyostelidos y mixogástricos. Los análisis de datos del factor de elongación-1α (EF-1α) respaldan a los micetozoos como un grupo monofilético, aunque los árboles de ARNr lo ubican como un grupo polifilético. Además, estos datos apoyan la idea de que el dictyostelido y el mixogastrido están más estrechamente relacionados entre sí que los protostélidos. El análisis de EF-1α también colocó a los micetozoos como el grupo externo inmediato del clado animal-fúngico. [33] Los datos filogenéticos más recientes sitúan a los dictyostélidos firmemente dentro del supergrupo Amoebozoa , junto con los mixomicetos . Mientras tanto, los protostélidos han resultado ser polifiléticos y sus cuerpos fructíferos con tallos son una característica convergente de múltiples linajes no relacionados. [34]
El proyecto de secuenciación del genoma de D. discoideum se completó y publicó en 2005 gracias a una colaboración internacional de institutos. Este fue el primer genoma de un protozoo de vida libre secuenciado por completo. D. discoideum consta de un genoma haploide de 34 Mb con una composición de bases del 77% [A+T] y contiene seis cromosomas que codifican alrededor de 12.500 proteínas. [3] La secuenciación del genoma de D. discoideum proporciona un estudio más complejo de su biología celular y del desarrollo.
Las repeticiones en tándem de trinucleótidos son muy abundantes en este genoma; una clase del genoma está agrupada, lo que lleva a los investigadores a creer que sirve como centrómeros. Las repeticiones corresponden a secuencias repetidas de aminoácidos y se cree que se expanden mediante expansión de nucleótidos. [3] La expansión de las repeticiones de trinucleótidos también ocurre en humanos, lo que en general conduce a muchas enfermedades. Aprender cómo las células de D. discoideum soportan estas repeticiones de aminoácidos puede proporcionar información que permita a los humanos tolerarlas.
Cada genoma secuenciado juega un papel importante en la identificación de genes que se han ganado o perdido con el tiempo. Los estudios genómicos comparativos permiten comparar genomas eucariotas. Una filogenia basada en el proteoma demostró que los amebozoos se desviaron del linaje animal-fúngico después de la división entre planta y animal. [3] El genoma de D. discoideum es digno de mención porque sus numerosas proteínas codificadas se encuentran comúnmente en hongos, plantas y animales. [3]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )