El cristalino , o cristalino , es una estructura biconvexa transparente en la mayoría de los ojos de los vertebrados terrestres . Junto con la córnea , los humores acuoso y vítreo , refracta la luz y la enfoca en la retina . En muchos animales terrestres, la forma de la lente se puede alterar, cambiando efectivamente la distancia focal del ojo, permitiéndoles enfocar objetos a distintas distancias. Este ajuste de la lente se conoce como acomodación (ver también más abajo). En muchos vertebrados totalmente acuáticos, como los peces, se utilizan otros métodos de acomodación, como cambiar la posición del cristalino en relación con la retina en lugar de cambiar la forma del cristalino. La acomodación es análoga al enfoque de una cámara fotográfica cambiando sus lentes . En los vertebrados terrestres, el cristalino es más plano en su lado anterior que en su lado posterior, mientras que en los peces el cristalino suele ser casi esférico.
La acomodación en los seres humanos está bien estudiada y permite utilizar medios artificiales para complementar nuestra concentración, como gafas para corregir la vista a medida que envejecemos. El poder refractivo de una lente humana más joven en su entorno natural es de aproximadamente 18 dioptrías , aproximadamente un tercio del poder total del ojo de aproximadamente 60 dioptrías. A los 25 años, la capacidad del cristalino para alterar la trayectoria de la luz se ha reducido a 10 dioptrías y la acomodación continúa disminuyendo con la edad.
El cristalino está ubicado hacia la parte frontal del ojo de los vertebrados llamado segmento anterior , que incluye la córnea y el iris colocados frente al cristalino. El cristalino se mantiene en su lugar mediante los ligamentos suspensorios (Zónula de Zinn) , [1] uniendo el cristalino en su ecuador al resto del ojo [2] [3] a través del cuerpo ciliar . Detrás del cristalino se encuentra el cuerpo vítreo gelatinoso que ayuda a mantener el cristalino en su lugar. En la parte frontal de la lente se encuentra el humor acuoso líquido que baña la lente con nutrientes y otras cosas. Las lentes de los vertebrados terrestres suelen tener una forma elipsoide y biconvexa. La superficie frontal es menos curvada que la trasera. En un adulto humano, la lente suele tener unos 10 mm de diámetro y 4 mm de grosor, aunque cambia de forma con la acomodación y el tamaño debido a que crece a lo largo de la vida de la persona. [4]




El cristalino tiene tres partes principales: la cápsula del cristalino , el epitelio del cristalino y las fibras del cristalino. La cápsula del cristalino es una membrana basal relativamente gruesa que forma la capa más externa del cristalino. Dentro de la cápsula, fibras del cristalino mucho más delgadas forman la mayor parte del cristalino. Las células del epitelio del cristalino forman una capa delgada entre la cápsula del cristalino y la capa más externa de fibras del cristalino en la parte frontal del cristalino, pero no en la parte posterior. El cristalino en sí carece de nervios, vasos sanguíneos o tejido conectivo. [5] Los anatomistas a menudo se refieren a las posiciones de las estructuras en la lente describiéndola como un globo terráqueo. La parte delantera y trasera de la lente se denominan "polos" anterior y posterior, al igual que los polos norte y sur. El "ecuador" es el borde exterior del cristalino, a menudo oculto por el iris, y es el área de mayor diferenciación celular. Como el ecuador generalmente no se encuentra en el camino de la luz del ojo, las estructuras involucradas en la actividad metabólica evitan la dispersión de la luz que de otro modo afectaría la visión.


La cápsula del cristalino es una membrana basal lisa y transparente que rodea completamente el cristalino. La cápsula es elástica y su principal componente estructural es el colágeno . Se presume que es sintetizado por el epitelio del cristalino y sus componentes principales en orden de abundancia son el proteoglicano heparán sulfato ( glucosaminoglicanos sulfatados (GAG)), entactina, colágeno tipo IV y laminina. [6] La cápsula es muy elástica y, por lo tanto, permite que el cristalino adopte una forma más esférica cuando se reduce la tensión de los ligamentos suspensorios. La cápsula humana varía de 2 a 28 micrómetros de espesor, siendo más gruesa cerca del ecuador (región periecuatorial) y generalmente más delgada cerca del polo posterior. [4] La fotografía tomada con un microscopio electrónico muestra un área de la cápsula cerca del ecuador donde se une uno de los miles de ligamentos suspensorios. [7]

La fijación debe ser lo suficientemente fuerte como para evitar que el ligamento se desprenda de la cápsula del cristalino. Las fuerzas se generan al sostener la lente en su lugar y se suman al enfocar. La cápsula anterior y posterior es más delgada.
El epitelio del cristalino es una capa única de células en la parte frontal del cristalino, entre la cápsula del cristalino y las fibras del cristalino. [4] Al proporcionar nutrientes a las fibras del cristalino y eliminar los desechos, las células del epitelio regulan el mantenimiento de la homeostasis del cristalino . [8] A medida que los iones, los nutrientes y el líquido ingresan al cristalino desde el humor acuoso , las bombas Na + /K + -ATPasa en las células epiteliales del cristalino bombean iones fuera del cristalino para mantener la concentración y el volumen osmótico apropiados del cristalino, con el cristalino colocado ecuatorialmente. Las células del epitelio que más contribuyen a esta corriente. La actividad de las Na + /K + -ATPasas mantiene el agua y la corriente fluyendo a través de la lente desde los polos y saliendo por las regiones ecuatoriales.
Las células del epitelio del cristalino también se dividen en nuevas fibras del cristalino en el ecuador del cristalino. [9] El cristalino deposita fibras desde que se forma por primera vez en el embrión hasta la muerte. [10]
Las fibras del cristalino forman la mayor parte del cristalino. Son células largas, delgadas y transparentes, firmemente empaquetadas, con diámetros típicos de 4 a 7 micrómetros y longitudes de hasta 12 mm de largo en los humanos. [4] Las fibras del cristalino se extienden longitudinalmente desde el polo posterior al anterior y, cuando se cortan horizontalmente, se organizan en capas concéntricas, como las capas de una cebolla. Si se corta a lo largo del ecuador, parece un panal. La mitad aproximada de cada fibra se encuentra alrededor del ecuador. [10] Estas capas apretadas de fibras de lentes se conocen como láminas. Los citoplasmas de las fibras del cristalino están unidos entre sí a través de uniones hendidas , puentes intercelulares e interdigitaciones de las células que se asemejan a formas de "bola y cavidad".
El cristalino se divide en regiones según la edad de las fibras del cristalino de una capa particular. Avanzando hacia afuera desde la capa central, la más antigua, el cristalino se divide en un núcleo embrionario, el núcleo fetal, el núcleo adulto y la corteza interna y externa. Nuevas fibras del cristalino, generadas a partir del epitelio del cristalino, se añaden a la corteza exterior. Las fibras maduras del cristalino no tienen orgánulos ni núcleos .


Con la llegada de otras formas de observar las estructuras celulares del cristalino en el animal vivo, se hizo evidente que las regiones de las células fibrosas, al menos en la parte anterior del cristalino, contienen grandes vacíos y vacuolas. Se especula que están involucrados en los sistemas de transporte de lentes que unen la superficie de la lente con regiones más profundas. [11] Estructuras de aspecto muy similar también indican fusión celular en el cristalino. La fusión celular se muestra mediante microinyección para formar un sincitio estratificado en cultivos de lentes completos. [9]

El desarrollo del cristalino de los vertebrados comienza cuando el embrión humano mide unos 4 mm de largo. La imagen adjunta muestra el proceso en un embrión de pollo más fácil de estudiar. A diferencia del resto del ojo, que se deriva principalmente de las capas internas del embrión , el cristalino se deriva de la piel que rodea al embrión . La primera etapa de formación del cristalino tiene lugar cuando una esfera de células formada por la gemación de las capas internas del embrión se acerca a la piel externa del embrión. La esfera de células induce a la piel exterior cercana a comenzar a transformarse en la placoda del cristalino . La placoda del cristalino es la primera etapa de transformación de un parche de piel en el cristalino. En esta etapa temprana, la placoda del cristalino es una sola capa de células . [12] [13]
A medida que avanza el desarrollo, la placoda del cristalino comienza a profundizarse y a inclinarse hacia adentro. A medida que la placoda continúa profundizándose, la abertura del ectodermo de la superficie se contrae [14] y las células del cristalino se desprenden de la piel del embrión para formar una esfera de células conocida como "vesícula del cristalino". Cuando el embrión mide unos 10 mm de largo, la vesícula del cristalino se ha separado completamente de la piel del embrión.
Luego, el embrión envía señales desde la retina en desarrollo, induciendo que las células más cercanas al extremo posterior de la vesícula del cristalino se alarguen hacia el extremo anterior de la vesícula. [14] Estas señales también inducen la síntesis de proteínas llamadas cristalinas . [15] Como sugiere el nombre, las cristalinas pueden formar una gelatina transparente altamente refractiva. Estas células alargadas eventualmente llenan el centro de la vesícula con células, que son largas y delgadas como un mechón de cabello, llamadas fibras. Estas fibras primarias se convierten en el núcleo del cristalino maduro. Las células epiteliales que no se forman en fibras más cercanas al frente del cristalino dan origen al epitelio del cristalino.

Las fibras adicionales se derivan de las células epiteliales del cristalino ubicadas en el ecuador del cristalino. Estas células se alargan hacia el frente y hacia atrás envolviendo las fibras ya depositadas. Las nuevas fibras deben ser más largas para cubrir las fibras anteriores, pero a medida que la lente se hace más grande, los extremos de las fibras más nuevas ya no llegan tan lejos hacia la parte delantera y trasera de la lente. Las fibras del cristalino que no llegan a los polos forman costuras estrechas y entrelazadas con las fibras vecinas. Estas costuras, al ser menos cristalinas que la mayor parte de la lente, son más visibles y se denominan "suturas". Los patrones de sutura se vuelven más complejos a medida que se agregan más capas de fibras del cristalino a la parte exterior del cristalino.
El cristalino continúa creciendo después del nacimiento, y las nuevas fibras secundarias se agregan como capas externas. Se generan nuevas fibras del cristalino a partir de las células ecuatoriales del epitelio del cristalino, en una región denominada "zona germinativa" y "región del arco". Las células epiteliales del cristalino se alargan, pierden contacto con la cápsula y el epitelio en la parte posterior y frontal del cristalino, sintetizan cristalina y finalmente pierden sus núcleos (enuclean) a medida que se convierten en fibras maduras del cristalino. En los seres humanos, a medida que el cristalino crece depositando más fibras hasta la edad adulta temprana, el cristalino adquiere una forma más elipsoide. Después de aproximadamente 20 años, el cristalino vuelve a volverse redondo y el iris es muy importante para este desarrollo. [4]
Varias proteínas controlan el desarrollo embrionario del cristalino, aunque PAX6 se considera el gen regulador maestro de este órgano. [16] Otros efectores del desarrollo adecuado de la lente incluyen los componentes de señalización Wnt BCL9 y Pygo2 . [17] Todo el proceso de diferenciación de las células epiteliales en células de fibra llenas de cristalina sin orgánulos ocurre dentro de los límites de la cápsula del cristalino. Las células más viejas no se pueden desprender y, en cambio, se internalizan hacia el centro del cristalino. Este proceso da como resultado un registro completo en capas temporales del proceso de diferenciación desde el inicio en la superficie de la lente hasta el final en el centro de la lente. Por tanto, la lente es valiosa para los científicos que estudian el proceso de diferenciación celular. [18]

En muchos vertebrados acuáticos, la lente es considerablemente más gruesa, casi esférica, lo que provoca una mayor refracción de la luz. Esta diferencia ayuda a compensar el menor ángulo de refracción entre la córnea del ojo y el ambiente acuoso, ya que tienen índices de refracción más similares que la córnea y el aire. [19] Las células fibrosas de los peces son generalmente considerablemente más delgadas que las de los vertebrados terrestres y parece que las proteínas cristalinas se transportan desde las células libres de orgánulos en el exterior del cristalino hasta las células internas a través de muchas capas de células. [20] Algunos vertebrados necesitan ver bien tanto por encima como por debajo del agua en ocasiones. Un ejemplo son las aves buceadoras, que tienen la capacidad de cambiar el enfoque entre 50 y 80 dioptrías. En comparación con los animales adaptados a un solo entorno, las aves buceadoras tienen una estructura del cristalino y de la córnea algo alterada con mecanismos de enfoque que permiten ambos entornos. [21] [22] Incluso entre los animales terrestres, el cristalino de los primates , como los humanos, es inusualmente plano, lo que explica de alguna manera por qué nuestra visión, a diferencia de las aves buceadoras, es particularmente borrosa bajo el agua. [23]


En los seres humanos, el mecanismo de enfoque de Helmholtz, ampliamente citado, también llamado acomodación , a menudo se denomina "modelo". [24] La prueba experimental directa de cualquier modelo de lente es necesariamente difícil ya que la lente de los vertebrados es transparente y sólo funciona bien en los animales vivos. Al considerar todos los vertebrados, los aspectos de todos los modelos pueden desempeñar diferentes roles en el enfoque de la lente.

El modelo de una lente humana que cambia de forma fue propuesto por Young en una conferencia el 27 de noviembre de 1800. [25] Otros, como Helmholtz y Huxley, refinaron el modelo a mediados del siglo XIX explicando cómo el músculo ciliar se contrae rodeando la lente para enfocar cerca. [26] y este modelo fue popularizado por Helmholtz en 1909. [27] [28] El modelo se puede resumir así. Normalmente, el cristalino se mantiene bajo tensión mediante los ligamentos de suspensión que se tensan por la presión del globo ocular. A una distancia focal corta, el músculo ciliar se contrae, aliviando parte de la tensión en los ligamentos, lo que permite que la lente se redondee un poco elásticamente, aumentando el poder refractivo. Cambiar el enfoque a un objeto a mayor distancia requiere una lente más delgada y menos curvada. Esto se logra relajando algunos de los esfínteres como los músculos ciliares. Si bien no se hace referencia, esto presumiblemente permite que la presión en el globo ocular lo expanda nuevamente hacia afuera, tirando con más fuerza de la lente, haciéndola menos curvada y más delgada, aumentando así la distancia focal . Hay un problema con el modelo de Helmholtz porque, a pesar de que se han probado modelos matemáticos, ninguno se ha acercado lo suficiente a funcionar utilizando únicamente los mecanismos de Helmholtz. [29]

Schachar propuso un modelo para vertebrados terrestres que no fue bien recibido. [30] La teoría permite que el modelado matemático refleje con mayor precisión la forma en que el cristalino enfoca y al mismo tiempo tenga en cuenta las complejidades de los ligamentos suspensorios y la presencia de músculos radiales y circulares en el cuerpo ciliar. [31] [32] En este modelo, los ligamentos pueden tirar en diversos grados del cristalino en el ecuador utilizando los músculos radiales, mientras que los ligamentos desplazados desde el ecuador hacia adelante y hacia atrás [33] se relajan en diversos grados contrayendo el círculo. músculos. [34] Estas múltiples acciones [35] que operan sobre la lente elástica le permiten cambiar la forma de la lente en la parte frontal de manera más sutil. No solo cambia el enfoque, sino que también corrige las aberraciones de la lente que de otro modo podrían resultar del cambio de forma y, al mismo tiempo, se ajusta mejor al modelado matemático. [29]
El modelo " catenaria " de enfoque del cristalino propuesto por Coleman [36] exige menos tensión sobre los ligamentos que suspenden el cristalino. En lugar de que la lente en su conjunto se estire más delgada para la visión de lejos y se le permita relajarse para enfocar de cerca, la contracción de los músculos ciliares circulares da como resultado que la lente tenga menos presión hidrostática contra su frente. Luego, el frente de la lente puede reformar su forma entre los ligamentos suspensorios de manera similar a como una cadena floja que cuelga entre dos polos podría cambiar su curva cuando los polos se acercan. Este modelo requiere un movimiento fluido del frente de la lente únicamente en lugar de intentar cambiar la forma de la lente en su conjunto.


Cuando Thomas Young propuso el cambio de la forma del cristalino humano como mecanismo de acomodación focal en 1801, pensó que el cristalino podría ser un músculo capaz de contraerse. Este tipo de modelo se denomina acomodación intracapsular ya que depende de la actividad dentro del cristalino. En una conferencia Nobel de 1911, Allvar Gullstrand habló sobre "Cómo encontré el mecanismo de acomodación intracapsular" y este aspecto del enfoque del cristalino sigue investigándose. [37] [38] [39] Young pasó tiempo buscando los nervios que podrían estimular la contracción del cristalino, sin éxito. Desde entonces quedó claro que el cristalino no es un simple músculo estimulado por un nervio, por lo que el modelo Helmholtz de 1909 tuvo prioridad. Los investigadores anteriores al siglo XX no se beneficiaron de muchos descubrimientos y técnicas posteriores. Las proteínas de membrana, como las acuaporinas , que permiten que el agua fluya dentro y fuera de las células, son las proteínas de membrana más abundantes en el cristalino. [40] [41] También prevalecen las conexinas que permiten el acoplamiento eléctrico de las células. La microscopía electrónica y la microscopía inmunofluorescente muestran que las células fibrosas tienen una estructura y composición muy variables. [42] [43] [44] Las imágenes por resonancia magnética confirman una estratificación en la lente que puede permitir diferentes planes refractivos dentro de ella. [45] El índice de refracción del cristalino humano varía desde aproximadamente 1,406 en las capas centrales hasta 1,386 en las capas menos densas del cristalino. [46] Este gradiente de índice mejora la potencia óptica de la lente. A medida que se aprende más sobre la estructura del cristalino de los mamíferos a partir de fotografías in situ de Scheimpflug , resonancias magnéticas [47] [48] e investigaciones fisiológicas, se hace evidente que el cristalino en sí no responde de forma completamente pasiva al músculo ciliar circundante, pero puede cambiar su refracción general. índice a través de mecanismos que involucran la dinámica del agua en la lente aún por aclarar. [49] [50] [51] La micrografía adjunta muestra fibras arrugadas de una lente de oveja relajada después de retirarla del animal, lo que indica un acortamiento de las fibras de la lente durante la acomodación del enfoque cercano. Los cambios relacionados con la edad en el cristalino humano también pueden estar relacionados con cambios en la dinámica del agua en el cristalino. [52] [53]
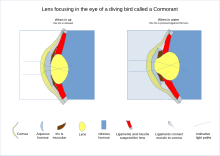

En reptiles y aves , el cuerpo ciliar que sostiene el cristalino a través de ligamentos suspensorios también toca el cristalino con una serie de almohadillas en su superficie interna. Estas almohadillas comprimen y liberan la lente para modificar su forma mientras enfocas objetos a diferentes distancias; Los ligamentos suspensorios suelen realizar esta función en los mamíferos . En la visión de peces y anfibios , la lente tiene una forma fija y, en cambio, el enfoque se logra moviendo la lente hacia adelante o hacia atrás dentro del ojo usando un músculo llamado retractor lentus. [23]
En los peces cartilaginosos , los ligamentos suspensorios son reemplazados por una membrana, que incluye un pequeño músculo en la parte inferior del cristalino. Este músculo empuja la lente hacia adelante desde su posición relajada cuando enfoca objetos cercanos. En los teleósteos , por el contrario, un músculo se proyecta desde una estructura vascular en el suelo del ojo, llamado proceso falciforme , y sirve para tirar del cristalino hacia atrás desde la posición relajada para enfocar objetos distantes. Si bien los anfibios mueven el cristalino hacia adelante, al igual que los peces cartilaginosos, los músculos involucrados no son similares en ninguno de los dos tipos de animales. En las ranas , hay dos músculos, uno encima y otro debajo del cristalino, mientras que otros anfibios tienen sólo el músculo inferior. [23]
En los vertebrados más simples, las lampreas y los mixinos , la lente no está adherida en absoluto a la superficie exterior del globo ocular. No hay humor acuoso en estos peces y el cuerpo vítreo simplemente presiona la lente contra la superficie de la córnea. Para enfocar sus ojos, una lamprea aplana la córnea usando músculos fuera del ojo y empuja el cristalino hacia atrás. [23]
Si bien no son vertebrados, aquí se hace una breve mención de la evolución convergente de los ojos de los vertebrados y los moluscos . El ojo de molusco más complejo es el ojo de cefalópodo , que tiene una estructura y función superficialmente similar a la de un ojo de vertebrado, incluida la acomodación, aunque se diferencia en aspectos básicos, como tener una lente de dos partes y no tener córnea. [54] [55] Los requisitos fundamentales de la óptica deben ser cubiertos por todos los ojos con lentes utilizando los tejidos a su disposición para que, superficialmente, todos los ojos tiendan a verse similares. Lo que varía entre los animales es la forma en que se cumplen los requisitos ópticos utilizando diferentes tipos de células y mecanismos estructurales.

Las cristalinas son proteínas solubles en agua que componen más del 90% de la proteína del cristalino. [56] Los tres tipos principales de cristalinas que se encuentran en el ojo humano son las cristalinas α, β y γ. Las cristalinas tienden a formar agregados solubles de alto peso molecular que se empaquetan firmemente en las fibras de la lente, aumentando así el índice de refracción de la lente mientras se mantiene su transparencia. Las cristalinas β y γ se encuentran principalmente en el cristalino, mientras que se han aislado subunidades de cristalina α de otras partes del ojo y del cuerpo. Las proteínas α-cristalina pertenecen a una superfamilia más grande de proteínas chaperonas moleculares , por lo que se cree que las proteínas cristalinas fueron reclutadas evolutivamente a partir de proteínas chaperonas con fines ópticos. [57] Las funciones chaperonas de la α-cristalina también pueden ayudar a mantener las proteínas del cristalino, que deben durar en un ser humano durante toda su vida. [57]
Otro factor importante para mantener la transparencia del cristalino es la ausencia de orgánulos que dispersen la luz, como el núcleo , el retículo endoplásmico y las mitocondrias dentro de las fibras maduras del cristalino. [58] Las fibras del cristalino también tienen un citoesqueleto muy extenso que mantiene la forma y el empaquetamiento precisos de las fibras del cristalino; Las alteraciones/mutaciones en ciertos elementos del citoesqueleto pueden provocar la pérdida de transparencia. [59]
La lente bloquea la mayor parte de la luz ultravioleta en el rango de longitud de onda de 300 a 400 nm; Las longitudes de onda más cortas son bloqueadas por la córnea. El pigmento responsable de bloquear la luz es el glucósido de 3-hidroxiquinurenina , producto del catabolismo del triptófano en el epitelio del cristalino. [60] La luz ultravioleta de alta intensidad puede dañar la retina y, por lo tanto, se fabrican lentes intraoculares artificiales para bloquear también la luz ultravioleta. [61] Las personas que carecen de lentes (una condición conocida como afaquia ) perciben la luz ultravioleta como azul blanquecina o violeta blanquecina. [62] [63]
El cristalino es metabólicamente activo y requiere nutrición para mantener su crecimiento y transparencia. Sin embargo, en comparación con otros tejidos del ojo, el cristalino tiene unas demandas de energía considerablemente menores. [64]
A las nueve semanas de desarrollo humano, el cristalino está rodeado y nutrido por una red de vasos, la túnica vasculosa lentis , que se deriva de la arteria hialoidea . [15] A partir del cuarto mes de desarrollo, la arteria hialoidea y su vasculatura relacionada comienzan a atrofiarse y desaparecen por completo al nacer. [65] En el ojo posnatal, el canal de Cloquet marca la antigua ubicación de la arteria hialoidea.

Después de la regresión de la arteria hialoidea, el cristalino recibe toda su nutrición del humor acuoso. Los nutrientes entran y los desechos salen a través de un flujo constante de líquido desde los polos anterior/posterior del cristalino y fuera de las regiones ecuatoriales, una dinámica que se mantiene mediante las bombas Na + /K + -ATPasa ubicadas en las células situadas ecuatorialmente. del epitelio del cristalino. [8] La interacción de estas bombas con canales de agua en células llamadas acuaporinas, moléculas de menos de 100 daltons de tamaño entre las células a través de uniones comunicantes y calcio mediante transportadores/reguladores (canales TRPV) da como resultado un flujo de nutrientes a través del cristalino. [66] [67]
La glucosa es la principal fuente de energía del cristalino. Como las fibras maduras del cristalino no tienen mitocondrias , aproximadamente el 80% de la glucosa se metaboliza mediante metabolismo anaeróbico . [68] La fracción restante de glucosa se desvía principalmente por la vía de las pentosas fosfato . [68] La falta de respiración aeróbica significa que la lente consume muy poco oxígeno. [68]