Un ciclo biogeoquímico , o más generalmente un ciclo de la materia , [1] es el movimiento y transformación de elementos y compuestos químicos entre organismos vivos, la atmósfera y la corteza terrestre. Los principales ciclos biogeoquímicos incluyen el ciclo del carbono , el ciclo del nitrógeno y el ciclo del agua . En cada ciclo, el elemento químico o molécula es transformado y reciclado por organismos vivos y a través de varias formas geológicas y reservorios, incluyendo la atmósfera, el suelo y los océanos. Puede considerarse como la vía por la cual una sustancia química recicla (se renueva o se mueve a través de) el compartimento biótico y los compartimentos abióticos de la Tierra . El compartimento biótico es la biosfera y los compartimentos abióticos son la atmósfera , la litosfera y la hidrosfera .
Por ejemplo, en el ciclo del carbono, el dióxido de carbono atmosférico es absorbido por las plantas a través de la fotosíntesis , que lo convierte en compuestos orgánicos que son utilizados por los organismos para obtener energía y crecer. Luego, el carbono se libera nuevamente a la atmósfera a través de la respiración y la descomposición . Además, el carbono se almacena en combustibles fósiles y se libera a la atmósfera a través de actividades humanas como la quema de combustibles fósiles . En el ciclo del nitrógeno, el gas nitrógeno atmosférico es convertido por las plantas en formas utilizables como amoníaco y nitratos a través del proceso de fijación de nitrógeno . Estos compuestos pueden ser utilizados por otros organismos, y el nitrógeno se devuelve a la atmósfera a través de la desnitrificación y otros procesos. En el ciclo del agua, el disolvente universal agua se evapora de la tierra y los océanos para formar nubes en la atmósfera, y luego se precipita de regreso a diferentes partes del planeta. La precipitación puede filtrarse en el suelo y convertirse en parte de los sistemas de agua subterránea utilizados por las plantas y otros organismos, o puede escurrirse de la superficie para formar lagos y ríos. El agua subterránea puede entonces filtrarse al océano junto con las descargas de los ríos , ricas en materia orgánica disuelta y particulada y otros nutrientes.
Existen ciclos biogeoquímicos para muchos otros elementos, como el oxígeno , el hidrógeno , el fósforo , el calcio , el hierro , el azufre , el mercurio y el selenio . También hay ciclos para moléculas, como el agua y el sílice . Además, existen ciclos macroscópicos, como el ciclo de las rocas , y ciclos inducidos por el hombre para compuestos sintéticos, como los bifenilos policlorados (PCB). En algunos ciclos hay depósitos geológicos donde las sustancias pueden permanecer o quedar secuestradas durante largos períodos de tiempo.
Los ciclos biogeoquímicos implican la interacción de procesos biológicos, geológicos y químicos. Los procesos biológicos incluyen la influencia de los microorganismos , que son impulsores críticos del ciclo biogeoquímico. Los microorganismos tienen la capacidad de llevar a cabo una amplia gama de procesos metabólicos esenciales para el ciclo de nutrientes y sustancias químicas en los ecosistemas globales. Sin microorganismos, muchos de estos procesos no ocurrirían, con un impacto significativo en el funcionamiento de los ecosistemas terrestres y oceánicos y los ciclos biogeoquímicos del planeta en su conjunto. Los cambios en los ciclos pueden afectar la salud humana. Los ciclos están interconectados y desempeñan funciones importantes en la regulación del clima, el apoyo al crecimiento de plantas , fitoplancton y otros organismos, y el mantenimiento de la salud de los ecosistemas en general. Las actividades humanas, como la quema de combustibles fósiles y el uso de grandes cantidades de fertilizantes, pueden alterar los ciclos, lo que contribuye al cambio climático, la contaminación y otros problemas ambientales.


La energía fluye direccionalmente a través de los ecosistemas, entrando como luz solar (o moléculas inorgánicas para los quimioautótrofos ) y saliendo como calor durante las muchas transferencias entre niveles tróficos . Sin embargo, la materia que compone los organismos vivos se conserva y se recicla. Los seis elementos más comunes asociados con las moléculas orgánicas (carbono, nitrógeno, hidrógeno, oxígeno, fósforo y azufre) toman una variedad de formas químicas y pueden existir durante largos períodos en la atmósfera, en la tierra, en el agua o debajo de la superficie de la Tierra. Los procesos geológicos, como la meteorización , la erosión , el drenaje de agua y la subducción de las placas continentales , juegan un papel en este reciclaje de materiales. Debido a que la geología y la química tienen papeles importantes en el estudio de este proceso, el reciclaje de materia inorgánica entre los organismos vivos y su entorno se llama ciclo biogeoquímico. [3]
Los seis elementos mencionados anteriormente son utilizados por los organismos de diversas maneras. El hidrógeno y el oxígeno se encuentran en el agua y en las moléculas orgánicas , ambos esenciales para la vida. El carbono se encuentra en todas las moléculas orgánicas, mientras que el nitrógeno es un componente importante de los ácidos nucleicos y las proteínas . El fósforo se utiliza para fabricar ácidos nucleicos y los fosfolípidos que componen las membranas biológicas . El azufre es fundamental para la forma tridimensional de las proteínas. El ciclo de estos elementos está interconectado. Por ejemplo, el movimiento del agua es fundamental para la lixiviación de azufre y fósforo en los ríos que luego pueden fluir hacia los océanos. Los minerales circulan a través de la biosfera entre los componentes bióticos y abióticos y de un organismo a otro. [4]
Los sistemas ecológicos ( ecosistemas ) tienen muchos ciclos biogeoquímicos que funcionan como parte del sistema, por ejemplo, el ciclo del agua, el ciclo del carbono, el ciclo del nitrógeno, etc. Todos los elementos químicos presentes en los organismos forman parte de los ciclos biogeoquímicos. Además de ser parte de los organismos vivos, estos elementos químicos también circulan a través de factores abióticos de los ecosistemas, como el agua ( hidrosfera ), la tierra ( litosfera ) y/o el aire ( atmósfera ). [5]
Los factores vivos del planeta pueden denominarse colectivamente biosfera . Todos los nutrientes (como el carbono , el nitrógeno , el oxígeno , el fósforo y el azufre ) que utilizan los organismos vivos en los ecosistemas forman parte de un sistema cerrado ; por lo tanto, estos productos químicos se reciclan en lugar de perderse y reponerse constantemente, como en un sistema abierto. [5]
Las partes principales de la biosfera están conectadas entre sí por el flujo de elementos y compuestos químicos en ciclos biogeoquímicos. En muchos de estos ciclos, la biota desempeña un papel importante. La materia del interior de la Tierra es liberada por los volcanes. La atmósfera intercambia algunos compuestos y elementos rápidamente con la biota y los océanos. Los intercambios de materiales entre rocas, suelos y océanos son generalmente más lentos en comparación. [2]
El flujo de energía en un ecosistema es un sistema abierto ; el Sol proporciona constantemente energía al planeta en forma de luz, que finalmente se utiliza y se pierde en forma de calor a lo largo de los niveles tróficos de una red alimentaria. El carbono se utiliza para fabricar carbohidratos, grasas y proteínas, las principales fuentes de energía alimentaria . Estos compuestos se oxidan para liberar dióxido de carbono, que puede ser capturado por las plantas para fabricar compuestos orgánicos. La reacción química se alimenta de la energía luminosa de la luz solar.
La luz del sol es necesaria para combinar el carbono con el hidrógeno y el oxígeno y formar una fuente de energía, pero los ecosistemas de las profundidades marinas , donde no puede penetrar la luz del sol, obtienen energía del azufre. El sulfuro de hidrógeno que se encuentra cerca de los respiraderos hidrotermales puede ser utilizado por organismos como el gusano tubícola gigante . En el ciclo del azufre , el azufre puede reciclarse para siempre como fuente de energía. La energía puede liberarse a través de la oxidación y reducción de compuestos de azufre (por ejemplo, oxidando el azufre elemental a sulfito y luego a sulfato ).
Aunque la Tierra recibe constantemente energía del Sol, su composición química es básicamente fija, ya que la materia adicional solo se añade ocasionalmente por los meteoritos. Como esta composición química no se repone como la energía, todos los procesos que dependen de estas sustancias químicas deben reciclarse. Estos ciclos incluyen tanto la biosfera viva como la litosfera , la atmósfera y la hidrosfera inertes .
Los ciclos biogeoquímicos pueden contrastarse con los ciclos geoquímicos . Estos últimos se ocupan únicamente de los yacimientos corticales y subcorticales, aunque algunos procesos de ambos se superponen.


El océano global cubre más del 70% de la superficie de la Tierra y es notablemente heterogéneo. Las áreas productivas marinas y los ecosistemas costeros comprenden una fracción menor del océano en términos de superficie, pero tienen un enorme impacto en los ciclos biogeoquímicos globales llevados a cabo por las comunidades microbianas , que representan el 90% de la biomasa del océano. [8] El trabajo en los últimos años se ha centrado en gran medida en el ciclo del carbono y los macronutrientes como el nitrógeno, el fósforo y el silicato: otros elementos importantes como el azufre o los oligoelementos han sido menos estudiados, lo que refleja problemas técnicos y logísticos asociados. [9] Cada vez más, estas áreas marinas, y los taxones que forman sus ecosistemas, están sujetos a una presión antropogénica significativa, lo que afecta la vida marina y el reciclaje de energía y nutrientes. [10] [11] [12] Un ejemplo clave es el de la eutrofización cultural , donde la escorrentía agrícola conduce al enriquecimiento de nitrógeno y fósforo de los ecosistemas costeros, aumentando enormemente la productividad que resulta en floraciones de algas , desoxigenación de la columna de agua y el lecho marino y mayores emisiones de gases de efecto invernadero, [13] con impactos locales y globales directos en los ciclos del nitrógeno y el carbono . Sin embargo, la escorrentía de materia orgánica desde el continente a los ecosistemas costeros es solo una de una serie de amenazas apremiantes que estresan a las comunidades microbianas debido al cambio global. El cambio climático también ha resultado en cambios en la criosfera , ya que los glaciares y el permafrost se derriten, lo que resulta en una estratificación marina intensificada , mientras que los cambios del estado redox en diferentes biomas están remodelando rápidamente los ensamblajes microbianos a un ritmo sin precedentes. [14] [15] [16] [17] [9]
Por lo tanto, el cambio global está afectando a procesos clave , incluida la productividad primaria , la fijación de CO2 y N2, la respiración/remineralización de materia orgánica y el hundimiento y enterramiento de CO2 fijado . [ 17] Además de esto, los océanos están experimentando un proceso de acidificación , con un cambio de ~0,1 unidades de pH entre el período preindustrial y la actualidad, lo que afecta a la química del tampón de carbonato / bicarbonato . A su vez, se ha informado que la acidificación afecta a las comunidades planctónicas , principalmente a través de efectos sobre los taxones calcificantes. [18] También hay evidencia de cambios en la producción de productos volátiles intermediarios clave, algunos de los cuales tienen marcados efectos de invernadero (por ejemplo, N 2 O y CH 4 , revisados por Breitburg en 2018, [15] debido al aumento de la temperatura global, la estratificación y desoxigenación de los océanos, impulsando hasta un 25 a 50% de la pérdida de nitrógeno del océano a la atmósfera en las llamadas zonas de mínimo de oxígeno [19] o zonas marinas anóxicas , [20] impulsadas por procesos microbianos. Otros productos, que son típicamente tóxicos para el necton marino , incluidas las especies de azufre reducido como H 2 S, tienen un impacto negativo para los recursos marinos como la pesca y la acuicultura costera. Si bien el cambio global se ha acelerado, ha habido un aumento paralelo en la conciencia de la complejidad de los ecosistemas marinos, y especialmente el papel fundamental de los microbios como impulsores del funcionamiento de los ecosistemas. [16] [9]
Los microorganismos impulsan gran parte del ciclo biogeoquímico en el sistema terrestre. [21] [22]
A veces, las sustancias químicas se almacenan durante largos períodos de tiempo en un lugar. Este lugar se denomina depósito y, por ejemplo, incluye depósitos de carbón que almacenan carbono durante un largo período de tiempo. [23] Cuando las sustancias químicas se almacenan solo durante períodos cortos de tiempo, se almacenan en depósitos de intercambio . Algunos ejemplos de depósitos de intercambio son las plantas y los animales. [23]
Las plantas y los animales utilizan el carbono para producir carbohidratos, grasas y proteínas, que luego pueden utilizarse para construir sus estructuras internas o para obtener energía. Las plantas y los animales utilizan temporalmente el carbono en sus sistemas y luego lo liberan nuevamente al aire o al medio circundante. En general, los reservorios son factores abióticos, mientras que los depósitos de intercambio son factores bióticos. El carbono se retiene durante un tiempo relativamente corto en las plantas y los animales en comparación con los depósitos de carbón. La cantidad de tiempo que una sustancia química se mantiene en un lugar se denomina tiempo de residencia o tiempo de recambio (también llamado tiempo de renovación o edad de salida). [23]
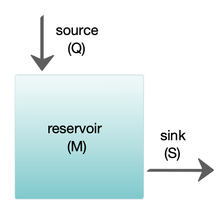
Los modelos de caja se utilizan ampliamente para modelar sistemas biogeoquímicos. [24] [25] Los modelos de caja son versiones simplificadas de sistemas complejos, reduciéndolos a cajas (o depósitos de almacenamiento ) para materiales químicos, conectados por flujos de materiales (flujos). Los modelos de caja simples tienen una pequeña cantidad de cajas con propiedades, como el volumen, que no cambian con el tiempo. Se supone que las cajas se comportan como si estuvieran mezcladas de manera homogénea. [25] Estos modelos se utilizan a menudo para derivar fórmulas analíticas que describen la dinámica y la abundancia en estado estacionario de las especies químicas involucradas.
El diagrama de la derecha muestra un modelo básico de una caja. El yacimiento contiene la cantidad de material M en consideración, según se define por propiedades químicas, físicas o biológicas. La fuente Q es el flujo de material hacia el yacimiento, y el sumidero S es el flujo de material que sale del yacimiento. El presupuesto es el control y equilibrio de las fuentes y los sumideros que afectan la rotación de material en un yacimiento. El yacimiento está en un estado estable si Q = S , es decir, si las fuentes equilibran a los sumideros y no hay cambios a lo largo del tiempo. [25]
El tiempo de residencia o de recambio es el tiempo medio que el material permanece residente en el yacimiento. Si el yacimiento está en estado estacionario, este es el mismo que el tiempo que tarda en llenarse o vaciarse. Por lo tanto, si τ es el tiempo de recambio, entonces τ = M / S . [25] La ecuación que describe la tasa de cambio del contenido en un yacimiento es
Cuando se conectan dos o más depósitos, se puede considerar que el material circula entre los depósitos y pueden existir patrones predecibles para el flujo cíclico. [25] Los modelos multibox más complejos generalmente se resuelven utilizando técnicas numéricas.

Los modelos de caja biogeoquímica global generalmente miden:
- Masas de reservorio en petagramos (Pg)
- flujos de flujo en petagramos por año (Pg yr −1 )
El diagrama de la izquierda muestra un presupuesto simplificado de los flujos de carbono oceánico. Está compuesto por tres modelos de caja simples interconectados, uno para la zona eufótica , uno para el interior del océano u océano oscuro y uno para los sedimentos oceánicos . En la zona eufótica, la producción neta de fitoplancton es de unos 50 Pg C cada año. Alrededor de 10 Pg se exportan al interior del océano mientras que los otros 40 Pg se respiran. La degradación del carbono orgánico se produce a medida que las partículas ( nieve marina ) se depositan en el interior del océano. Solo 2 Pg llegan finalmente al fondo marino, mientras que los otros 8 Pg se respiran en el océano oscuro. En los sedimentos, la escala de tiempo disponible para la degradación aumenta en órdenes de magnitud con el resultado de que el 90% del carbono orgánico entregado se degrada y solo 0,2 Pg C año −1 quedan finalmente enterrados y transferidos de la biosfera a la geosfera. [26]

El diagrama de la derecha muestra un modelo más complejo con muchos recuadros que interactúan. Las masas de los reservorios aquí representan las reservas de carbono , medidas en Pg C. Los flujos de intercambio de carbono, medidos en Pg C año −1 , ocurren entre la atmósfera y sus dos principales sumideros, la tierra y el océano. Los números y flechas negros indican la masa del reservorio y los flujos de intercambio estimados para el año 1750, justo antes de la Revolución Industrial . Las flechas rojas (y los números asociados) indican los cambios de flujo anuales debido a las actividades antropogénicas, promediados durante el período de tiempo 2000-2009. Representan cómo ha cambiado el ciclo del carbono desde 1750. Los números rojos en los reservorios representan los cambios acumulativos en el carbono antropogénico desde el comienzo del Período Industrial, 1750-2011. [28] [29] [27]

Existen ciclos biogeoquímicos rápidos y lentos. Los ciclos rápidos operan en la biosfera y los ciclos lentos operan en las rocas . Los ciclos rápidos o biológicos pueden completarse en años, moviendo sustancias de la atmósfera a la biosfera y luego de regreso a la atmósfera. Los ciclos lentos o geológicos pueden tardar millones de años en completarse, moviendo sustancias a través de la corteza terrestre entre las rocas, el suelo, el océano y la atmósfera. [31]
Como ejemplo, el ciclo rápido del carbono se ilustra en el diagrama que aparece a continuación, a la izquierda. Este ciclo implica procesos biogeoquímicos de plazo relativamente corto entre el medio ambiente y los organismos vivos en la biosfera. Incluye movimientos de carbono entre la atmósfera y los ecosistemas terrestres y marinos, así como entre los suelos y los sedimentos del fondo marino . El ciclo rápido incluye ciclos anuales que implican la fotosíntesis y ciclos decenales que implican el crecimiento vegetativo y la descomposición. Las reacciones del ciclo rápido del carbono a las actividades humanas determinarán muchos de los impactos más inmediatos del cambio climático. [32] [33] [34] [35]
El ciclo lento se ilustra en el diagrama de arriba a la derecha. Implica procesos geoquímicos de mediano a largo plazo que pertenecen al ciclo de las rocas . El intercambio entre el océano y la atmósfera puede durar siglos, y la erosión de las rocas puede durar millones de años. El carbono del océano se precipita al fondo oceánico, donde puede formar rocas sedimentarias y ser subducido al manto terrestre . Los procesos de formación de montañas dan como resultado el retorno de este carbono geológico a la superficie de la Tierra. Allí, las rocas se erosionan y el carbono regresa a la atmósfera mediante la desgasificación y al océano a través de los ríos. Otro carbono geológico regresa al océano a través de la emisión hidrotermal de iones de calcio. En un año determinado, entre 10 y 100 millones de toneladas de carbono se mueven en este ciclo lento. Esto incluye los volcanes que devuelven carbono geológico directamente a la atmósfera en forma de dióxido de carbono. Sin embargo, esto es menos del uno por ciento del dióxido de carbono que se libera a la atmósfera mediante la quema de combustibles fósiles. [31] [32]
El subsuelo terrestre es el mayor reservorio de carbono de la Tierra, y contiene entre 14 y 135 µg de carbono [36] y entre el 2 y el 19 % de toda la biomasa [37] . Los microorganismos impulsan las transformaciones de compuestos orgánicos e inorgánicos en este entorno y, por lo tanto, controlan los ciclos biogeoquímicos. El conocimiento actual de la ecología microbiana del subsuelo se basa principalmente en las secuencias de genes del ARN ribosómico (ARNr) 16S. Estimaciones recientes muestran que <8 % de las secuencias de ARNr 16S en bases de datos públicas derivan de organismos del subsuelo [38] y solo una pequeña fracción de ellas están representadas por genomas o aislados. Por lo tanto, hay muy poca información confiable sobre el metabolismo microbiano en el subsuelo. Además, se sabe poco sobre cómo están interconectados metabólicamente los organismos en los ecosistemas del subsuelo. Algunos estudios basados en cultivos de consorcios sintróficos [39] [40] [41] y análisis metagenómicos a pequeña escala de comunidades naturales [42] [43] [44] sugieren que los organismos están vinculados a través de transferencias metabólicas: la transferencia de productos de reacción redox de un organismo a otro. Sin embargo, no se han diseccionado entornos complejos lo suficientemente completos como para resolver las redes de interacción metabólica que los sustentan. Esto restringe la capacidad de los modelos biogeoquímicos para capturar aspectos clave de los ciclos del carbono y otros nutrientes. [45] Nuevos enfoques como la metagenómica resuelta por genoma, un enfoque que puede producir un conjunto integral de borradores e incluso genomas completos para organismos sin el requisito de aislamiento en laboratorio [42] [46] [47] tienen el potencial de proporcionar este nivel crítico de comprensión de los procesos biogeoquímicos. [48]
A continuación se muestran algunos de los ciclos biogeoquímicos más conocidos:
Actualmente se están estudiando por primera vez muchos ciclos biogeoquímicos. El cambio climático y los impactos humanos están modificando drásticamente la velocidad, la intensidad y el equilibrio de estos ciclos relativamente desconocidos, entre los que se incluyen:
Los ciclos biogeoquímicos siempre implican estados de equilibrio activos: un equilibrio en el ciclo del elemento entre compartimentos. Sin embargo, el equilibrio general puede implicar compartimentos distribuidos a escala global.
Como los ciclos biogeoquímicos describen los movimientos de sustancias en todo el globo, su estudio es inherentemente multidisciplinario. El ciclo del carbono puede estar relacionado con la investigación en ecología y ciencias atmosféricas . [53] La dinámica bioquímica también estaría relacionada con los campos de la geología y la pedología . [54]
{{cite book}}: CS1 maint: numeric names: authors list (link)