Una célula artificial , célula sintética o célula mínima es una partícula diseñada que imita una o varias funciones de una célula biológica . A menudo, las células artificiales son membranas biológicas o poliméricas que encierran materiales biológicamente activos. [1] Como tales, los liposomas , polimerosomas , nanopartículas , microcápsulas y otras partículas pueden calificar como células artificiales.
Los términos "célula artificial" y "célula sintética" se utilizan en una variedad de campos diferentes y pueden tener diferentes significados, como también se refleja en las diferentes secciones de este artículo. Algunas definiciones más estrictas se basan en el supuesto de que el término "célula" se relaciona directamente con células biológicas y que, por lo tanto, estas estructuras tienen que estar vivas (o ser parte de un organismo vivo) y, además, que el término "artificial" implica que estas estructuras se construyen artificialmente desde abajo hacia arriba, es decir, a partir de componentes básicos. Como tal, en el área de la biología sintética , una célula artificial puede entenderse como una célula hecha completamente sintéticamente que puede capturar energía , mantener gradientes iónicos , contener macromoléculas , así como almacenar información y tener la capacidad de replicarse . [2] Este tipo de célula artificial aún no se ha fabricado.
Sin embargo, en otros casos, el término "artificial" no implica que toda la estructura sea creada por el hombre, sino que puede referirse a la idea de que ciertas funciones o estructuras de las células biológicas pueden modificarse, simplificarse, reemplazarse o complementarse con una entidad sintética.
En otros campos, el término "célula artificial" puede referirse a cualquier compartimento que se parezca un poco a una célula biológica en tamaño o estructura, pero que esté fabricado sintéticamente, o incluso completamente, a partir de componentes no biológicos. El término "célula artificial" también se utiliza para estructuras con aplicaciones directas, como compartimentos para la administración de fármacos. La microencapsulación permite el metabolismo dentro de la membrana, el intercambio de moléculas pequeñas y la prevención del paso de sustancias grandes a través de ella. [3] [4] Las principales ventajas de la encapsulación incluyen un mejor mimetismo en el cuerpo, una mayor solubilidad de la carga y una disminución de las respuestas inmunes . En particular, las células artificiales han tenido éxito clínico en la hemoperfusión . [5]
El patólogo alemán Rudolf Virchow planteó la idea de que no sólo la vida surge de las células, sino que cada célula proviene de otra célula; " Omnis cellula e cellula ". [6] Hasta ahora, la mayoría de los intentos de crear una célula artificial sólo han creado un paquete que puede imitar ciertas tareas de la célula. Los avances en las reacciones de transcripción y traducción libres de células permiten la expresión de muchos genes , pero estos esfuerzos están lejos de producir una célula en pleno funcionamiento.
Un enfoque ascendente para construir una célula artificial implicaría la creación de una protocélula de novo , enteramente a partir de materiales no vivos. Como implica el término "célula", un requisito previo es la generación de algún tipo de compartimento que defina una unidad celular individual. Las membranas de fosfolípidos son una opción obvia como límites compartimentados, [7] ya que actúan como barreras selectivas en todas las células biológicas vivas. Los científicos pueden encapsular biomoléculas en vesículas de fosfolípidos del tamaño de una célula y, al hacerlo, observar que estas moléculas actúan de manera similar a las células biológicas y así recrear ciertas funciones celulares. [8] De manera similar, se pueden encapsular componentes biológicos funcionales en estos compartimentos lipídicos para lograr la síntesis de células artificiales (aunque rudimentarias).
Se propone crear una vesícula bicapa de fosfolípidos con ADN capaz de autorreproducirse utilizando información genética sintética. Los tres elementos principales de estas células artificiales son la formación de una membrana lipídica , la replicación del ADN y el ARN mediante un proceso de plantilla y la recolección de energía química para el transporte activo a través de la membrana. [9] [10] Los principales obstáculos previstos y encontrados con esta protocélula propuesta son la creación de un ADN sintético mínimo que contenga toda la información suficiente para la vida y la reproducción de componentes no genéticos que son integrales en el desarrollo celular, como la automolecularidad. -organización. [11] Sin embargo, se espera que este tipo de enfoque ascendente proporcione información sobre las cuestiones fundamentales de las organizaciones a nivel celular y los orígenes de la vida biológica. Hasta el momento no se ha sintetizado ninguna célula completamente artificial capaz de autorreproducirse utilizando las moléculas de la vida, y este objetivo aún queda en un futuro lejano, aunque actualmente varios grupos están trabajando para lograrlo. [12]
Otro método propuesto para crear una protocélula se parece más a las condiciones que se cree que estuvieron presentes durante la evolución conocida como sopa primordial. Se podrían encapsular varios polímeros de ARN en vesículas y, en condiciones límite tan pequeñas, se podrían probar reacciones químicas. [13]
La investigación de protocélulas ha creado controversia y opiniones contrarias, incluidos críticos de la vaga definición de "vida artificial". [14] La creación de una unidad básica de vida es la preocupación ética más apremiante. [15] La preocupación más generalizada sobre las protocélulas es su amenaza potencial para la salud humana y el medio ambiente a través de su replicación incontrolada. Sin embargo, es mucho más probable que las células artificiales creadas mediante un enfoque de arriba hacia abajo, o cualquier otra forma manipulada de células vivas existentes, puedan existir y reproducirse fuera de un laboratorio y, por lo tanto, representen tal amenaza.
A mediados de la década de 2010, la comunidad investigadora comenzó a reconocer la necesidad de unificar el campo de la investigación sobre células sintéticas, reconociendo que la tarea de construir un organismo vivo completo a partir de componentes no vivos estaba más allá de los recursos de un solo país. [dieciséis]
En 2017, se inició la colaboración internacional de investigación a gran escala Build-a-Cell, financiada por la NSF, para la construcción de células vivas sintéticas [17] . Build-a-Cell ha llevado a cabo nueve talleres interdisciplinarios, abiertos a todos los interesados, para discutir y guiar el futuro de la comunidad de células sintéticas. A Build-a-Cell le siguieron organizaciones nacionales de células sintéticas en varios otros países. Esas organizaciones nacionales incluyen FabriCell, [18] MaxSynBio [19] y BaSyC. [20] Los esfuerzos europeos sobre células sintéticas se unificaron en 2019 como iniciativa SynCellEU. [21]
Miembros del Instituto J. Craig Venter han utilizado un enfoque computacional de arriba hacia abajo para eliminar genes de un organismo vivo hasta un conjunto mínimo de genes. [22] En 2010, el equipo logró crear una cepa replicante (llamada Mycoplasma laboratorium ) de Mycoplasma mycoides utilizando ADN creado sintéticamente, considerado el requisito mínimo para la vida, que se insertó en una bacteria genómicamente vacía. [22] Se espera que el proceso de biosíntesis de arriba hacia abajo permita la inserción de nuevos genes que realizarían funciones rentables como la generación de hidrógeno como combustible o la captura del exceso de dióxido de carbono en la atmósfera. [15] Las innumerables redes reguladoras, metabólicas y de señalización no están completamente caracterizadas. Estos enfoques de arriba hacia abajo tienen limitaciones para la comprensión de la regulación molecular fundamental, ya que los organismos huéspedes tienen una composición molecular compleja y no completamente definida. [23] En 2019 se publicó un modelo computacional completo de todas las vías en la célula Mycoplasma Syn3.0, que representa el primer modelo completo in silico para un organismo mínimo vivo. [24]
Grandes empresas como ExxonMobil , que se ha asociado con Synthetic Genomics Inc ; han realizado fuertes inversiones en biología; La propia empresa de biosintéticos de Craig Venter en el desarrollo de combustible a partir de algas. [25]
A partir de 2016, Mycoplasma genitalium es el único organismo utilizado como punto de partida para diseñar una célula mínima, ya que tiene el genoma más pequeño conocido que puede cultivarse en condiciones de laboratorio; la variedad de tipo salvaje tiene 482, y la eliminación de exactamente 100 genes considerados no esenciales dio como resultado una cepa viable con tasas de crecimiento mejoradas. Escherichia coli con genoma reducido se considera más útil y se han desarrollado cepas viables con el 15% del genoma eliminado. [26] : 29–30
Se ha creado una variación de una célula artificial en la que se introduce un genoma completamente sintético en células huésped genómicamente vaciadas. [22] Aunque no es completamente artificial porque los componentes citoplasmáticos y la membrana de la célula huésped se conservan, la célula diseñada está bajo el control de un genoma sintético y es capaz de replicarse .
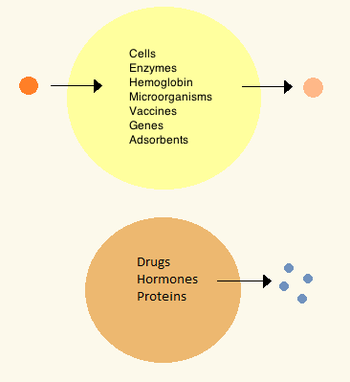
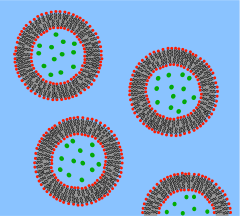
En la década de 1960, Thomas Chang desarrolló microcápsulas que más tarde llamaría "células artificiales", ya que eran compartimentos del tamaño de una célula fabricados a partir de materiales artificiales. [27] Estas células consistían en membranas ultrafinas de nailon, colodión o proteína reticulada cuyas propiedades semipermeables permitían la difusión de pequeñas moléculas dentro y fuera de la célula. Estas células tenían un tamaño de micras y contenían células , enzimas , hemoglobina , materiales magnéticos, adsorbentes y proteínas . [3]
Posteriormente, las células artificiales han variado desde dimensiones de cien micrómetros a nanómetros y pueden transportar microorganismos, vacunas , genes , fármacos, hormonas y péptidos . [3] El primer uso clínico de células artificiales fue en hemoperfusión mediante la encapsulación de carbón activado . [28]
En la década de 1970, los investigadores pudieron introducir enzimas, proteínas y hormonas en microcápsulas biodegradables, lo que luego condujo al uso clínico en enfermedades como el síndrome de Lesch-Nyhan . [29] Aunque la investigación inicial de Chang se centró en los glóbulos rojos artificiales , sólo a mediados de la década de 1990 se desarrollaron glóbulos rojos artificiales biodegradables. [30] Las células artificiales en encapsulación de células biológicas se utilizaron por primera vez en la clínica en 1994 para el tratamiento de un paciente diabético [31] y desde entonces se han encapsulado y están bajo investigación otros tipos de células como hepatocitos , células madre adultas y células genéticamente modificadas. estudio para su uso en la regeneración de tejidos. [32] [33]
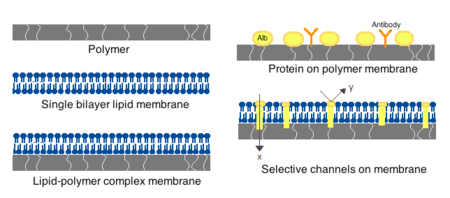
Las membranas para células artificiales pueden estar hechas de polímeros simples , proteínas reticuladas, membranas lipídicas o complejos polímero-lípido. Además, las membranas se pueden diseñar para presentar proteínas de superficie como albúmina , antígenos , portadores de Na/K-ATPasa o poros como canales iónicos . Los materiales comúnmente utilizados para la producción de membranas incluyen polímeros de hidrogel como alginato , celulosa y polímeros termoplásticos como metacrilato de hidroxietilo-metacrilato de metilo (HEMA-MMA), poliacrilonitrilo-cloruro de polivinilo (PAN-PVC), así como variaciones de los anteriores. mencionado. [4] El material utilizado determina la permeabilidad de la membrana celular, que en el caso del polímero depende de la difusión adecuada de nutrientes, desechos y otras moléculas críticas. Los polímeros hidrófilos tienen el potencial de ser biocompatibles y pueden fabricarse en una variedad de formas que incluyen micelas de polímeros , mezclas sol-gel , mezclas físicas y partículas y nanopartículas reticuladas. [4] Son de especial interés los polímeros que responden a estímulos que responden a cambios de pH o temperatura para su uso en entregas dirigidas. Estos polímeros pueden administrarse en forma líquida mediante una inyección macroscópica y solidificarse o gelificarse in situ debido a la diferencia de pH o temperatura. Las preparaciones de nanopartículas y liposomas también se utilizan habitualmente para la encapsulación y entrega de materiales. Una ventaja importante de los liposomas es su capacidad para fusionarse con las membranas celulares y de orgánulos .
Se han desarrollado muchas variaciones para la preparación y encapsulación de células artificiales. Normalmente, se sintetizan vesículas como una nanopartícula , un polimerosoma o un liposoma . Normalmente, una emulsión se elabora mediante el uso de equipos de alta presión, como un homogeneizador de alta presión o un microfluidizador. A continuación también se describen dos métodos de microencapsulación para nitrocelulosa.
En un homogeneizador de alta presión, dos líquidos en suspensión aceite/líquido se fuerzan a través de un pequeño orificio bajo una presión muy alta. Este proceso divide los productos y permite la creación de partículas extremadamente finas, tan pequeñas como 1 nm.
Esta técnica utiliza un Microfluidizador patentado para obtener una mayor cantidad de suspensiones homogéneas que pueden crear partículas más pequeñas que los homogeneizadores. Primero se utiliza un homogeneizador para crear una suspensión gruesa que luego se bombea al microfluidizador a alta presión. Luego, el flujo se divide en dos corrientes que reaccionarán a velocidades muy altas en una cámara de interacción hasta que se obtenga el tamaño de partícula deseado. [34] Esta técnica permite la producción a gran escala de liposomas de fosfolípidos y nanoencapsulaciones de materiales posteriores.
En este método, se incorpora gota a gota una solución de células en una solución de colodión de nitrato de celulosa. A medida que la gota viaja a través del colodión, se recubre con una membrana gracias a las propiedades de polimerización interfacial del colodión. Posteriormente, la célula se deposita en parafina, donde se fija la membrana, que luego se suspende con una solución salina. El método de la gota se utiliza para la creación de grandes células artificiales que encapsulan células biológicas, células madre y células madre genéticamente modificadas.
El método de emulsión se diferencia en que el material que se va a encapsular suele ser más pequeño y se coloca en el fondo de una cámara de reacción donde se agrega el colodión encima y se centrifuga, o se perturba de otro modo para crear una emulsión. A continuación, el material encapsulado se dispersa y se suspende en solución salina.
Las células artificiales utilizadas para la administración de fármacos se diferencian de otras células artificiales en que su contenido está destinado a difundirse fuera de la membrana o ser engullido y digerido por una célula objetivo huésped. A menudo se utilizan células artificiales de membrana lipídica submicrónicas que pueden denominarse nanocápsulas, nanopartículas, polimerosomas u otras variaciones del término. [35]
La terapia enzimática se está estudiando activamente para enfermedades metabólicas genéticas en las que una enzima está sobreexpresada, subexpresada, defectuosa o no existe. En caso de subexpresión o expresión de una enzima defectuosa , se introduce en el organismo una forma activa de la enzima para compensar el déficit. Por otro lado, una sobreexpresión enzimática puede contrarrestarse mediante la introducción de una enzima no funcional competidora; es decir, una enzima que metaboliza el sustrato en productos no activos. Cuando se colocan dentro de una célula artificial, las enzimas pueden llevar a cabo su función durante un período mucho más largo en comparación con las enzimas libres [3] y pueden optimizarse aún más mediante la conjugación de polímeros. [36]
La primera enzima estudiada bajo encapsulación celular artificial fue la asparaginasa para el tratamiento del linfosarcoma en ratones. Este tratamiento retrasó la aparición y el crecimiento del tumor . [37] Estos hallazgos iniciales llevaron a nuevas investigaciones sobre el uso de células artificiales para la administración de enzimas en melanomas dependientes de tirosina . [38] Estos tumores tienen una mayor dependencia de la tirosina que las células normales para su crecimiento, y la investigación ha demostrado que la reducción de los niveles sistémicos de tirosina en ratones puede inhibir el crecimiento de los melanomas. [39] El uso de células artificiales en la administración de tirosinasa ; y enzima que digiere la tirosina, permite una mejor estabilidad de la enzima y se muestra eficaz en la eliminación de tirosina sin los graves efectos secundarios asociados con la depravación de tirosina en la dieta. [40]
La terapia con enzimas celulares artificiales también es de interés para la activación de profármacos como la ifosfamida en ciertos cánceres. Las células artificiales que encapsulan la enzima citocromo p450 que convierte este profármaco en fármaco activo se pueden adaptar para acumularse en el carcinoma de páncreas o implantar las células artificiales cerca del sitio del tumor. Aquí, la concentración local de ifosfamida activada será mucho mayor que en el resto del cuerpo, previniendo así la toxicidad sistémica . [41] El tratamiento tuvo éxito en animales [42] y mostró una duplicación de la mediana de supervivencia entre pacientes con cáncer de páncreas en estadio avanzado en ensayos clínicos de fase I/II, y una triplicación de la tasa de supervivencia a un año. [41]
En el tratamiento de enfermedades genéticas, la terapia génica tiene como objetivo insertar, alterar o eliminar genes dentro de las células de un individuo afectado. La tecnología depende en gran medida de vectores virales , lo que genera preocupación sobre la mutagénesis por inserción y la respuesta inmune sistémica que han provocado muertes humanas [43] [44] y el desarrollo de leucemia [45] [46] en ensayos clínicos. Evitar la necesidad de vectores mediante el uso de ADN desnudo o plasmídico como su propio sistema de administración también enfrenta problemas tales como una baja eficiencia de transducción y una pobre focalización en el tejido cuando se administra sistémicamente. [4]
Se han propuesto células artificiales como un vector no viral mediante el cual se encapsulan e implantan células no autólogas modificadas genéticamente para administrar proteínas recombinantes in vivo . [47] Este tipo de inmunoaislamiento ha demostrado ser eficaz en ratones mediante la administración de células artificiales que contienen hormona de crecimiento de ratón que rescató un retraso del crecimiento en ratones mutantes. [48] Algunas estrategias han avanzado hasta los ensayos clínicos en humanos para el tratamiento del cáncer de páncreas , la esclerosis lateral y el control del dolor. [4]
El primer uso clínico de células artificiales fue en hemoperfusión mediante la encapsulación de carbón activado . [28] El carbón activado tiene la capacidad de adsorber muchas moléculas grandes y desde hace mucho tiempo se conoce por su capacidad para eliminar sustancias tóxicas de la sangre en caso de intoxicación accidental o sobredosis. Sin embargo, la perfusión mediante la administración directa de carbón es tóxica ya que provoca embolias y daños a las células sanguíneas, seguidos de su eliminación por las plaquetas. [49] Las células artificiales permiten que las toxinas se difundan dentro de la célula mientras mantienen la carga peligrosa dentro de su membrana ultrafina. [28]
La hemoperfusión de células artificiales se ha propuesto como una opción desintoxicante menos costosa y más eficiente que la hemodiálisis , [3] en la que el filtrado de la sangre se realiza únicamente mediante la separación de tamaños mediante una membrana física. En la hemoperfusión, miles de células artificiales adsorbentes se retienen dentro de un pequeño recipiente mediante el uso de dos pantallas en cada extremo a través de las cuales se perfunde la sangre del paciente . A medida que la sangre circula, las toxinas o fármacos se difunden hacia las células y son retenidas por el material absorbente. Las membranas de las células artificiales son mucho más delgadas que las utilizadas en diálisis y su pequeño tamaño hace que tengan una gran superficie de membrana . Esto significa que una porción de célula puede tener una transferencia de masa teórica cien veces mayor que la de una máquina de riñón artificial completa. [3] El dispositivo se ha establecido como un método clínico de rutina para pacientes tratados por intoxicación accidental o suicida, pero también se ha introducido como terapia en insuficiencia hepática y renal al realizar parte de la función de estos órganos. [3] También se ha propuesto el uso de hemoperfusión de células artificiales en inmunoadsorción mediante la cual los anticuerpos se pueden eliminar del cuerpo uniendo un material inmunoadsorbente como la albúmina en la superficie de las células artificiales. Este principio se ha utilizado para eliminar anticuerpos de grupo sanguíneo del plasma para trasplantes de médula ósea [50] y para el tratamiento de la hipercolesterolemia mediante anticuerpos monoclonales para eliminar lipoproteínas de baja densidad . [51] La hemoperfusión es especialmente útil en países con una industria manufacturera de hemodiálisis débil, ya que los dispositivos tienden a ser más baratos allí y se utilizan en pacientes con insuficiencia renal .

El método más común de preparación de células artificiales es mediante encapsulación celular . Las células encapsuladas generalmente se logran mediante la generación de gotitas de tamaño controlado a partir de una suspensión celular líquida que luego se solidifican o gelifican rápidamente para proporcionar mayor estabilidad. La estabilización se puede lograr mediante un cambio de temperatura o mediante reticulación del material. [4] El microambiente que ve una célula cambia tras la encapsulación. Por lo general, pasa de estar en una monocapa a una suspensión en un armazón de polímero dentro de una membrana polimérica. Un inconveniente de la técnica es que encapsular una célula disminuye su viabilidad y capacidad para proliferar y diferenciarse. [52] Además, después de algún tiempo dentro de la microcápsula, las células forman grupos que inhiben el intercambio de oxígeno y desechos metabólicos, [53] lo que lleva a la apoptosis y necrosis , lo que limita la eficacia de las células y activa el sistema inmunológico del huésped . Las células artificiales han tenido éxito en el trasplante de varias células, incluidos los islotes de Langerhans para el tratamiento de la diabetes , [54] células paratiroideas y células de la corteza suprarrenal.
La escasez de donantes de órganos convierte a las células artificiales en actores clave de las terapias alternativas para la insuficiencia hepática . El uso de células artificiales para el trasplante de hepatocitos ha demostrado viabilidad y eficacia para proporcionar función hepática en modelos de enfermedad hepática animal y dispositivos hepáticos bioartificiales . [55] La investigación surgió de experimentos en los que los hepatocitos se adhirieron a la superficie de un microportador [56] y evolucionaron hasta convertirse en hepatocitos que están encapsulados en una matriz tridimensional en microgotas de alginato cubiertas por una piel exterior de polilisina . Una ventaja clave de este método de administración es que evita la terapia de inmunosupresión durante la duración del tratamiento. Se han propuesto encapsulaciones de hepatocitos para su uso en un hígado bioartificial . El dispositivo consta de una cámara cilíndrica incrustada con hepatocitos aislados a través de la cual el plasma del paciente circula extracorpóreamente en un tipo de hemoperfusión . Debido a que las microcápsulas tienen una alta relación superficie - volumen , proporcionan una gran superficie para la difusión del sustrato y pueden acomodar una gran cantidad de hepatocitos. El tratamiento de ratones con insuficiencia hepática inducida mostró un aumento significativo en la tasa de supervivencia. [55] Los sistemas de hígado artificial todavía están en desarrollo temprano, pero muestran potencial para pacientes que esperan un trasplante de órgano o mientras el propio hígado del paciente se regenera lo suficiente como para reanudar su función normal. Hasta ahora, los ensayos clínicos que utilizan sistemas de hígado artificial y trasplante de hepatocitos en enfermedades hepáticas en etapa terminal han demostrado una mejora de los marcadores de salud, pero aún no han mejorado la supervivencia. [57] La corta longevidad y la agregación de hepatocitos artificiales después del trasplante son los principales obstáculos encontrados. Los hepatocitos coencapsulados con células madre muestran una mayor viabilidad en cultivo y después de la implantación [58] y la implantación de células madre artificiales solas también ha mostrado regeneración hepática. [59] Como tal, ha surgido interés en el uso de células madre para la encapsulación en medicina regenerativa .
La ingestión oral de colonias de células bacterianas vivas ha sido propuesta y actualmente se encuentra en terapia para la modulación de la microflora intestinal , [60] prevención de enfermedades diarreicas , [61] tratamiento de infecciones por H. Pylori , inflamaciones atópicas, [62] intolerancia a la lactosa [ 63] y modulación inmune , [64] entre otros. El mecanismo de acción propuesto no se comprende completamente, pero se cree que tiene dos efectos principales. El primero es el efecto nutricional, en el que las bacterias compiten con las bacterias productoras de toxinas. El segundo es el efecto sanitario, que estimula la resistencia a la colonización y estimula la respuesta inmune . [4] La administración oral de cultivos bacterianos suele ser un problema porque son atacados por el sistema inmunológico y, a menudo, destruidos cuando se toman por vía oral. Las células artificiales ayudan a abordar estos problemas proporcionando mimetismo en el cuerpo y liberación selectiva o a largo plazo, aumentando así la viabilidad de las bacterias que llegan al sistema gastrointestinal . [4] Además, la encapsulación de células bacterianas vivas se puede diseñar para permitir la difusión de pequeñas moléculas, incluidos péptidos, en el cuerpo con fines terapéuticos. [4] Las membranas que han demostrado ser exitosas para la administración bacteriana incluyen acetato de celulosa y variantes de alginato . [4] Los usos adicionales que han surgido de la encapsulación de células bacterianas incluyen la protección contra el desafío de M. Tuberculosis [65] y la regulación positiva de las células secretoras de Ig del sistema inmunológico. [66] La tecnología está limitada por el riesgo de infecciones sistémicas, actividades metabólicas adversas y el riesgo de transferencia de genes. [4] Sin embargo, el mayor desafío sigue siendo la entrega de suficientes bacterias viables al sitio de interés. [4]
Los transportadores de oxígeno de tamaño nanométrico se utilizan como un tipo de sustitutos de los glóbulos rojos , aunque carecen de otros componentes de los glóbulos rojos. Están compuestos por un polimerosoma sintético o una membrana artificial que rodea la hemoglobina animal, humana o recombinante purificada . [67] En general, la administración de hemoglobina sigue siendo un desafío porque es altamente tóxica cuando se administra sin modificaciones. En algunos ensayos clínicos se han observado efectos vasopresores. [68] [69]
El interés por la investigación en el uso de células artificiales para la sangre surgió después del temor al SIDA en la década de 1980. Además de evitar el potencial de transmisión de enfermedades, los glóbulos rojos artificiales son deseables porque eliminan los inconvenientes asociados con las transfusiones de sangre alogénicas, como el tipo sanguíneo, las reacciones inmunes y su corta vida de almacenamiento de 42 días. Un sustituto de la hemoglobina puede almacenarse a temperatura ambiente y no refrigerado durante más de un año. [3] Se han hecho intentos para desarrollar un glóbulo rojo completamente funcional que contenga carbónico no sólo como transportador de oxígeno sino también con las enzimas asociadas con la célula. El primer intento se realizó en 1957 reemplazando la membrana de los glóbulos rojos por una membrana polimérica ultrafina [70] , seguida de una encapsulación a través de una membrana lipídica [71] y, más recientemente, una membrana polimérica biodegradable. [3] También se puede utilizar una membrana biológica de glóbulos rojos que incluye lípidos y proteínas asociadas para encapsular nanopartículas y aumentar el tiempo de residencia in vivo evitando la captación de macrófagos y la eliminación sistémica. [72]
Un leucopolimerosoma es un polimerosoma diseñado para tener las propiedades adhesivas de un leucocito . [73] Los polimerosomas son vesículas compuestas por una lámina bicapa que puede encapsular muchas moléculas activas, como fármacos o enzimas . Al agregar las propiedades adhesivas de un leucocito a sus membranas, se puede hacer que ralenticen o rueden a lo largo de las paredes epiteliales dentro del sistema circulatorio que fluye rápidamente .
El concepto de Célula Artificial Electrónica se ha ampliado en una serie de tres proyectos de la UE coordinados por John McCaskill de 2004 a 2015.
La Comisión Europea patrocinó el desarrollo del programa Programmable Artificial Cell Evolution (PACE) [74] de 2004 a 2008, cuyo objetivo era sentar las bases para la creación de "entidades autónomas microscópicas, autoorganizadas, autorreplicantes y evolutivas construidas a partir de sustancias orgánicas e inorgánicas simples que pueden programarse genéticamente para realizar funciones específicas" [74] para su eventual integración en sistemas de información. El proyecto PACE desarrolló la primera máquina Omega, un sistema de soporte vital de microfluidos para células artificiales que podría complementar funciones químicamente faltantes (como propusieron originalmente Norman Packard, Steen Rasmussen, Mark Beadau y John McCaskill). El objetivo final era lograr una célula híbrida capaz de evolucionar en un entorno complejo programable a microescala. Las funciones de la Máquina Omega podrían entonces eliminarse paso a paso, planteando una serie de desafíos evolutivos solucionables para la química de las células artificiales. El proyecto logró la integración química hasta el nivel de pares de las tres funciones principales de las células artificiales (un subsistema genético, un sistema de contención y un sistema metabólico) y generó nuevos entornos de microfluidos programables y resueltos espacialmente para la integración de la contención y la amplificación genética. [74] El proyecto condujo a la creación del centro europeo de tecnología viva. [75]
Tras esta investigación, en 2007, John McCaskill propuso concentrarse en una célula artificial complementada electrónicamente, llamada Célula Química Electrónica. La idea clave era utilizar una serie masiva de electrodos paralelos acoplados a circuitos electrónicos dedicados localmente, en una película delgada bidimensional, para complementar la funcionalidad celular química emergente. La información electrónica local que define los circuitos de detección y conmutación de electrodos podría servir como un genoma electrónico, complementando la información secuencial molecular en los protocolos emergentes. Una propuesta de investigación tuvo éxito con la Comisión Europea y un equipo internacional de científicos que coincidían parcialmente con el consorcio PACE comenzaron a trabajar entre 2008 y 2012 en el proyecto Electronic Chemical Cells. El proyecto demostró, entre otras cosas, que el transporte local controlado electrónicamente de secuencias específicas podría utilizarse como sistema de control espacial artificial para la proliferación genética de futuras células artificiales, y que los procesos centrales del metabolismo podrían realizarse mediante conjuntos de electrodos adecuadamente recubiertos.
La principal limitación de este enfoque, aparte de las dificultades iniciales para dominar la electroquímica y la electrocinética a microescala, es que el sistema electrónico está interconectado como una pieza rígida y no autónoma de hardware macroscópico. En 2011, McCaskill propuso invertir la geometría de la electrónica y la química: en lugar de colocar productos químicos en un medio electrónico activo, colocar una electrónica microscópica autónoma en un medio químico. Organizó un proyecto para abordar una tercera generación de células artificiales electrónicas a escala de 100 µm que podrían autoensamblarse a partir de dos "tabletas" de media célula para encerrar un espacio químico interno y funcionar con la ayuda de electrónica activa alimentada por el medio. están inmersas. Estas células pueden copiar su contenido electrónico y químico y serán capaces de evolucionar dentro de las limitaciones impuestas por sus bloques de construcción microscópicos presintetizados especiales. En septiembre de 2012 se iniciaron las obras de este proyecto. [76]
Hay investigación y desarrollo de neuronas físicas artificiales, orgánicas e inorgánicas.
Por ejemplo, algunas neuronas artificiales pueden recibir [77] [78] y liberar dopamina ( señales químicas en lugar de señales eléctricas) y comunicarse con células musculares y cerebrales naturales de rata , con potencial para su uso en BCI / prótesis . [79] [80]
Los memristores biocompatibles de baja potencia pueden permitir la construcción de neuronas artificiales que funcionan a voltajes de potenciales de acción biológicos y podrían usarse para procesar directamente señales de biodetección , para computación neuromórfica y/o comunicación directa con neuronas biológicas . [81] [82] [83]
Se han integrado en un robot circuitos neuromórficos orgánicos hechos de polímeros , recubiertos con un gel rico en iones para permitir que un material transporte una carga eléctrica como neuronas reales , lo que le permite aprender sensoriomotoramente en el mundo real, en lugar de mediante simulaciones o virtualmente. [84] [85] Además, las neuronas artificiales hechas de materia blanda (polímeros) pueden operar en entornos biológicamente relevantes y permitir la comunicación sinérgica entre los dominios artificial y biológico. [86] [87]Las protocélulas de Jeewanu son partículas químicas sintéticas que poseen una estructura similar a la de una célula y parecen tener algunas propiedades vivas funcionales. [88] Sintetizado por primera vez en 1963 a partir de minerales simples y compuestos orgánicos básicos mientras se expone a la luz solar , todavía se informa que tiene algunas capacidades metabólicas, la presencia de membrana semipermeable , aminoácidos , fosfolípidos , carbohidratos y moléculas similares a ARN. [88] Sin embargo, la naturaleza y las propiedades del Jeewanu aún no se han aclarado. [88] [89]