Los inhibidores de la bomba de protones (IBP) bloquean la ATPasa de hidrógeno y potasio gástrica ( ATPasa H + /K + ) e inhiben la secreción de ácido gástrico. Estos medicamentos han surgido como el tratamiento de elección para enfermedades relacionadas con el ácido, incluida la enfermedad por reflujo gastroesofágico (ERGE) y la enfermedad de úlcera péptica . Los IBP también pueden unirse a otros tipos de bombas de protones, como las que se producen en las células cancerosas, y están encontrando aplicaciones en la reducción del eflujo ácido de las células cancerosas y la reducción de la resistencia a los medicamentos de quimioterapia.
A finales de los años 1970, aparecieron pruebas de que la recién descubierta bomba de protones (H + /K + ATPasa) en la membrana secretora de la célula parietal era el paso final de la secreción ácida. [1] La literatura sobre las pruebas de anestesia dirigió la atención hacia el posible compuesto antiviral piridiltioacetamida que, tras un examen más detallado, apuntó la atención hacia un compuesto antisecretor con mecanismos de acción desconocidos llamado timoprazol . [2] [3] [4] El timoprazol es un piridilmetilsulfinil benzimidazol y resultó atractivo debido a su estructura química simple y su nivel sorprendentemente alto de actividad antisecretora. [5]
Se estudió la optimización de los benzimidazoles sustituidos y sus efectos antisecretores en la recién descubierta bomba de protones para obtener valores de pKa más altos de la piridina , facilitando así la acumulación dentro de la célula parietal y aumentando la tasa de conversión mediada por ácido al mediador activo. Como resultado de dicha optimización, se lanzó al mercado el primer fármaco inhibidor de la bomba de protones, el omeprazol . [4] [6] Otros IBP como el lansoprazol y el pantoprazol seguirían sus pasos, reclamando su parte de un mercado floreciente, después de su propio curso de desarrollo. [ cita requerida ]

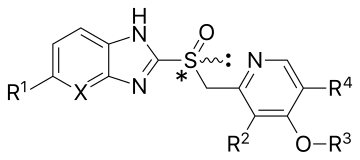
Los IBP se pueden dividir en dos grupos según su estructura básica. Aunque todos los miembros tienen una parte de piridina sustituida , un grupo se ha unido a varios benzimidazoles, mientras que el otro se ha unido a una imidazopiridina sustituida. Todos los IBP comercializados (omeprazol, lansoprazol, pantoprazol) pertenecen al grupo de los benzimidazoles. [ cita requerida ]
Los inhibidores de la bomba de protones son profármacos y su forma inhibidora real es algo controvertida. En solución ácida, el ácido sulfénico se aísla antes de la reacción con una o más cisteínas accesibles desde la superficie luminar de la enzima , una sulfenamida tetracíclica. Esta es una molécula plana, por lo que cualquier enantiómero de un IBP pierde estereoespecificidad tras la activación. [7]
La eficacia de estos fármacos se deriva de dos factores: su diana, la H + /K + ATPasa que es responsable del último paso de la secreción ácida; por tanto, su acción sobre la secreción ácida es independiente del estímulo a la secreción ácida, de la histamina , la acetilcolina u otros estimulantes aún por descubrir. Además, su mecanismo de acción implica la unión covalente del fármaco activado a la enzima, lo que da lugar a una duración de acción que supera su semivida plasmática . [7] [8]
La secreción ácida del estómago humano produce un pH diurno medio de 1,4. Este gradiente de H + muy grande (>10 6 veces) es generado por la ATPasa H + /K + gástrica , que es una bomba de protones impulsada por ATP. La hidrólisis de una molécula de ATP se utiliza para catalizar el intercambio electroneutral de dos iones de potasio luminales por dos protones citoplasmáticos a través de la membrana gástrica. [9]
La bomba de protones, H + /K + ATPasa, es una enzima α,β-heterodímera. La subunidad α catalítica tiene diez segmentos transmembrana con un grupo de aminoácidos carboxílicos intramembranales ubicados en el medio de los segmentos transmembrana TM4, TM5, TM6 y TM8. La subunidad β tiene un segmento transmembrana con extremo N en la región citoplasmática. El dominio extracelular de la subunidad β contiene seis o siete sitios de glicosilación ligados a N que son importantes para el ensamblaje, la maduración y la clasificación de la enzima. [10]
El transporte de iones se lleva a cabo mediante cambios conformacionales cíclicos de la enzima entre sus dos estados de reacción principales , E1 y E2. Los estados E1 citoplasmático abierto y E2 luminal abierto tienen una alta afinidad por H + y K + . [9] La expulsión del protón a una concentración de 160 mM (pH 0,8) resulta del movimiento de la lisina 791 hacia el sitio de unión de iones en la configuración E2P. [10]
En el año 1975, se descubrió que el timoprazol inhibe la secreción ácida independientemente del estímulo, extracelular o intracelular. [7] Los estudios sobre el timoprazol revelaron un agrandamiento de la glándula tiroides debido a la inhibición de la captación de yodo , así como una atrofia de la glándula del timo . Una búsqueda bibliográfica mostró que algunos mercapto-benzimidazoles sustituidos no tenían efecto sobre la captación de yodo y la introducción de dichos sustituyentes en el timoprazol resultó en una eliminación de los efectos tóxicos, sin reducir el efecto antisecretor. [6] Un derivado del timoprazol, el omeprazol, fue descubierto en 1979, y fue el primero de una nueva clase de fármacos que controlan la secreción ácida en el estómago, un inhibidor de la bomba de protones (IBP). [11] [12] También se realizó la adición de la sustitución 5-metoxi a la fracción benzimidazol del omeprazol y le dio al compuesto mucha más estabilidad a pH neutro. [6] En 1980, se presentó una solicitud de nuevo fármaco en investigación (IND) y el omeprazol pasó a la fase III de ensayos en humanos en 1982. [6] Se introdujo un nuevo enfoque para el tratamiento de enfermedades relacionadas con el ácido y rápidamente se demostró que el omeprazol era clínicamente superior a los antagonistas del receptor H2 de histamina y se lanzó en 1988 como Losec en Europa y en 1990 como Prilosec en los Estados Unidos. En 1996, Losec se convirtió en el fármaco de mayor venta en el mundo y en 2004 más de 800 millones de pacientes habían sido tratados con el fármaco en todo el mundo. Durante la década de 1980, alrededor de otras 40 empresas entraron en el área de los IBP, pero pocas lograron el éxito en el mercado: Takeda con lansoprazol, Byk Gulden (ahora Nycomed ) con pantoprazol y Eisai con rabeprazol, todos ellos análogos del omeprazol. [7] [8]
La historia del descubrimiento del pantoprazol es un buen ejemplo del desarrollo gradual de los IBP. El objetivo principal de la modificación del timoprazol fue la parte benzimidazol de su estructura. La adición de un grupo trifluorometilo a la fracción benzimidazol condujo a una serie de compuestos muy activos con estabilidad variable en solución. En general, se descubrió que los sustituyentes flúor bloqueaban el metabolismo en el punto donde estaban unidos. Más tarde, el sustituyente fluoroalcoxi más equilibrado, en lugar del sustituyente trifluorometilo altamente lipofílico y con fuerte capacidad de atracción de electrones, condujo a compuestos altamente activos con supuestas vidas medias más largas y mayor estabilidad en solución. [5]
Se observó que la actividad estaba de algún modo relacionada con la inestabilidad en solución y luego se llegó a la conclusión de que las sulfenamidas cíclicas, formadas en condiciones ácidas, eran el principio activo de los IBP. Finalmente, se entendió que alteraciones aparentemente pequeñas en la cadena principal del timoprazol no conducían a ninguna parte, y el enfoque debía centrarse en los sustituyentes de la cadena principal. Sin embargo, la necesaria reorganización intramolecular del benzimidazol en sulfenamida planteaba severas restricciones geométricas . Los compuestos óptimos serían aquellos que fueran estables a pH neutro pero que se activaran rápidamente a pH bajo. [5]
Todavía no era posible diseñar con claridad los inhibidores activos porque, en la compleja química de múltiples pasos, la influencia de un sustituyente en cada paso de la cascada podía ser diferente y, por lo tanto, no predecible para la tasa general de activación ácida requerida. Smith Kline y French, que iniciaron una colaboración con Byk Gulden a mediados de 1984, ayudaron en gran medida a determinar los criterios para un mayor desarrollo. A partir de 1985, el objetivo era identificar un compuesto con buena estabilidad a pH neutro, que mantuviera este nivel más alto de estabilidad hasta pH 5, pero que fuera rápidamente activable a pH más bajos, combinado con un alto nivel de inhibición de la ATPasa H + /K + . [13] De los numerosos compuestos ya sintetizados y probados que cumplían estos criterios, los candidatos más prometedores eran el pantoprazol y su sal, el pantoprazol sódico. [5]
En 1986 se sintetizó el sesquihidrato de pantoprazol sódico y a partir de 1987 se pasó al desarrollo de pantoprazol con la sal sódica, que es más estable y tiene mejor compatibilidad con otros excipientes utilizados en la formulación del fármaco. [ cita requerida ]
El pantoprazol fue identificado después de casi siete años de investigación y registrado para uso clínico después de otros siete años de desarrollo, y finalmente llegó a su primer mercado en 1994 en Alemania. Durante el curso de los estudios sobre pantoprazol, se habían sintetizado y evaluado más de 650 IBP. [5] El pantoprazol obtuvo altos criterios de selección en su proceso de desarrollo, especialmente en relación con el bajo potencial favorable de interacción con otros fármacos. La buena solubilidad del pantoprazol y una estabilidad de solución muy alta le permitieron convertirse en el primer IBP comercializado para uso intravenoso en pacientes con cuidados críticos. [5]
El omeprazol mostró una variabilidad interindividual y, por lo tanto, un número significativo de pacientes con trastornos relacionados con la acidez requirieron dosis más altas o múltiples para lograr el alivio de los síntomas y la curación. Astra inició un nuevo programa de investigación en 1987 para identificar un nuevo análogo del omeprazol con una variabilidad interpaciente menor. Solo un compuesto demostró ser superior al omeprazol y ese fue el isómero ( S )-(−), esomeprazol, que se desarrolló como sal de magnesio. El esomeprazol magnésico (nombre comercial Nexium) recibió su primera aprobación en 2000 y proporcionó una inhibición más pronunciada de la secreción ácida y una menor variación interpaciente en comparación con el omeprazol. En 2004, Nexium ya se había utilizado para tratar a más de 200 millones de pacientes. [7] [8]

El omeprazol fue el primer inhibidor de la bomba de protones que se comercializó en 1988. Es un fármaco racemato 1:1 con una estructura principal de timoprazol, pero sustituido con dos grupos metoxi y dos grupos metilo. Uno de los grupos metoxi está en la posición 6 del benzoimidazol y el otro en la posición 4 de la piridina, y los grupos metilo están en las posiciones 3 y 5 de la piridina. El omeprazol está disponible en comprimidos con cubierta entérica , cápsulas , comprimidos masticables, polvo para suspensiones orales y polvo para inyección intravenosa . [ cita requerida ]

El lansoprazol fue el segundo fármaco inhibidor de la bomba de protones que llegó al mercado, y se lanzó en Europa en 1991 y en los EE. UU. en 1995. No tiene sustituciones en el benzimidazol, pero sí dos sustituyentes en la piridina, un grupo metilo en la posición 3 y un grupo trifluoroetoxi en la posición 4. El fármaco es un racemato 1:1 de los enantiómeros dexlansoprazol y levolansoprazol. Está disponible en cápsulas y comprimidos gastrorresistentes, así como en comprimidos masticables. [ cita requerida ]

El pantoprazol fue el tercer inhibidor de la bomba de protones y se introdujo en el mercado alemán en 1994. Tiene un grupo lateral difluoroalcoxi en la parte benzimidazol y dos grupos metoxi en la posición 3 y 4 en la piridina. El pantoprazol fue preparado por primera vez en abril de 1985 por un pequeño grupo de químicos especializados en la fabricación a gran escala. Es una piridina sustituida con dimetoxi unida a un benzimidazol sustituido con fluoroalcoxi. [5] El pantoprazol sódico está disponible en comprimidos gastrorresistentes o de liberación retardada y en polvo liofilizado para uso intravenoso.

El rabeprazol es un nuevo compuesto de benzimidazol que se comercializa desde 1999 en los EE. UU. Es similar al lansoprazol en que no tiene sustituyentes en su parte de benzimidazol y un grupo metilo en el sitio 3 de la piridina; la única diferencia es la sustitución metoxipropoxi en el sitio 4 en lugar del grupo trifluoroetoxi en el lansoprazol. El rabeprazol se comercializa como sal sódica de rabeprazol. Está disponible en comprimidos con cubierta entérica. [ cita requerida ]

En 2001, se lanzó el esomeprazol en los EE. UU., como continuación de la patente del omeprazol. El esomeprazol es el enantiómero ( S )-(−) del omeprazol y proporciona una mayor biodisponibilidad y una eficacia mejorada , en términos de control del ácido estomacal, que el enantiómero ( R )-(+) del omeprazol. En teoría, al utilizar esomeprazol puro, los efectos sobre la bomba de protones serán iguales en todos los pacientes, eliminando el "efecto metabolizador lento" del racemato omeprazol. Está disponible en cápsulas o comprimidos de liberación retardada y como esomeprazol sódico para inyección/infusión intravenosa. Las preparaciones orales de esomeprazol tienen un recubrimiento entérico, debido a la rápida degradación del fármaco en las condiciones ácidas del estómago. Esto se logra formulando cápsulas utilizando el sistema de pellets de unidades múltiples. Aunque el isómero ( S )-(−)- es más potente en humanos, el isómero ( R )-(+)- es más potente en pruebas con ratas, mientras que los enantiómeros son equipotentes en perros. [14]

El dexlansoprazol se lanzó como una continuación del lansoprazol en 2009. El dexlansoprazol es un enantiómero ( R )-(+)-del lansoprazol, comercializado como Dexilant. Después de la administración oral del lansoprazol racémico, el fármaco circulante es 80% dexlansoprazol. Además, ambos enantiómeros tienen efectos similares en la bomba de protones. [15] En consecuencia, la principal ventaja de Dexilant no es el hecho de que sea una sustancia enantiopura. La ventaja es la formulación farmacéutica del fármaco, que se basa en una tecnología de liberación dual, con la primera liberación rápida que produce una concentración máxima en el plasma sanguíneo aproximadamente una hora después de la aplicación, y la segunda liberación retardada que produce otro pico aproximadamente cuatro horas después. [16]

El tenatoprazol (TU-199), un inhibidor de la bomba de protones de imidazopiridina , es un compuesto novedoso que ha sido diseñado como una nueva entidad química con una vida media plasmática sustancialmente prolongada (7 horas), pero que por lo demás tiene una actividad similar a la de otros IBP. [17]
La diferencia en la estructura básica del tenatoprazol en comparación con los IBP de benzimidazol es su fracción imidazo[4,5-b]piridina, que reduce la tasa de metabolismo, lo que permite un mayor tiempo de residencia en plasma, pero también disminuye el pKa del N imidazol fusionado en comparación con los IBP actuales. [18] El tenatoprazol tiene los mismos sustituyentes que el omeprazol, los grupos metoxi en la posición 6 de la imidazopiridina y en la posición 4 de la parte de piridina, así como dos grupos metilo en la posición 3 y 5 de la piridina.
La biodisponibilidad del tenatoprazol es el doble para la forma hidratada de sal sódica de tenatoprazol ( S )-(−) en comparación con la forma libre en perros. Esta mayor biodisponibilidad se debe a las diferencias en la estructura cristalina y la naturaleza hidrofóbica de las dos formas, y por lo tanto es más probable que se comercialice como el enantiómero ( S )-(−) puro. [ cita requerida ]
La unión disulfuro del inhibidor tiene lugar en el sector luminal de la H + /K + ATPasa donde se unen 2 moles de inhibidor por cada 1 mol del sitio activo H + /K + ATPasa. [19] [20] Todos los IBP reaccionan con la cisteína 813 en el bucle entre TM5 y TM6 en la H + /K + ATPasa, fijando la enzima en la configuración E2. El omeprazol reacciona con la cisteína 813 y 892. El rabeprazol se une a la cisteína 813 y a la 892 y a la 321. El lansoprazol reacciona con la cisteína 813 y la cisteína 321, mientras que el pantoprazol y el tenatoprazol reaccionan con la cisteína 813 y la 822. [18] [21] [22] [23] La reacción con la cisteína 822 confiere una propiedad bastante especial a la enzima inhibida covalentemente, a saber, la irreversibilidad a los agentes reductores . El primer paso probable es la unión del profármaco protonado en la piridina del compuesto con la cisteína 813. Luego, el segundo protón se agrega con transporte ácido por la H + /K + ATPasa, y el compuesto se activa. Datos recientes sugieren que el ácido sulfénico hidratado es la especie reactiva que se forma directamente a partir del benzimidazol monoprotonado unido a la superficie de la bomba. [7]
Aunque el consumo de alimentos estimula la secreción ácida y la secreción ácida activa los IBP, estos últimos no pueden inhibir todas las bombas. Aproximadamente el 70% de las enzimas de la bomba se inhiben, ya que los IBP tienen una vida media corta y no todas las enzimas de la bomba se activan. Se necesitan aproximadamente 3 días para alcanzar la inhibición en estado estacionario de la secreción ácida, ya que se logra un equilibrio entre la inhibición covalente de las bombas activas, la estimulación posterior de las bombas inactivas después de que el fármaco se haya eliminado de la sangre y la síntesis de novo de nuevas bombas. [8]
Aunque los fármacos omeprazol, lansoprazol, pantoprazol y rabeprazol comparten una estructura y un modo de acción comunes, cada uno difiere un poco en su farmacología clínica. [24] Los diferentes sustituyentes de piridina y benzimidazol dan lugar a pequeñas, pero potencialmente significativas, diferencias en las propiedades físicas y químicas. La comparación directa del pantoprazol sódico con otros fármacos antisecretores mostró que era significativamente más eficaz que los antagonistas del receptor H2 y equivalente o mejor que otros IBP de uso clínico. [5] Otro estudio afirma que el rabeprazol experimenta una activación en un rango de pH mayor que el omeprazol, el lansoprazol y el pantoprazol, y se convierte en la forma sulfenamida más rápidamente que cualquiera de estos tres fármacos. [23] La mayoría de las preparaciones orales de IBP tienen cubierta entérica, debido a la rápida degradación de los fármacos en las condiciones ácidas del estómago. Por ejemplo, el omeprazol es inestable en medio ácido, con una vida media de 2 minutos a un pH de 1 a 3, pero es significativamente más estable a un pH de 7 (vida media de aproximadamente 20 horas). La capa protectora ácida impide la conversión al principio activo en el lumen del estómago, que luego reaccionará con cualquier grupo sulfhidrilo disponible en los alimentos y no penetrará en el lumen del canalículo secretor [10].
La biodisponibilidad oral de los IBP es alta: 77% para pantoprazol, 80-90% para lansoprazol y 89% para esomeprazol. Todos los IBP, excepto el tenatoprazol, se metabolizan rápidamente en el hígado por las enzimas CYP, principalmente por CYP2C19 y CYP3A4 . Los IBP son sensibles a las enzimas CYP y tienen diferentes perfiles farmacocinéticos. Los estudios que comparan la eficacia de los IBP indican que esomeprazol y tenatoprazol tienen una supresión ácida más fuerte, con un período más largo de pH intragástrico (pH > 4). [25] [26] [27] [28] [29]
Los estudios sobre el efecto del tenatoprazol en la secreción ácida en modelos animales in vivo , como ratas con ligadura del píloro y ratas con fístula gástrica aguda, demostraron una actividad inhibidora de 2 a 4 veces más potente en comparación con el omeprazol. También se demostró una actividad inhibidora más potente en varios modelos de lesiones gástricas inducidas. [30] En sujetos sanos asiáticos y caucásicos, el tenatoprazol mostró una vida media siete veces más larga que los inhibidores de la H + /K + ATPasa existentes. [31] Por lo tanto, se plantea la hipótesis de que una vida media más larga da como resultado una inhibición más prolongada de la secreción ácida gástrica, especialmente durante la noche. Se ha establecido una fuerte relación entre el grado y la duración de la inhibición ácida gástrica, medida mediante el monitoreo del pH intragástrico de 24 horas en estudios farmacodinámicos, y la tasa de curación y alivio de los síntomas notificada. Un estudio clínico demostró que la duración de la irrupción ácida nocturna fue significativamente más corta con 40 mg de tenatoprazol que con 40 mg de esomeprazol, y se concluyó que el tenatoprazol fue significativamente más potente que el esomeprazol durante la noche. Sin embargo, la relevancia terapéutica de esta ventaja farmacológica merece un estudio más profundo. [17]
Los IBP se han utilizado con éxito en regímenes de terapia triple con claritromicina y amoxicilina para la erradicación de Helicobacter pylori sin diferencias significativas entre diferentes regímenes basados en IBP. [10]
A pesar de que los IBP han revolucionado el tratamiento de la ERGE , todavía hay margen de mejora en la velocidad de inicio de la supresión ácida, así como en el modo de acción que es independiente de un entorno ácido y también en una mejor inhibición de la bomba de protones. [8] Por lo tanto, en los últimos años se ha estado desarrollando una nueva clase de IBP, los bloqueadores de ácido competitivos con potasio (P-CAB) o los antagonistas de la bomba ácida (APA), que probablemente serán la próxima generación de fármacos que supriman la actividad gástrica. [32] Estos nuevos agentes pueden inhibir de forma reversible y competitiva el paso final de la secreción ácida gástrica con respecto a la unión de K + a la ATPasa H + /K + gástrica de las células parietales . Es decir, bloquean la acción de la ATPasa H + /K + uniéndose al sitio del canal K + o cerca de él. Dado que la unión es competitiva y reversible, estos agentes tienen el potencial de lograr una inhibición más rápida de la secreción ácida y una mayor duración de la acción en comparación con los IBP, lo que da como resultado un alivio de los síntomas y una curación más rápidos. [33] [34] El compuesto SCH28080 basado en imidazopiridina fue el prototipo de esta clase y resultó ser hepatotóxico. [35] Los agentes más nuevos que se encuentran actualmente en desarrollo incluyen CS-526, linaprazan , soraprazan y revaprazan, en los que este último ha llegado a ensayos clínicos. Quedan estudios para determinar si estos u otros compuestos relacionados pueden resultar útiles. [34] [36] En junio de 2006, Yuhan obtuvo la aprobación de la FDA coreana para el uso de revaprazan (nombre comercial Revanex) en el tratamiento de la gastritis. [37]
El vonoprazan es un fármaco más nuevo con una acción más rápida y duradera, que se comercializó primero en Japón, luego en Rusia y en 2023 se aprobó su uso en los EE. UU. Todavía se está probando en el Reino Unido. [38]