Babesia , [3] [4] también llamada Nuttallia , [5] es un parásito apicomplejo que infecta los glóbulos rojos y se transmite por garrapatas . Descubierta originalmente por el bacteriólogo rumano Victor Babeș en 1888,desde entonces se han identificado más de 100 especies de Babesia . [6] [7]
Babesia comprende más de 100 especies de parásitos transmitidos por garrapatas que infectan los eritrocitos (glóbulos rojos) en muchos huéspedes vertebrados. [8]
Las especies de Babesia infectan al ganado en todo el mundo, a los animales vertebrados domésticos y salvajes y, ocasionalmente, a los humanos, donde causan la enfermedad babesiosis . [9] [7] En los Estados Unidos, B. microti es la cepa más común de las pocas que se ha documentado que causan enfermedades en humanos.

Babesia es un parásito protozoario que infecta a animales vertebrados, principalmente ganado, mamíferos y aves, pero ocasionalmente también a humanos. Los nombres comunes de la enfermedad que causa Babesia microti son fiebre del ganado de Texas, fiebre de aguas rojas, fiebre de garrapatas y fiebre de Nantucket. [7] La enfermedad que causa en los humanos, la babesiosis, también se llama piroplasmosis. [9]
Babesia microti , sin embargo, no forma parte del género Babesia . Debido a clasificaciones erróneas históricas, el protozoo ha sido etiquetado con muchos nombres, incluido Nuttallia, [5] y se le cambió el nombre de Babesia microti a Theileria microti según la evidencia de 2006. Su secuencia genética , publicada en 2012, muestra que la especie no pertenece a ninguno de los dos. Babesia ni Theileria, sino a un género separado. [10] Otro grupo "occidental" también está separado del núcleo Babesia . [2]
Las especies aviares de Babesia se caracterizan por tener formas anulares y ameboideas , y esquizontes tétrada en forma de abanico o cruciforme (en forma de cruz) . Sólo se ha informado sobre el desarrollo de parásitos en los glóbulos rojos. [11]
Durante siglos, se sabía que esta enfermedad animal era una enfermedad grave para los animales salvajes y domésticos, especialmente el ganado. En 1888, Victor Babeș identificó por primera vez el agente causal en Rumania y creyó que se debía a la bacteria que llamó Haematococcus bovis . Documentó la enfermedad describiendo signos de una enfermedad hemolítica grave que se observa únicamente en ganado vacuno y ovino. [7] [12]
En 1893, los estadounidenses Theobald Smith y Fred Kilborne identificaron el parásito como la causa de la fiebre del ganado de Texas, la misma enfermedad descrita por Babeș. También identificaron a la garrapata como el agente transmisor, un descubrimiento que introdujo por primera vez el concepto de que los artrópodos funcionan como vectores de enfermedades . [13]
Se creía que era una enfermedad que sólo afectaba a los mamíferos no humanos, pero en 1957 se observó el primer caso de babesiosis en un humano. [9] La persona había sido esplenectomizada , como todas las personas diagnosticadas con babesiosis hasta 1969, cuando se diagnosticó el primer caso de babesiosis en una persona que todavía tenía el bazo . Esto demostró que el parásito era un patógeno potencial en cualquier persona. [14]
Babesia muestra especificidad de huésped , lo que permite que surjan muchas subespecies diferentes de Babesia , cada una de las cuales infecta un tipo diferente de organismo vertebrado. [15] Si bien B. bovis y Babesia bigemina prefieren infectar al ganado en ambientes tropicales, pueden infectar a otros animales, como el venado de cola blanca . [15] Por lo tanto, si bien el organismo tiene la capacidad de mostrar especificidad de huésped y, por lo tanto, aumentar la efectividad de la transmisión, aún puede infectar una variedad de huéspedes. [15] Lo logra mediante mutaciones y selección natural. En diferentes entornos, los protozoos individuales pueden desarrollar mutaciones que, cuando aumentan la aptitud de los protozoos , permiten que la población aumente su número. Esta especificidad explica por qué Babesia tiene una diversidad genética tan grande. [15]
Babesia persiste egoístamente a largo plazo en el sistema del huésped: el huésped no obtiene ningún beneficio de la invasión del parásito y sólo sufre. Esto permite al parásito explotar todos los recursos ofrecidos por el huésped, aumentar en número y aumentar la tasa de transmisión. [15] Una infección demasiado letal provoca la muerte del huésped y el parásito no puede propagarse, lo cual es una pérdida desde el punto de vista evolutivo. [15] Diferentes especies de Babesia son capaces de resistir el estrés del sistema inmunológico del huésped. La infección normalmente estimula el sistema inmunológico innato y no el sistema inmunológico humoral . [15] Esto da como resultado el control de la infección, pero también la persistencia y no la eliminación del parásito. [15]
El genoma de B. microti ha sido secuenciado y muestra que la especie no pertenece ni a Babesia ni a Theileria, sino a un género separado. [10] A partir de 2013 [actualizar], se sabe que el genoma mitocondrial es lineal como otros genomas mitocondriales de Apicomplexa secuenciados , aunque inicialmente se informó que era circular. [dieciséis]
La secuenciación parcial de ARN de piroplasmas caninos ha identificado varias especies adicionales. [ cita necesaria ]
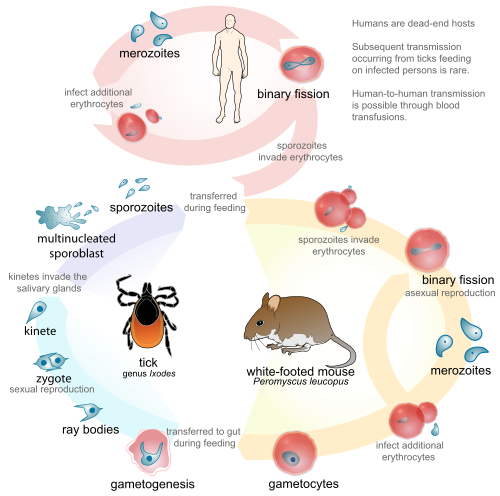
El ciclo de vida de B. microti , que es típico de los parásitos del género, requiere una etapa biológica en un huésped roedor o ciervo . Se transmite por garrapatas de la familia Ixodidae entre estos huéspedes. Para empezar, la garrapata, como huésped definitivo , se infecta a sí misma, ya que absorbe gametocitos cuando se adhiere para alimentarse de sangre. También introduce Babesia en el huésped intermediario (por ejemplo, ganado) cuando se ingiere sangre. A medida que Babesia ingresa a los glóbulos rojos del animal (eritrocitos), se les llama esporozoítos . Dentro de los glóbulos rojos, los protozoos se vuelven cíclicos y se convierten en un anillo de trofozoíto . Los trofozoítos se mudan a merozoítos , que tienen una estructura de tétrada denominada forma de cruz de Malta . [17] El crecimiento de trofozoitos y merozoitos rompe los eritrocitos del huésped, lo que lleva a la liberación de vermículas, los cuerpos parásitos infecciosos, que rápidamente propagan los protozoos por toda la sangre. [9] En lugar de producir más y más trofozoitos, algunos de los merozoitos producen gametocitos . Los gametos son fertilizados en el intestino de la garrapata y se convierten en esporozoítos en las glándulas salivales. Estos son los esporozoítos que introduce la garrapata infectada cuando pica a un huésped intermediario. Incluso como huésped incidental , los cambios de fase que ocurren en el parásito son los mismos en los humanos que en los huéspedes biológicos. La babesia se puede diagnosticar en la etapa de trofozoítos y también se puede transmitir de persona a persona a través de la garrapata vectora, mediante transfusiones de sangre o mediante transmisión congénita (de una madre infectada a su bebé). [18] [6]
El clima frío interrumpe por completo la transmisión. [19] Se ha descubierto que la aparición de enfermedades transmitidas por garrapatas coincide con el cambio climático. [20] No se sabe que la correlación entre el cambio climático y la incidencia de enfermedades transmitidas por garrapatas sea lo suficientemente fuerte como para considerarse un factor importante. [20]
La alta humedad y las precipitaciones favorecen a las garrapatas portadoras de Babesia . [21] Esto puede explicar por qué ha aumentado la infección por B. bigemina en el ganado bovino en la región montañosa de Meghalaya . [21] La duración de la vida y el número de generaciones de Babesia microplus se correlacionan con el aumento de la longevidad de las larvas y el número de generaciones anuales. [21] El clima cálido y seco interfiere con el ciclo de vida de Babesia dentro de la garrapata. [19] El clima cálido y húmedo aumenta la intensidad de la infestación: la población puede prosperar gracias al ambiente relativamente fluido que hace que el agua y los nutrientes sean más accesibles. [19]
Las especies de Babesia se transmiten a través de la saliva de una garrapata cuando ésta pica. Ya en su etapa ninfal , la garrapata muerde la piel para alimentarse de sangre. La garrapata, si no se elimina, permanece adherida durante tres o cuatro días, y los períodos más prolongados de alimentación se asocian con una mayor probabilidad de adquirir el parásito. El parásito puede sobrevivir en la garrapata mientras muda a través de sus diversas etapas de desarrollo, lo que hace que todas las etapas de la garrapata sean potencialmente infecciosas. Algunas especies de Babesia pueden transmitirse de una garrapata hembra a su descendencia antes de migrar a las glándulas salivales para alimentarse. [9] No se ha demostrado que B. microti , la especie más común en humanos, se transmita por vía transovárica . [6]
Las garrapatas de animales domésticos que transmiten Babesia y causan muchas enfermedades incluyen las muy extendidas garrapatas del ganado, Rhipicephalus (Boophilus) microplus y R.(B.) decoloratus . Estas garrapatas tienen un ciclo de alimentación estricto de un solo huésped en el ganado, por lo que Babesia solo puede transmitirse por vía transovárica.
En América, Ixodes scapularis es el vector más común. Esta garrapata dura, comúnmente conocida como garrapata del venado, también es vector de otras enfermedades asociadas a las garrapatas, como la enfermedad de Lyme . Muchas especies de Babesia sólo infectan a huéspedes mamíferos no humanos, más comúnmente ganado vacuno, caballos y ovejas. B. microti y B. divergens son las dos principales especies patógenas en humanos. Se teoriza que sus reservorios son el ratón de patas blancas ( Peromyscus leucopus ), los topillos del género Microtus y el venado de cola blanca ( Odocoileus virginianus ). [22] Estas especies de bosques son reservorios hipotéticos porque, aunque se sabe que albergan la enfermedad, aún no se ha demostrado que sean completos como reservorios. [23]
La mayoría de los casos de transmisión entre humanos se atribuyen a una garrapata vectora. En 2003, los Centros para el Control y la Prevención de Enfermedades (CDC) reconocieron más de 40 casos de babesiosis contraída por transfusiones de concentrados de glóbulos rojos (PRBC), así como dos infecciones documentadas por trasplante de órganos. Las transfusiones de glóbulos rojos que causan infecciones se identificaron mediante pruebas del donante de sangre para detectar anticuerpos contra B. microti . [24] La aparición de la transmisión de Babesia a través de transfusiones de sangre de GRBC ejerce presión sobre las organizaciones gubernamentales (como los CDC) para que aumenten las medidas estándar para la detección de donaciones de sangre . [ cita necesaria ]
La transmisión también es posible mediante transmisión congénita (de una madre infectada a su bebé). Como es posible que no aparezcan síntomas, es posible que muchas mujeres no sepan que están infectadas durante el embarazo y, por lo tanto, en este momento no se conoce una medición de la tasa de transmisión congénita. [25]
Actualmente no se han identificado vectores de Babesia aviar , pero se supone que son garrapatas. [11] Las especies de Babesia requieren huéspedes vertebrados e invertebrados competentes para mantener los ciclos de transmisión. [26]
De las especies que infectan a los humanos, B. microti es la más común en América, mientras que B. divergens es la cepa predominante que se encuentra en Europa. Las áreas endémicas son regiones de hábitat de garrapatas, incluidas las regiones forestales del noreste de Estados Unidos y las regiones templadas de Europa. [27] Ixodidae, las garrapatas vectores de B. microti , también transmiten la más conocida Borrelia burgdorferi , el agente causante de la enfermedad de Lyme. Por razones que aún no están claras, en áreas endémicas tanto de la enfermedad de Lyme como de la babesiosis, la transmisión de la enfermedad de Lyme prevalece y es más predominante en la región. [9] La prevalencia de la babesiosis en regiones endémicas de malaria sigue siendo desconocida debido a la probabilidad de un diagnóstico erróneo de malaria. [28] Como la enfermedad produce un gran número de personas asintomáticas, muchas poblaciones pueden poseer una alta seroprevalencia sin mucha documentación de la enfermedad. Por ejemplo, en Rhode Island y Nantucket, se ha medido que la seroprevalencia es del 20 al 25%. [9] La prevalencia de la babesiosis se documenta principalmente durante los meses de mayo a septiembre, cuando la actividad de las garrapatas en las regiones endémicas es alta. [27]
Hay 15 especies de aves de Babesia, y se han reportado cuatro Babesia en huéspedes marinos. Babesia poelea fue descrita en piqueros marrones ( Sula leucogaster ) en Sand Island, Johnston Atoll, Pacífico Central. [29] B. poelea fue reportada a partir de un piquero enmascarado ( Sula dactylatra melanops ) de la isla Desnoeufs , Amirantes , Seychelles . [30] Babesia peircei se ha observado en 2 especies de pingüinos, el pingüino burro ( Sphenicus demersus ) de Sudáfrica y el pingüino pequeño ( Eduyptula minor ) del sur de Australia. [31] [32] Babesia bennetti se asoció con la gaviota patiamarilla ( Larus cachinnans ) de la isla de Benidorm frente a la costa de España. [32] Babesia uriae se encontró en araos comunes en California.
En Europa se notificaron alrededor de 40 casos de babesiosis humana, causada por protozoos intraeritrocíticos (protozoos dentro de los glóbulos rojos) del género Babesia . [33]
La babesiosis bovina causada por B. bovis es una limitación importante para las industrias ganaderas en todo el mundo. [ cita necesaria ]
Los signos de infección por B. microti suelen aparecer entre una y ocho semanas después de la picadura de una garrapata infecciosa. [27] Las infecciones por B. divergens tienen un período de latencia más corto, que generalmente oscila entre una y tres semanas. [28] La gravedad de las infecciones por B. microti varía. En el 25% de los casos en adultos y el 50% de los casos en niños, la enfermedad es asintomática o leve con síntomas similares a los de la gripe. En otros casos, los síntomas se caracterizan por fiebres irregulares, escalofríos, dolores de cabeza, letargo general, dolor y malestar general . [9] En casos graves, se han documentado los efectos de la multiplicación parasitaria, síntomas como anemia hemolítica , ictericia , dificultad para respirar y hemoglobinuria . [7] [28] Las personas con función inmune normal y bazo sano a menudo se recuperan sin tratamiento. [9]
Los pacientes esplenectomizados son más susceptibles a contraer la enfermedad y pueden morir entre cinco y ocho días después de la aparición de los síntomas. [27] Tienen anemia hemolítica grave y se ha documentado hepatomegalia ocasional. Los niveles de parasitemia pueden alcanzar hasta el 85% en pacientes sin bazo, en comparación con el 1-10% en personas con bazo y sistemas inmunológicos eficaces. [28]
Las complicaciones incluyen insuficiencia respiratoria aguda , insuficiencia cardíaca congestiva e insuficiencia renal . Las infecciones pueden ser mortales en entre el 5% y el 10% de los pacientes hospitalizados, con mayor riesgo de muerte en personas inmunodeprimidas , ancianos y aquellos también infectados con la enfermedad de Lyme . [28] Las infecciones por B. divergens tienen una tasa de mortalidad mucho más alta (42%) y se presentan con síntomas más graves. Las personas infectadas experimentan hemoglobinuria seguida de ictericia, fiebre alta persistente, escalofríos y sudores. Si no se tratan, las infecciones por B. divergens pueden convertirse en síntomas similares a los de un shock con edema pulmonar e insuficiencia renal. [28]
en aves
Actualmente se desconoce la patogenicidad de B. uriae para el arao . Se encontraron aves con lesiones , anemia y dificultad respiratoria, y los tejidos de las aves hospedadoras se vieron afectados. [11] Las infecciones por Babesia peircei pueden causar anemia leve, leucocitosis y deterioro de la función hepática en los pingüinos africanos . [34]
Como parásito protozoario, la forma más eficaz de identificar la infección por Babesia es mediante análisis de muestras de sangre .
Las especies de Babesia ingresan a los glóbulos rojos (eritrocitos) en la etapa de esporozoitos. Dentro de los glóbulos rojos, los protozoos se vuelven cíclicos y se convierten en un anillo de trofozoíto. Los trofozoítos se mudan a merozoítos, que tienen una estructura de tétrada denominada forma de cruz de Malta . [17] Esta morfología de tétrada vista con la tinción de Giemsa de un frotis de sangre fino es exclusiva de Babesia y la distingue de Plasmodium falciparum , un protozoo de morfología similar que causa la malaria. El crecimiento de trofozoitos y merozoitos rompe los eritrocitos del huésped, lo que lleva a la liberación de vermículas, los cuerpos parásitos infecciosos, que propagan rápidamente los protozoos por toda la sangre. [9] Es importante prestar atención a las morfologías particulares de Babesia en frotis de sangre, debido a su gran similitud con el parásito de la malaria Plasmodium falciparum . Esto ha provocado que muchos pacientes con babesiosis sean diagnosticados erróneamente. Los pocos factores distintivos de Babesia incluyen protozoos con diferentes formas y tamaños, el potencial de contener vacuolas y la falta de producción de pigmentos. Los trofozoítos que aparecen en una formación de tétrada dentro de un eritrocito también son indicativos de Babesia . [ cita necesaria ]
A pesar de muchos estudios sobre la babesiosis y la malaria, el diagnóstico erróneo mediante frotis de sangre puede ser frecuente y problemático. Para complementar un frotis de sangre, el diagnóstico debe realizarse con una prueba de anticuerpos fluorescentes indirectos (IFA). La prueba IFA tiene una especificidad mucho mayor que los frotis de sangre teñidos, con detección de anticuerpos en el 88-96% de los pacientes infectados. [6] Las medidas de diagnóstico mediante pruebas de anticuerpos también son particularmente útiles para identificar la prevalencia sérica en individuos asintomáticos. Debido a la transmisibilidad de Babesia a través de transfusiones de sangre, las pruebas IFA serían un medio eficaz para detectar la enfermedad en donaciones de sangre.
Históricamente, el diagnóstico de babesiosis se realizaba con xenodiagnóstico en hámsteres para B. microti y en jerbos para B. divergens . [9] Esta técnica de diagnóstico se ha abandonado en favor de medidas de diagnóstico más rápidas.
Hay varios métodos disponibles para controlar y tratar la babesiosis en animales. [ cita necesaria ]
En los seres humanos, muchos se recuperan espontáneamente y sólo han experimentado síntomas leves que no se diagnostican como enfermedad. Esto casi siempre se observa en las infecciones por B. microti , que generalmente son más comunes en los Estados Unidos. Para las infecciones por B. divergens y más graves por B. microti , históricamente el tratamiento estándar para personas sintomáticas era clindamicina oral o intravenosa con quinina oral . [6] Sin embargo, con los resultados de la investigación completada en 2000, los regímenes de tratamiento se han inclinado cada vez más hacia la atovacuona oral con azitromicina oral . Se prefieren estos últimos, ya que son igualmente eficaces en todos los casos excepto en los más graves y presentan menos reacciones adversas asociadas . [35] En casos graves, se han realizado exanguinotransfusiones de sangre para reducir la carga parasitaria en un individuo. [9] Otras medidas incluyen abordar y corregir los signos clínicos anormales. [7]
En aves marinas, la primaquina se ha utilizado en un estudio para demostrar un tratamiento eficaz en huéspedes infectados. [36] El tratamiento para la babesiosis consistió en primaquina (1 mg/kg VO cada 24 h durante 10 días; fosfato de primaquina 1,76% m/v en solución estabilizada, Primaquin Solution, MedPet Ltd, Benrose , Sudáfrica). Después, el tratamiento fue seguido por un suplemento de fosfolípidos (1 cápsula/ave VO cada 24 h durante 12 días; fosfolípidos de soja enriquecidos y desengrasados , 300 mg/cápsula, Essentiale Extreme, Sanofi Aventis Ltd, Midrand , Sudáfrica); como un intento de mitigar los posibles efectos hepatotóxicos de la primaquina. Para prevenir la transmisión de Babesia y otros patógenos transmitidos por garrapatas, todas las aves con ectoparásitos visibles son tratadas con pesticida en polvo ( carbaril 50 g/kg) al momento de su ingreso y las instalaciones se limpian minuciosamente diariamente. [36]
En 1906, se hicieron esfuerzos para erradicar la garrapata vectora de la babesiosis bovina en los Estados Unidos. Se registró que esta erradicación se completó con éxito cuatro décadas después. [7]
Se puede lograr un control eficaz mediante la vacunación con fenotipos vivos atenuados del parásito. Las vacunas tienen varios inconvenientes, por lo que todavía se están investigando vacunas mejores y más seguras. [ cita necesaria ] En reciente [ ¿cuándo? ] años, se han descubierto varias proteínas del parásito con potencial inmunogénico . Mediante reacción en cadena de la polimerasa , secuenciación genética y análisis bioinformático de los genes, se encontró un alto grado de conservación (98-100%) entre los aislados brasileños de B. bovis y el aislado T2Bo. Por lo tanto, se considera la inclusión de estos genes en un cóctel de vacuna recombinante para la babesiosis bovina causada por B. bovis . [ cita necesaria ]
La medida de salud pública más eficaz para Babesia es evitar la exposición a las garrapatas. Esto se puede lograr mediante la prevención personal, como evitar áreas infestadas de garrapatas (especialmente durante la temporada alta de garrapatas entre mayo y septiembre), permanecer cubierto con ropa ligera, buscar garrapatas después de estar al aire libre y eliminar de la piel las garrapatas descubiertas. [28] Otras medidas incluyen la aplicación de DEET , un repelente común que es eficaz contra garrapatas e insectos. (Para las personas que reaccionan adversamente al DEET, se deben usar repelentes de insectos alternativos). A nivel estatal, si los departamentos de salud están particularmente motivados, la eliminación de las garrapatas es una posibilidad. En 1906, se hicieron esfuerzos para erradicar la garrapata vectora de la babesiosis, enfermedad bovina, en los Estados Unidos. Se registró que esta erradicación se completó con éxito cuatro décadas después. [7]
La erradicación completa mediante el control de vectores sería un proyecto a largo plazo, que reduciría significativamente la prevalencia tanto de la babesiosis como de la enfermedad de Lyme, pero, como los departamentos de salud pública suelen tener escasez de fondos, se recomiendan más medidas preventivas. [ cita necesaria ]
Debido a la prevalencia relativamente baja de la enfermedad humana y la presencia de varios reservorios, la babesiosis no ha sido candidata para vacunas. En las regiones donde las garrapatas de los animales domésticos se controlan habitualmente con acaricidas químicos para reducir la incidencia de infección por B. bovis y B. bigemina , se reducirá el riesgo de estos parásitos para los seres humanos.
Figura 2. Panel de imágenes electrónicas generadas por computadora de fotomicrografías de eritrocitos infectados con
Babesia
en un frotis de sangre periférica teñido con Giemsa...