La apoptosis (del griego antiguo : ἀπόπτωσις , romanizado : apóptōsis , lit. 'caída') es una forma de muerte celular programada que ocurre en organismos multicelulares y en algunos microorganismos eucariotas unicelulares como la levadura . [1] Los eventos bioquímicos conducen a cambios celulares característicos ( morfología ) y muerte. [2] Estos cambios incluyen la formación de ampollas , la contracción celular , la fragmentación nuclear , la condensación de la cromatina , la fragmentación del ADN y la descomposición del ARNm . El ser humano adulto promedio pierde de 50 a 70 mil millones de células cada día debido a la apoptosis. [a] Para el niño humano promedio entre 8 y 14 años, cada día la pérdida aproximada es de 20 a 30 mil millones de células. [4]
A diferencia de la necrosis , que es una forma de muerte celular traumática que resulta de una lesión celular aguda, la apoptosis es un proceso altamente regulado y controlado que confiere ventajas durante el ciclo de vida de un organismo. Por ejemplo, la separación de los dedos de las manos y de los pies en un embrión humano en desarrollo se produce porque las células entre los dedos sufren apoptosis. A diferencia de la necrosis, la apoptosis produce fragmentos celulares llamados cuerpos apoptóticos que los fagocitos pueden engullir y eliminar antes de que el contenido de la célula pueda derramarse sobre las células circundantes y causarles daño. [5]
Debido a que la apoptosis no puede detenerse una vez que ha comenzado, es un proceso altamente regulado. La apoptosis puede iniciarse a través de una de dos vías. En la vía intrínseca, la célula se mata a sí misma porque detecta estrés celular , mientras que en la vía extrínseca, la célula se mata a sí misma debido a señales de otras células. Las señales externas débiles también pueden activar la vía intrínseca de la apoptosis. [6] Ambas vías inducen la muerte celular activando caspasas , que son proteasas o enzimas que degradan proteínas. Las dos vías activan caspasas iniciadoras, que luego activan caspasas verdugas, que luego matan a la célula degradando proteínas indiscriminadamente.
Además de su importancia como fenómeno biológico, los procesos apoptóticos defectuosos se han visto implicados en una amplia variedad de enfermedades. La apoptosis excesiva causa atrofia , mientras que una cantidad insuficiente da lugar a una proliferación celular descontrolada, como el cáncer . Algunos factores como los receptores Fas y las caspasas promueven la apoptosis, mientras que algunos miembros de la familia de proteínas Bcl-2 la inhiben. [7]
El científico alemán Carl Vogt fue el primero en describir el principio de la apoptosis en 1842. En 1885, el anatomista Walther Flemming entregó una descripción más precisa del proceso de muerte celular programada. Sin embargo, no fue hasta 1965 que el tema resucitó. Mientras estudiaba tejidos utilizando microscopía electrónica, John Kerr en la Universidad de Queensland pudo distinguir la apoptosis de la muerte celular traumática. [8] Después de la publicación de un artículo que describía el fenómeno, Kerr fue invitado a unirse a Alastair Currie , así como a Andrew Wyllie , quien era estudiante de posgrado de Currie, [9] en la Universidad de Aberdeen . En 1972, el trío publicó un artículo seminal en el British Journal of Cancer . [10] Kerr había utilizado inicialmente el término necrosis celular programada, pero en el artículo, el proceso de muerte celular natural se llamó apoptosis . Kerr, Wyllie y Currie atribuyeron a James Cormack, profesor de lengua griega en la Universidad de Aberdeen, la sugerencia del término apoptosis. Kerr recibió el premio Paul Ehrlich y Ludwig Darmstaedter el 14 de marzo de 2000 por su descripción de la apoptosis. Compartió el premio con el biólogo de Boston H. Robert Horvitz . [11]
Durante muchos años, ni la "apoptosis" ni la "muerte celular programada" fueron términos muy citados. Dos descubrimientos hicieron que la muerte celular pasara de ser un tema de anonimato a convertirse en un importante campo de investigación: la identificación del primer componente de los mecanismos de control y efecto de la muerte celular, y la vinculación de las anomalías en la muerte celular con las enfermedades humanas, en particular el cáncer. Esto ocurrió en 1988, cuando se demostró que BCL2, el gen responsable del linfoma folicular, codificaba una proteína que inhibía la muerte celular. [12]
El Premio Nobel de Medicina de 2002 fue otorgado a Sydney Brenner , H. Robert Horvitz y John Sulston por su trabajo en la identificación de genes que controlan la apoptosis. Los genes fueron identificados mediante estudios en el nematodo C. elegans y los homólogos de estos genes funcionan en humanos para regular la apoptosis.

En griego, apoptosis se traduce como la "caída" de las hojas de un árbol. [13] Cormack, profesor de lengua griega, reintrodujo el término para uso médico, ya que tenía un significado médico para los griegos más de dos mil años antes. Hipócrates usó el término para significar "la caída de los huesos". Galeno extendió su significado a "la caída de las costras". Cormack sin duda era consciente de este uso cuando sugirió el nombre. El debate continúa sobre la pronunciación correcta, con la opinión dividida entre una pronunciación con la segunda p muda ( / æ p ə ˈ t oʊ s ɪ s / ap-ə- TOH -sis [14] [15] ) y la segunda p pronunciada ( / eɪ p ə p ˈ t oʊ s ɪ s / ). [14] [16] En inglés, la p del grupo consonántico griego -pt- normalmente no se pronuncia al principio de una palabra (por ejemplo, pterodactyl , Ptolemy ), pero se articula cuando se usa en formas combinadas precedidas por una vocal, como en helicóptero o los órdenes de insectos: diptera , lepidoptera , etc.
En el artículo original de Kerr, Wyllie y Currie, [10] hay una nota al pie sobre la pronunciación:
Estamos muy agradecidos al profesor James Cormack del Departamento de Griego de la Universidad de Aberdeen por sugerir este término. La palabra "apoptosis" ( ἀπόπτωσις ) se utiliza en griego para describir la "caída" o "desprendimiento" de los pétalos de las flores o de las hojas de los árboles. Para mostrar la derivación con claridad, proponemos que el acento esté en la penúltima sílaba, y que la segunda mitad de la palabra se pronuncie como "ptosis" (sin la "p" pronunciada), que proviene de la misma raíz "caer", y ya se utiliza para describir la caída del párpado superior.

El inicio de la apoptosis está estrechamente regulado por mecanismos de activación, porque una vez que la apoptosis ha comenzado, inevitablemente conduce a la muerte de la célula. [17] [2] Los dos mecanismos de activación mejor entendidos son la vía intrínseca (también llamada vía mitocondrial ) y la vía extrínseca. [18] La vía intrínseca se activa por señales intracelulares generadas cuando las células están estresadas y depende de la liberación de proteínas del espacio intermembrana de las mitocondrias. [19] La vía extrínseca se activa por ligandos extracelulares que se unen a los receptores de muerte de la superficie celular, lo que conduce a la formación del complejo de señalización inductor de muerte (DISC). [20]
Una célula inicia una señalización apoptótica intracelular en respuesta a un estrés, [21] que puede provocar el suicidio celular. La unión de los receptores nucleares por glucocorticoides , [22] calor, [22] radiación, [22] privación de nutrientes, [22] infección viral, [22] hipoxia , [22] aumento de la concentración intracelular de ácidos grasos libres [23] y aumento de la concentración intracelular de calcio , [24] [25] por ejemplo, por daño a la membrana, pueden desencadenar la liberación de señales apoptóticas intracelulares por una célula dañada. Una serie de componentes celulares, como la poli ADP ribosa polimerasa , también pueden ayudar a regular la apoptosis. [26] Se han observado fluctuaciones de células individuales en estudios experimentales de apoptosis inducida por estrés. [27] [28]
Antes de que las enzimas provoquen el proceso de muerte celular, las señales apoptóticas deben hacer que las proteínas reguladoras inicien la vía de la apoptosis. Este paso permite que esas señales provoquen la muerte celular o que se detenga el proceso si la célula ya no necesita morir. Hay varias proteínas implicadas, pero se han identificado dos métodos principales de regulación: la focalización de la funcionalidad de las mitocondrias [29] o la transducción directa de la señal a través de proteínas adaptadoras a los mecanismos apoptóticos. Una vía extrínseca para la iniciación identificada en varios estudios de toxinas es un aumento de la concentración de calcio dentro de una célula causado por la actividad de un fármaco, que también puede causar apoptosis a través de una proteasa de unión al calcio, la calpaína .
La vía intrínseca también se conoce como vía mitocondrial. Las mitocondrias son esenciales para la vida multicelular. Sin ellas, una célula deja de respirar aeróbicamente y muere rápidamente. Este hecho constituye la base de algunas vías apoptóticas. Las proteínas apoptóticas que se dirigen a las mitocondrias las afectan de diferentes maneras. Pueden causar hinchazón mitocondrial a través de la formación de poros en la membrana, o pueden aumentar la permeabilidad de la membrana mitocondrial y hacer que los efectores apoptóticos se escapen. [22] [30] También hay un creciente cuerpo de evidencia que indica que el óxido nítrico es capaz de inducir la apoptosis al ayudar a disipar el potencial de membrana de las mitocondrias y, por lo tanto, hacerla más permeable. [31] El óxido nítrico se ha implicado en la iniciación e inhibición de la apoptosis a través de su posible acción como molécula señal de vías posteriores que activan la apoptosis. [32]
Durante la apoptosis, el citocromo c se libera de las mitocondrias a través de las acciones de las proteínas Bax y Bak . El mecanismo de esta liberación es enigmático, pero parece provenir de una multitud de homo- y heterodímeros Bax/Bak de Bax/Bak insertados en la membrana externa. [33] Una vez que se libera el citocromo c , se une con el factor activador de la proteasa apoptótica - 1 ( Apaf-1 ) y el ATP , que luego se unen a la pro-caspasa-9 para crear un complejo proteico conocido como apoptosoma . El apoptosoma escinde la pro-caspasa a su forma activa de caspasa-9 , que a su vez escinde y activa la pro-caspasa en la efectora caspasa-3 .
Las mitocondrias también liberan proteínas conocidas como SMAC (segundo activador de caspasas derivado de mitocondrias ) en el citosol de la célula tras el aumento de la permeabilidad de las membranas mitocondriales. El SMAC se une a las proteínas que inhiben la apoptosis (IAP), desactivándolas y evitando que las IAP detengan el proceso y, por tanto, permitan que se produzca la apoptosis. La IAP también suprime normalmente la actividad de un grupo de cisteína proteasas llamadas caspasas [34] , que llevan a cabo la degradación de la célula. Por tanto, se puede observar que las enzimas de degradación reales están reguladas indirectamente por la permeabilidad mitocondrial.
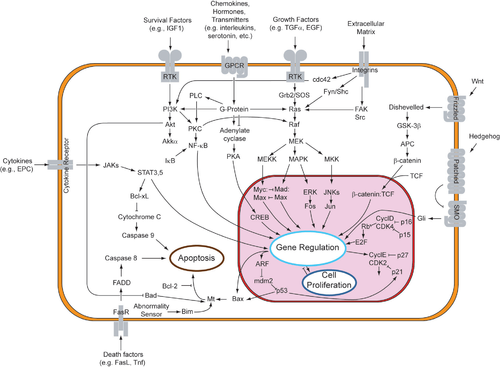
Se han sugerido dos teorías sobre la iniciación directa de los mecanismos apoptóticos en mamíferos: el modelo inducido por TNF ( factor de necrosis tumoral ) y el modelo mediado por el ligando Fas-Fas , ambos involucrando receptores de la familia del receptor TNF (TNFR) [35] acoplados a señales extrínsecas.
El TNF-alfa es una citocina producida principalmente por macrófagos activados y es el principal mediador extrínseco de la apoptosis. La mayoría de las células del cuerpo humano tienen dos receptores para el TNF-alfa: TNFR1 y TNFR2 . Se ha demostrado que la unión del TNF-alfa al TNFR1 inicia la vía que conduce a la activación de la caspasa a través de las proteínas de membrana intermedias dominio de muerte asociado al receptor del TNF ( TRADD ) y proteína del dominio de muerte asociado a Fas ( FADD ). cIAP1 /2 puede inhibir la señalización del TNF-α uniéndose a TRAF2 . FLIP inhibe la activación de la caspasa-8. [36] La unión de este receptor también puede conducir indirectamente a la activación de factores de transcripción implicados en la supervivencia celular y las respuestas inflamatorias. [37] Sin embargo, la señalización a través del TNFR1 también podría inducir la apoptosis de forma independiente de la caspasa. [38] El vínculo entre el TNF-alfa y la apoptosis muestra por qué una producción anormal de TNF-alfa juega un papel fundamental en varias enfermedades humanas, especialmente en enfermedades autoinmunes . La superfamilia de receptores de TNF-alfa también incluye receptores de muerte (DR), como DR4 y DR5 . Estos receptores se unen a la proteína TRAIL y median la apoptosis. Se sabe que la apoptosis es uno de los mecanismos primarios de la terapia dirigida contra el cáncer. [39] Recientemente se han diseñado híbridos de complejo de iridio-péptido luminiscente (IPH), que imitan a TRAIL y se unen a los receptores de muerte en las células cancerosas, induciendo así su apoptosis. [40]
El receptor fas (First apoptosis signal) – (también conocido como Apo-1 o CD95 ) es una proteína transmembrana de la familia TNF que se une al ligando Fas (FasL). [35] La interacción entre Fas y FasL da como resultado la formación del complejo de señalización inductor de muerte (DISC), que contiene el FADD, la caspasa-8 y la caspasa-10. En algunos tipos de células (tipo I), la caspasa-8 procesada activa directamente a otros miembros de la familia de las caspasas y desencadena la ejecución de la apoptosis de la célula. En otros tipos de células (tipo II), el Fas -DISC inicia un ciclo de retroalimentación que se convierte en una espiral de liberación creciente de factores proapoptóticos de las mitocondrias y la activación amplificada de la caspasa-8. [41]
Tras la activación de TNF-R1 y Fas en células de mamíferos [ cita requerida ] se establece un equilibrio entre los miembros proapoptóticos ( BAX , [42] BID , BAK o BAD ) y antiapoptóticos ( Bcl-Xl y Bcl-2 ) de la familia Bcl-2 . Este equilibrio es la proporción de homodímeros proapoptóticos que se forman en la membrana externa de la mitocondria. Los homodímeros proapoptóticos son necesarios para hacer que la membrana mitocondrial sea permeable para la liberación de activadores de caspasa como el citocromo c y SMAC. El control de las proteínas proapoptóticas en condiciones celulares normales de células no apoptóticas no se entiende por completo, pero en general, Bax o Bak se activan mediante la activación de proteínas solo BH3, parte de la familia Bcl-2 . [43]
Las caspasas desempeñan un papel central en la transducción de señales apoptóticas del RE. Las caspasas son proteínas que son proteasas específicas de aspartato dependientes de cisteína altamente conservadas. Hay dos tipos de caspasas: caspasas iniciadoras (caspasas 2, 8, 9, 10, 11 y 12) y caspasas efectoras (caspasas 3, 6 y 7). La activación de las caspasas iniciadoras requiere la unión a una proteína activadora oligomérica específica . Las caspasas efectoras son luego activadas por estas caspasas iniciadoras activas a través de la escisión proteolítica . Las caspasas efectoras activas luego degradan proteolíticamente una serie de proteínas intracelulares para llevar a cabo el programa de muerte celular.
También existe una vía apoptótica independiente de la caspasa que está mediada por el AIF ( factor inductor de apoptosis ). [44]
La rana Xenopus laevis sirve como un sistema modelo ideal para el estudio de los mecanismos de la apoptosis. De hecho, el yodo y la tiroxina también estimulan la espectacular apoptosis de las células de las branquias, cola y aletas de las larvas en la metamorfosis de los anfibios, y estimulan la evolución de su sistema nervioso transformando al renacuajo acuático y vegetariano en la rana terrestre y carnívora . [45] [46] [47] [48]
La regulación negativa de la apoptosis inhibe las vías de señalización de muerte celular, lo que ayuda a los tumores a evadir la muerte celular y desarrollar resistencia a los fármacos . La relación entre las proteínas antiapoptóticas (Bcl-2) y proapoptóticas (Bax) determina si una célula vive o muere. [49] [50] Muchas familias de proteínas actúan como reguladores negativos categorizados en factores antiapoptóticos, como las proteínas IAP y Bcl-2 o factores de prosupervivencia como cFLIP , BNIP3 , FADD , Akt y NF-κB . [51]
Muchas vías y señales conducen a la apoptosis, pero estas convergen en un único mecanismo que realmente causa la muerte de la célula. Después de que una célula recibe un estímulo, sufre una degradación organizada de los orgánulos celulares por parte de las caspasas proteolíticas activadas . Además de la destrucción de los orgánulos celulares, el ARNm se degrada rápida y globalmente por un mecanismo que aún no está completamente caracterizado. [52] La degradación del ARNm se desencadena muy temprano en la apoptosis.
Una célula en proceso de apoptosis muestra una serie de cambios morfológicos característicos. Las alteraciones tempranas incluyen:
La apoptosis progresa rápidamente y sus productos se eliminan rápidamente, lo que dificulta su detección o visualización en cortes de histología clásica. Durante la cariorrexis, la activación de la endonucleasa deja fragmentos cortos de ADN, espaciados regularmente en tamaño. Estos dan una apariencia característica de "escalones" en el gel de agar después de la electroforesis . [57] Las pruebas de escalonamiento del ADN diferencian la apoptosis de la muerte celular isquémica o tóxica. [58]

Antes de que se elimine la célula apoptótica, se produce un proceso de desmontaje. Existen tres pasos reconocidos en el desmontaje de la célula apoptótica: [60]
La eliminación de células muertas por células fagocíticas vecinas se ha denominado eferocitosis . [66] Las células moribundas que pasan por las etapas finales de la apoptosis muestran moléculas fagocíticas, como la fosfatidilserina , en su superficie celular. [67] La fosfatidilserina se encuentra normalmente en la superficie interna de la membrana plasmática, pero se redistribuye durante la apoptosis a la superficie extracelular por una proteína conocida como scramblase . [68] Estas moléculas marcan la célula para la fagocitosis por células que poseen los receptores apropiados, como los macrófagos. [69] La eliminación de células moribundas por los fagocitos ocurre de manera ordenada sin provocar una respuesta inflamatoria . [70] Durante la apoptosis, el ARN y el ADN celulares se separan entre sí y se clasifican en diferentes cuerpos apoptóticos; la separación del ARN se inicia como segregación nucleolar. [71]
Se han realizado muchos knock-outs en las vías de apoptosis para probar la función de cada una de las proteínas. Varias caspasas, además de APAF1 y FADD , se han mutado para determinar el nuevo fenotipo. Para crear un knock-out del factor de necrosis tumoral (TNF), se eliminó del gen un exón que contenía los nucleótidos 3704–5364. [72] Este exón codifica una porción del dominio maduro del TNF, así como la secuencia líder, que es una región altamente conservada necesaria para el procesamiento intracelular adecuado. Los ratones TNF-/- se desarrollan normalmente y no tienen anomalías estructurales o morfológicas macroscópicas. Sin embargo, tras la inmunización con SRBC (glóbulos rojos de oveja), estos ratones demostraron una deficiencia en la maduración de una respuesta de anticuerpos; pudieron generar niveles normales de IgM, pero no pudieron desarrollar niveles específicos de IgG. [73] Apaf-1 es la proteína que activa la caspasa 9 por escisión para iniciar la cascada de caspasas que conduce a la apoptosis. [74] Dado que una mutación -/- en el gen APAF-1 es letal en el embrión, se utilizó una estrategia de trampa génica para generar un ratón APAF-1 -/-. Este ensayo se utiliza para alterar la función génica mediante la creación de una fusión génica intragénica. Cuando se introduce una trampa génica APAF-1 en las células, se producen muchos cambios morfológicos, como la espina bífida, la persistencia de las membranas interdigitales y el cerebro abierto. [75] Además, después del día embrionario 12,5, el cerebro de los embriones mostró varios cambios estructurales. Las células APAF-1 están protegidas de los estímulos de apoptosis, como la irradiación. Un ratón knock-out BAX-1 exhibe una formación normal del prosencéfalo y una muerte celular programada reducida en algunas poblaciones neuronales y en la médula espinal, lo que conduce a un aumento de las neuronas motoras. [76]
Las proteínas caspasa son partes integrales de la vía de la apoptosis, por lo que se deduce que los knock-outs realizados tienen diversos resultados perjudiciales. Un knock-out de caspasa 9 conduce a una malformación cerebral grave [ cita requerida ] . Un knock-out de caspasa 8 conduce a insuficiencia cardíaca y, por lo tanto, letalidad embrionaria [ cita requerida ] . Sin embargo, con el uso de la tecnología cre-lox, se ha creado un knock-out de caspasa 8 que exhibe un aumento en las células T periféricas, una respuesta de células T deteriorada y un defecto en el cierre del tubo neural [ cita requerida ] . Se encontró que estos ratones eran resistentes a la apoptosis mediada por CD95, TNFR, etc., pero no resistentes a la apoptosis causada por la radiación UV, los fármacos quimioterapéuticos y otros estímulos. Finalmente, un knock-out de caspasa 3 se caracterizó por masas de células ectópicas en el cerebro y características apoptóticas anormales como vesículas de membrana o fragmentación nuclear [ cita requerida ] . Una característica destacable de estos ratones KO es que tienen un fenotipo muy restringido: los ratones KO Casp3, 9, APAF-1 tienen deformaciones del tejido neural y los KO FADD y Casp 8 mostraron un desarrollo cardíaco defectuoso, sin embargo, en ambos tipos de KO otros órganos se desarrollaron normalmente y algunos tipos de células todavía eran sensibles a los estímulos apoptóticos, lo que sugiere que existen vías proapoptóticas desconocidas.

La obtención de imágenes de células vivas sin etiquetas , la microscopía de lapso de tiempo , la fluorocitometría de flujo y la microscopía electrónica de transmisión se pueden utilizar para comparar células apoptóticas y necróticas. También existen varias técnicas bioquímicas para el análisis de marcadores de superficie celular (exposición a la fosfatidilserina frente a la permeabilidad celular por citometría de flujo), marcadores celulares como la fragmentación del ADN [77] (citometría de flujo), [78] la activación de la caspasa, la escisión de Bid y la liberación del citocromo c ( Western blotting ). La detección del sobrenadante en busca de caspasas, HMGB1 y liberación de citoqueratina 18 puede identificar células necróticas primarias de secundarias. Sin embargo, todavía no se han identificado marcadores bioquímicos o de superficie distintos de la muerte celular necrótica, y solo hay marcadores negativos disponibles. Entre ellos se incluyen la ausencia de marcadores apoptóticos (activación de caspasa, liberación de citocromo c y fragmentación de ADN oligonucleosómico) y la cinética diferencial de los marcadores de muerte celular (exposición a la fosfatidilserina y permeabilización de la membrana celular). En estas referencias se puede encontrar una selección de técnicas que se pueden utilizar para distinguir la apoptosis de las células necrópticas. [79] [80] [81] [82]



Los muchos tipos diferentes de vías apoptóticas contienen una multitud de componentes bioquímicos diferentes, muchos de ellos aún no comprendidos. [83] Como una vía es más o menos secuencial por naturaleza, la eliminación o modificación de un componente produce un efecto en otro. En un organismo vivo, esto puede tener efectos desastrosos, a menudo en forma de enfermedad o trastorno. Una discusión de cada enfermedad causada por la modificación de las diversas vías apoptóticas sería poco práctica, pero el concepto subyacente a cada una es el mismo: el funcionamiento normal de la vía se ha interrumpido de tal manera que se perjudica la capacidad de la célula para experimentar una apoptosis normal. Esto da como resultado una célula que vive más allá de su "fecha de caducidad" y es capaz de replicarse y transmitir cualquier maquinaria defectuosa a su progenie, lo que aumenta la probabilidad de que la célula se vuelva cancerosa o enferma.
Un ejemplo recientemente descrito de este concepto en acción se puede ver en el desarrollo de un cáncer de pulmón llamado NCI-H460 . [84] La proteína inhibidora de la apoptosis ligada al cromosoma X ( XIAP ) se sobreexpresa en células de la línea celular H460 . Las XIAP se unen a la forma procesada de la caspasa-9 y suprimen la actividad del activador apoptótico citocromo c , por lo tanto, la sobreexpresión conduce a una disminución en el número de agonistas proapoptóticos. Como consecuencia, el equilibrio de los efectores antiapoptóticos y proapoptóticos se altera a favor de los primeros, y las células dañadas continúan replicándose a pesar de que se les ordena morir. Los defectos en la regulación de la apoptosis en células cancerosas ocurren a menudo a nivel de control de factores de transcripción. Como ejemplo particular, los defectos en las moléculas que controlan el factor de transcripción NF-κB en el cáncer cambian el modo de regulación transcripcional y la respuesta a las señales apoptóticas, para reducir la dependencia del tejido al que pertenece la célula. Este grado de independencia de las señales de supervivencia externas puede permitir la metástasis del cáncer. [85]
La proteína supresora de tumores p53 se acumula cuando el ADN se daña debido a una cadena de factores bioquímicos. Parte de esta vía incluye el interferón alfa y el interferón beta, que inducen la transcripción del gen p53 , lo que da como resultado el aumento del nivel de proteína p53 y la mejora de la apoptosis de las células cancerosas. [86] El p53 evita que la célula se replique deteniendo el ciclo celular en G1, o interfase, para darle tiempo a la célula para repararse; sin embargo, inducirá la apoptosis si el daño es extenso y los esfuerzos de reparación fallan. [87] Cualquier alteración en la regulación de los genes p53 o interferón dará como resultado una apoptosis deteriorada y la posible formación de tumores.
La inhibición de la apoptosis puede dar lugar a una serie de cánceres, enfermedades inflamatorias e infecciones víricas. En un principio se creía que la acumulación asociada de células se debía a un aumento de la proliferación celular, pero ahora se sabe que también se debe a una disminución de la muerte celular. La más común de estas enfermedades es el cáncer, la enfermedad de la proliferación celular excesiva, que a menudo se caracteriza por una sobreexpresión de miembros de la familia IAP . Como resultado, las células malignas experimentan una respuesta anormal a la inducción de la apoptosis: los genes reguladores del ciclo (como p53, ras o c-myc) se mutan o inactivan en las células enfermas, y otros genes (como bcl-2) también modifican su expresión en los tumores. Algunos factores apoptóticos son vitales durante la respiración mitocondrial, por ejemplo, el citocromo C. [88] La inactivación patológica de la apoptosis en las células cancerosas se correlaciona con frecuentes cambios metabólicos respiratorios hacia la glucólisis (una observación conocida como la "hipótesis de Warburg". [89]
La apoptosis en las células HeLa [b] es inhibida por proteínas producidas por la célula; estas proteínas inhibidoras se dirigen a las proteínas supresoras de tumores del retinoblastoma. [90] Estas proteínas supresoras de tumores regulan el ciclo celular, pero se vuelven inactivas cuando se unen a una proteína inhibidora. [90] Las proteínas E6 y E7 del VPH son inhibidoras expresadas por el virus del papiloma humano, siendo el VPH responsable de la formación del tumor cervical del que se derivan las células HeLa. [91] La E6 del VPH hace que la p53, que regula el ciclo celular, se vuelva inactiva. [92] La E7 del VPH se une a las proteínas supresoras de tumores del retinoblastoma y limita su capacidad para controlar la división celular. [92] Estas dos proteínas inhibidoras son parcialmente responsables de la inmortalidad de las células HeLa al inhibir la apoptosis. [93]
El principal método de tratamiento para la muerte potencial por enfermedades relacionadas con la señalización implica aumentar o disminuir la susceptibilidad de la apoptosis en las células enfermas, dependiendo de si la enfermedad es causada por la inhibición o el exceso de apoptosis. Por ejemplo, los tratamientos apuntan a restaurar la apoptosis para tratar enfermedades con muerte celular deficiente y aumentar el umbral apoptótico para tratar enfermedades involucradas con muerte celular excesiva. Para estimular la apoptosis, se puede aumentar el número de ligandos del receptor de muerte (como TNF o TRAIL), antagonizar la vía antiapoptótica Bcl-2 o introducir miméticos de Smac para inhibir el inhibidor (IAP). [49] La adición de agentes como Herceptin, Iressa o Gleevec actúa para detener el ciclo de las células y provoca la activación de la apoptosis al bloquear el crecimiento y la señalización de supervivencia más arriba. Finalmente, agregar complejos p53- MDM2 desplaza a p53 y activa la vía p53, lo que lleva a la detención del ciclo celular y la apoptosis. Se pueden utilizar muchos métodos diferentes para estimular o inhibir la apoptosis en varios lugares a lo largo de la vía de señalización de muerte. [94]
La apoptosis es un programa de muerte celular de múltiples pasos y múltiples vías que es inherente a cada célula del cuerpo. En el cáncer, la proporción entre la apoptosis y la división celular se altera. El tratamiento del cáncer con quimioterapia y radiación mata las células diana principalmente al inducir la apoptosis.
Por otra parte, la pérdida de control de la muerte celular (resultando en exceso de apoptosis) puede conducir a enfermedades neurodegenerativas, enfermedades hematológicas y daño tisular. Las neuronas que dependen de la respiración mitocondrial sufren apoptosis en enfermedades neurodegenerativas como el Alzheimer [95] y el Parkinson [96] (una observación conocida como la "hipótesis de Warburg inversa" [88] [97] ). Además, existe una comorbilidad epidemiológica inversa entre las enfermedades neurodegenerativas y el cáncer [98] . La progresión del VIH está directamente relacionada con el exceso de apoptosis no regulada. En un individuo sano, el número de linfocitos CD4+ está en equilibrio con las células generadas por la médula ósea; sin embargo, en pacientes VIH positivos, este equilibrio se pierde debido a una incapacidad de la médula ósea para regenerar células CD4+. En el caso del VIH, los linfocitos CD4+ mueren a un ritmo acelerado a través de una apoptosis descontrolada, cuando se estimulan. A nivel molecular, la apoptosis hiperactiva puede ser causada por defectos en las vías de señalización que regulan las proteínas de la familia Bcl-2. El aumento de la expresión de proteínas apoptóticas como BIM, o la disminución de su proteólisis, conduce a la muerte celular y puede causar una serie de patologías, dependiendo de las células en las que se produzca una actividad excesiva de BIM. Las células cancerosas pueden escapar de la apoptosis a través de mecanismos que suprimen la expresión de BIM o mediante el aumento de la proteólisis de BIM. [ cita requerida ]
Los tratamientos que tienen como objetivo inhibir las funciones de bloqueo de caspasas específicas. Por último, la proteína quinasa Akt promueve la supervivencia celular a través de dos vías. Akt fosforila e inhibe Bad (un miembro de la familia Bcl-2), lo que hace que Bad interactúe con el andamiaje 14-3-3 , lo que da como resultado la disociación de Bcl y, por lo tanto, la supervivencia celular. Akt también activa IKKα, lo que conduce a la activación de NF-κB y la supervivencia celular. El NF-κB activo induce la expresión de genes antiapoptóticos como Bcl-2, lo que da como resultado la inhibición de la apoptosis. Se ha descubierto que NF-κB desempeña tanto un papel antiapoptótico como un papel proapoptótico dependiendo de los estímulos utilizados y el tipo de célula. [99]
La progresión de la infección por el virus de la inmunodeficiencia humana hacia el SIDA se debe principalmente a la disminución de los linfocitos T colaboradores CD4+ de una manera demasiado rápida para que la médula ósea del cuerpo pueda reponer las células, lo que conduce a un sistema inmunológico comprometido. Uno de los mecanismos por los cuales se reducen los linfocitos T colaboradores es la apoptosis, que resulta de una serie de vías bioquímicas: [100]
Las células también pueden morir como consecuencia directa de infecciones virales. La expresión del VIH-1 induce la detención de la G2/M de las células tubulares y la apoptosis. [101] La progresión del VIH al SIDA no es inmediata ni necesariamente rápida; la actividad citotóxica del VIH hacia los linfocitos CD4+ se clasifica como SIDA una vez que el recuento de células CD4+ de un paciente determinado cae por debajo de 200. [102]
Investigadores de la Universidad de Kumamoto en Japón han desarrollado un nuevo método para erradicar el VIH en las células del reservorio viral, denominado "Lock-in y apoptosis". Utilizando el compuesto sintetizado heptanoylphosphatidyl L-Inositol Pentakisphophate (o L-Hippo) para unirse fuertemente a la proteína PR55Gag del VIH, lograron suprimir la gemación viral. Al suprimir la gemación viral, los investigadores pudieron atrapar el virus VIH en la célula y permitir que la célula sufriera apoptosis (muerte celular natural). La profesora asociada Mikako Fujita ha declarado que el enfoque aún no está disponible para los pacientes con VIH porque el equipo de investigación tiene que realizar más investigaciones sobre la combinación de la terapia farmacológica que existe actualmente con este enfoque de "Lock-in y apoptosis" para lograr una recuperación completa del VIH. [103]
La inducción viral de la apoptosis ocurre cuando una o varias células de un organismo vivo son infectadas con un virus , lo que lleva a la muerte celular. La muerte celular en los organismos es necesaria para el desarrollo normal de las células y la maduración del ciclo celular. [104] También es importante para mantener las funciones y actividades regulares de las células.
Los virus pueden desencadenar la apoptosis de las células infectadas a través de una variedad de mecanismos, entre ellos:
Se sabe que el virus del moquillo canino (CDV) causa apoptosis en el sistema nervioso central y el tejido linfoide de perros infectados in vivo e in vitro. [106] La apoptosis causada por CDV se induce típicamente a través de la vía extrínseca , que activa caspasas que alteran la función celular y eventualmente conducen a la muerte celular. [90] En células normales, CDV activa primero la caspasa-8, que funciona como proteína iniciadora seguida de la proteína ejecutora caspasa-3. [90] Sin embargo, la apoptosis inducida por CDV en células HeLa no involucra a la proteína iniciadora caspasa-8. La apoptosis de células HeLa causada por CDV sigue un mecanismo diferente al de las líneas celulares vero. [90] Este cambio en la cascada de caspasas sugiere que CDV induce apoptosis a través de la vía intrínseca , excluyendo la necesidad de la caspasa-8 iniciadora. La proteína ejecutora es activada en cambio por los estímulos internos causados por la infección viral, no por una cascada de caspasas. [90]
El virus Oropouche (OROV) pertenece a la familia Bunyaviridae . El estudio de la apoptosis provocada por Bunyaviridae se inició en 1996, cuando se observó que el virus La Crosse inducía la apoptosis en las células renales de crías de hámster y en los cerebros de crías de ratón. [107]
El OROV es una enfermedad que se transmite entre humanos a través del mosquito picador ( Culicoides paraensis ). [108] Se le conoce como un arbovirus zoonótico y causa una enfermedad febril, caracterizada por la aparición de una fiebre repentina conocida como fiebre de Oropouche. [109]
El virus Oropouche también causa alteraciones en las células cultivadas, es decir, en condiciones específicas y específicas. Un ejemplo de esto se puede observar en las células HeLa , que comienzan a degenerarse poco después de ser infectadas. [107]
Con el uso de electroforesis en gel , se puede observar que OROV causa fragmentación de ADN en células HeLa. Se puede interpretar contando, midiendo y analizando las células de la población celular Sub/G1. [107] Cuando las células HeLA se infectan con OROV, el citocromo C se libera de la membrana de las mitocondrias al citosol de las células. Este tipo de interacción muestra que la apoptosis se activa a través de una vía intrínseca. [104]
Para que se produzca la apoptosis en el virus OROV, es necesario que el virus pierda su envoltura, se internalice y se produzca la replicación celular. En algunos virus, la apoptosis se activa mediante estímulos extracelulares. Sin embargo, estudios han demostrado que la infección por OROV provoca la activación de la apoptosis mediante estímulos intracelulares e involucra a las mitocondrias. [107]
Muchos virus codifican proteínas que pueden inhibir la apoptosis. [110] Varios virus codifican homólogos virales de Bcl-2. Estos homólogos pueden inhibir proteínas proapoptóticas como BAX y BAK, que son esenciales para la activación de la apoptosis. Los ejemplos de proteínas virales Bcl-2 incluyen la proteína BHRF1 del virus de Epstein-Barr y la proteína E1B 19K del adenovirus . [111] Algunos virus expresan inhibidores de caspasa que inhiben la actividad de la caspasa y un ejemplo es la proteína CrmA de los virus de la viruela bovina. Mientras que varios virus pueden bloquear los efectos de TNF y Fas. Por ejemplo, la proteína M-T2 de los virus mixoma puede unirse a TNF impidiendo que se una al receptor de TNF e induciendo una respuesta. [112] Además, muchos virus expresan inhibidores de p53 que pueden unirse a p53 e inhibir su actividad de transactivación transcripcional. Como consecuencia, p53 no puede inducir apoptosis, ya que no puede inducir la expresión de proteínas proapoptóticas. La proteína E1B-55K del adenovirus y la proteína HBx del virus de la hepatitis B son ejemplos de proteínas virales que pueden realizar dicha función. [113]
Los virus pueden permanecer intactos tras la apoptosis, en particular en las últimas etapas de la infección. Pueden ser exportados en los cuerpos apoptóticos que se desprenden de la superficie de la célula moribunda, y el hecho de que sean engullidos por los fagocitos impide el inicio de una respuesta del huésped. Esto favorece la propagación del virus. [112] Los priones pueden causar apoptosis en las neuronas .
La muerte celular programada en plantas tiene varias similitudes moleculares con la apoptosis animal, pero también tiene diferencias, siendo las más notables la presencia de una pared celular y la falta de un sistema inmunológico que elimine los trozos de la célula muerta. En lugar de una respuesta inmunológica, la célula moribunda sintetiza sustancias para descomponerse y las coloca en una vacuola que se rompe cuando la célula muere. Además, las plantas no contienen células fagocíticas, que son esenciales en el proceso de descomposición y eliminación de los cuerpos apoptóticos. [114] No está claro si todo este proceso se parece lo suficiente a la apoptosis animal como para justificar el uso del nombre apoptosis (en contraposición al más general de muerte celular programada ). [115] [116]
La caracterización de las caspasas permitió el desarrollo de inhibidores de caspasa, que pueden utilizarse para determinar si un proceso celular involucra caspasas activas. Utilizando estos inhibidores se descubrió que las células pueden morir mostrando una morfología similar a la apoptosis sin activación de caspasas. [117] Estudios posteriores relacionaron este fenómeno con la liberación de AIF ( factor inductor de apoptosis ) desde la mitocondria y su translocación al núcleo mediada por su NLS ( señal de localización nuclear ). Dentro de la mitocondria, AIF está anclado a la membrana interna. Para ser liberado, la proteína es escindida por una calpaína proteasa dependiente de calcio .