El aminoglucósido es una categoría medicinal y bacteriológica de medicamentos antibacterianos gramnegativos tradicionales que inhiben la síntesis de proteínas y contienen como porción de la molécula un glucósido amino modificado ( azúcar ). [1] [2] El término también puede referirse de manera más general a cualquier molécula orgánica que contenga subestructuras de aminoazúcares . Los antibióticos aminoglucósidos muestran actividad bactericida contra aerobios gramnegativos y algunos bacilos anaeróbicos donde aún no ha surgido resistencia, pero generalmente no contra bacterias grampositivas y gramnegativas anaeróbicas. [3]
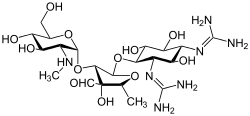
La estreptomicina es el antibiótico aminoglucósido de primera clase . Se deriva de Streptomyces griseus y es el primer agente moderno utilizado contra la tuberculosis . La estreptomicina carece del resto común de 2-desoxiestreptamina (imagen derecha, abajo) presente en la mayoría de los demás miembros de esta clase. Otros ejemplos de aminoglucósidos incluyen los agentes que contienen deoxiestreptamina kanamicina , tobramicina , gentamicina y neomicina (ver más abajo).

Los aminoglucósidos que se derivan de bacterias del género Streptomyces se denominan con el sufijo -micina , mientras que los que se derivan de Micromonospora [4] se denominan con el sufijo -micina . [5] Sin embargo, este sistema de nomenclatura no es específico para los aminoglucósidos, por lo que la aparición de este conjunto de sufijos no implica un mecanismo de acción común. (Por ejemplo, la vancomicina , un antibiótico glicopéptido , [6] y la eritromicina , [7] un antibiótico macrólido producido por Saccharopolyspora erythraea , junto con sus derivados sintéticos claritromicina y azitromicina , comparten los sufijos pero tienen mecanismos de acción notablemente diferentes).
En la siguiente galería, desde la kanamicina A hasta la netilmicina son ejemplos de la subclase de aminoglucósidos desoxiestreptamina disustituida 4,6, las neomicinas son ejemplos de la subclase disustituida 4,5 y la estreptomicina es un ejemplo de una subclase no desoxiestreptamina. aminoglucósido. [2]
Los aminoglucósidos muestran actividad bactericida dependiente de la concentración contra "la mayoría de los bacilos aeróbicos y anaeróbicos facultativos gramnegativos", pero no contra los anaerobios gramnegativos ni la mayoría de las bacterias grampositivas. [3] Requieren sólo un corto tiempo de contacto y son más eficaces contra poblaciones bacterianas susceptibles que se multiplican rápidamente. [8] Estas actividades se atribuyen a un modo de acción principal como inhibidores de la síntesis de proteínas , aunque existen mecanismos adicionales implicados para algunos agentes específicos y/o aún no se dispone de descripciones mecanicistas detalladas. [2] [3] [8]
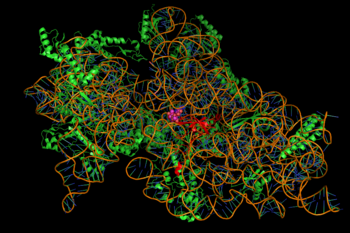
La inhibición de la síntesis de proteínas está mediada por la unión de los aminoglucósidos, dependiente de energía, a veces irreversible, al ribosoma bacteriano citosólico asociado a la membrana (imagen de la derecha). [2] (Los aminoglucósidos primero cruzan las paredes celulares bacterianas ( lipopolisacárido en bacterias gramnegativas) y las membranas celulares, donde se transportan activamente . [8] ) Si bien los pasos específicos en la síntesis de proteínas afectados pueden variar un poco entre agentes aminoglucósidos específicos, al igual que sus afinidad y grado de unión, [8] la presencia de aminoglucósidos en el citosol generalmente altera el alargamiento del péptido en la subunidad ribosomal 30S , dando lugar a una traducción inexacta del ARNm y, por lo tanto, a la biosíntesis de proteínas que están truncadas o que tienen composiciones de aminoácidos alteradas en puntos particulares. [2] Específicamente, la unión perjudica la corrección traslacional , lo que conduce a una lectura errónea del mensaje de ARN, a una terminación prematura o a ambas, y por lo tanto a la inexactitud del producto proteico traducido . El subconjunto de proteínas aberrantes que se incorporan a la membrana celular bacteriana puede provocar cambios en su permeabilidad y luego una "mayor estimulación del transporte de aminoglucósidos". [2] La porción de aminoazúcar de esta clase de moléculas (p. ej., la 2-desoxiestreptamina en las kanamicinas, gentamicinas y tobramicina, ver arriba) están implicadas en la asociación de la molécula pequeña con estructuras ribosómicas que conducen a las infidelidades en la traducción ( ibídem.). También se ha sugerido [ cita necesaria ] la inhibición de la translocación ribosómica , es decir , el movimiento del peptidil-ARNt desde el sitio A al sitio P. Experimentos recientes de seguimiento de una sola molécula en E. coli viva mostraron una síntesis de proteínas continua pero más lenta tras el tratamiento con diferentes aminoglucósidos. [9] ( La espectinomicina , una clase de estructura química relacionada pero distinta que a menudo se analiza con los aminoglucósidos, no induce una lectura errónea del ARNm y generalmente no es bactericida) .
Se ha propuesto que los antibióticos aminoglucósidos provocan la oxidación de los nucleótidos de guanina en el conjunto de nucleótidos bacterianos y que esto contribuye a la citotoxicidad de estos antibióticos. [10] La incorporación de nucleótidos de guanina oxidados en el ADN podría ser bactericida ya que la reparación incompleta de 8-oxo-2'-desoxiguanosina muy espaciada en el ADN puede provocar roturas letales de la doble hebra. [10]
Finalmente, con los aminoglucósidos se produce otro "efecto de membrana celular"; La "integridad funcional de la membrana celular bacteriana" puede perderse más adelante en el transcurso del tiempo de exposición y transporte de aminoglucósidos. [11]
Existe una variabilidad significativa en la relación entre la dosis administrada y el nivel plasmático resultante en sangre. [ cita necesaria ] La monitorización terapéutica de medicamentos (TDM) es necesaria para obtener la dosis correcta. Estos agentes exhiben un efecto post-antibiótico en el que hay muy poco o ningún nivel de fármaco detectable en la sangre, pero todavía parece haber inhibición del nuevo crecimiento bacteriano. Esto se debe a una unión fuerte e irreversible al ribosoma, permanece intracelular mucho después de que los niveles plasmáticos caen y permite un intervalo de dosificación prolongado. [ cita necesaria ] Dependiendo de su concentración, actúan como agentes bacteriostáticos o bactericidas . [12]
Los aminoglucósidos son útiles principalmente en infecciones que involucran bacterias aerobias gramnegativas , como Pseudomonas , Acinetobacter y Enterobacter . Además, algunas micobacterias , incluidas las bacterias que causan la tuberculosis , son susceptibles a los aminoglucósidos. La estreptomicina fue el primer fármaco eficaz en el tratamiento de la tuberculosis, aunque el papel de los aminoglucósidos como la estreptomicina y la amikacina ha quedado eclipsado (debido a su toxicidad y su incómoda vía de administración), excepto en el caso de las cepas resistentes a múltiples fármacos. [ cita necesaria ] El uso más frecuente de aminoglucósidos es la terapia empírica para infecciones graves como sepsis , infecciones intraabdominales complicadas, infecciones complicadas del tracto urinario e infecciones nosocomiales del tracto respiratorio. Por lo general, una vez que se cultivan los cultivos del organismo causal y se prueban sus susceptibilidades, se suspenden los aminoglucósidos en favor de antibióticos menos tóxicos. [ cita necesaria ]
Como se señaló, los aminoglucósidos son en su mayoría ineficaces contra bacterias anaeróbicas, hongos y virus. [2] Las infecciones causadas por bacterias Gram-positivas también se pueden tratar con aminoglucósidos, pero otros tipos de antibióticos son más potentes y menos dañinos para el huésped. Los aminoglucósidos se han utilizado en el pasado junto con antibióticos betalactámicos en infecciones estreptocócicas por sus efectos sinérgicos, en particular en endocarditis . Una de las combinaciones más frecuentes es la ampicilina (un betalactámico o antibiótico relacionado con la penicilina) y gentamicina. A menudo, el personal del hospital se refiere a esta combinación como "amp y gent" o, más recientemente, como "pen and gent" para la penicilina y la gentamicina. [ cita necesaria ]
La interferencia con la corrección del ARNm se ha aprovechado para tratar enfermedades genéticas que resultan de codones de parada prematuros (que conducen a la terminación temprana de la síntesis de proteínas y a las proteínas truncadas). Los aminoglucósidos pueden hacer que la célula supere los codones de parada, inserte un aminoácido aleatorio y exprese una proteína de longitud completa. [13] El aminoglucósido gentamicina se ha utilizado para tratar las células de fibrosis quística (FQ) en el laboratorio para inducirlas a desarrollar proteínas de longitud completa. La FQ es causada por una mutación en el gen que codifica la proteína reguladora de la conductancia transmembrana de la fibrosis quística ( CFTR ). En aproximadamente el 10% de los casos de FQ, la mutación en este gen provoca su terminación temprana durante la traducción , lo que lleva a la formación de una proteína CFTR truncada y no funcional. Se cree que la gentamicina distorsiona la estructura del complejo ribosoma-ARN, lo que lleva a una lectura errónea del codón de terminación , provocando que el ribosoma "salta" la secuencia de parada y continúa con el alargamiento y producción normal de la proteína CFTR. . [14]
Dado que no se absorben en el intestino, se administran por vía intravenosa e intramuscular . Algunos se utilizan en preparaciones tópicas para heridas. La administración oral se puede utilizar para la descontaminación intestinal (p. ej., en la encefalopatía hepática). La tobramicina se puede administrar en forma nebulizada. [15]
La reciente aparición de infecciones debidas a cepas de bacterias gramnegativas con patrones avanzados de resistencia a los antimicrobianos ha llevado a los médicos a reevaluar el uso de estos agentes antibacterianos. [16] Este renovado interés en el uso de aminoglucósidos ha vuelto a sacar a la luz el debate sobre las dos cuestiones principales relacionadas con estos compuestos, a saber, el espectro de susceptibilidad y toxicidad antimicrobiana. La evidencia actual muestra que los aminoglucósidos conservan actividad contra la mayoría de los aislados de bacterias clínicas Gram-negativas en muchas partes del mundo. Aun así, la aparición relativamente frecuente de nefrotoxicidad y ototoxicidad durante el tratamiento con aminoglucósidos hace que los médicos se muestren reacios a utilizar estos compuestos en la práctica diaria. Los avances recientes en la comprensión del efecto de diversas pautas posológicas de aminoglucósidos sobre la toxicidad han proporcionado una solución parcial a este problema, aunque aún es necesario realizar más investigaciones para superarlo por completo. [17]
Los aminoglucósidos se encuentran en la categoría D del embarazo , [18] es decir, existe evidencia positiva de riesgo fetal humano basada en datos de reacciones adversas provenientes de experiencias o estudios de investigación o comercialización en humanos, pero los beneficios potenciales pueden justificar el uso del medicamento en mujeres embarazadas a pesar de los posibles beneficios. riesgos.
Los aminoglucósidos pueden causar toxicidad en el oído interno, lo que puede provocar pérdida auditiva neurosensorial . [19] La incidencia de toxicidad en el oído interno varía del 7 al 90%, dependiendo de los tipos de antibióticos utilizados, la susceptibilidad del paciente a dichos antibióticos y la duración de la administración de antibióticos. [20]
Otro efecto secundario grave e incapacitante del uso de aminoglucósidos es la ototoxicidad vestibular. [19] Esto conduce a oscilopsia (inestabilidad de la mirada) y alteraciones del equilibrio que afectan todos los aspectos de la función antigravedad de un individuo. Esta pérdida es permanente y puede ocurrir en cualquier dosis. [21] [22] [23] [24]
El uso frecuente de aminoglucósidos podría provocar daño renal (lesión renal aguda), que podría provocar una enfermedad renal crónica . [25]
Los aminoglucósidos pueden exacerbar la debilidad en pacientes con miastenia gravis y, por lo tanto, se evita su uso en estos pacientes. [26]
Los aminoglucósidos están contraindicados en pacientes con enfermedades mitocondriales, ya que pueden alterar la traducción del ADNmt, lo que puede provocar pérdida auditiva irreversible, tinnitus, toxicidad cardíaca y toxicidad renal. Sin embargo, también se ha observado pérdida de audición y tinnitus en algunos pacientes sin enfermedades mitocondriales. [27]
{{cite journal}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )