
En química orgánica , una α-halocetona es un grupo funcional que consiste en un grupo cetona o, más generalmente, un grupo carbonilo con un sustituyente α- halógeno . Las α-halocetonas son agentes alquilantes . Las α-halocetonas prominentes incluyen bromuro de fenacilo y cloroacetona . [1]
La estructura general es RR′C(X)C(=O)R donde R es un residuo alquilo o arilo y X cualquiera de los halógenos. La conformación preferida de una halocetona es la de un cisoide con el halógeno y el carbonilo compartiendo el mismo plano ya que el impedimento estérico con el grupo alquilo carbonilo es generalmente mayor. [2]
Las halocetonas y los compuestos halocarbonílicos en general se sintetizan por reacción de compuestos carbonílicos con fuentes de X + (X = halógeno), que se obtiene utilizando halógenos : [1]
Las fuentes especializadas de agentes halogenantes electrofílicos incluyen N -bromosuccinimida y 1,3-dibromo-5,5-dimetilhidantoína (DBDMH). En la reacción de Nierenstein, un cloruro de acilo reacciona con diazometano.
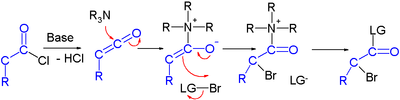
Se han descrito esfuerzos en la síntesis asimétrica de halocarbonilos mediante organocatálisis . En un estudio, un cloruro de ácido se convierte en un éster α-halo con una base fuerte ( hidruro de sodio ), un donador de bromo y un organocatalizador basado en prolina y quinina : [3]

En el mecanismo de reacción propuesto , la base primero convierte el cloruro de ácido en cetena , luego el organocatalizador introduce quiralidad a través de su amina terciaria quinonoide , formando un aducto de cetena.
Un ejemplo de su actividad alquilante son las reacciones con yoduro de potasio en acetona ; la cloroacetona reacciona más rápido que el 1-cloropropano por un factor de 36.000. Las halocetonas reaccionan con fosfitos en la reacción de Perkow .
El grupo halo se puede eliminar en la deshalogenación reductora de halocetonas . Las α-halocetonas también se pueden convertir en alquenos mediante tratamiento con hidrazina.
Debido a la presencia de dos grupos que atraen electrones (carbonilo y haluro), el α-hidrógeno es ácido. Esta propiedad se aprovecha en la transposición de Favorskii , donde la base primero abstrae un α-hidrógeno ácido y luego el carbanión resultante desplaza al halógeno.
En las reacciones aldólicas cruzadas entre halocetonas y aldehídos , el producto de reacción inicial es una halohidrina que posteriormente puede formar un oxirano en presencia de una base.
Las α-halocetonas pueden reaccionar con aminas para formar una α-halo imina, que puede convertirse nuevamente en la halocetona original por hidrólisis , de modo que las halo iminas pueden usarse como versiones enmascaradas de las halocetonas. Esto permite lograr algunas transformaciones químicas que no son posibles con las halocetonas originales directamente. [4]
Las halocetonas participan en varios tipos de reacciones, especialmente porque son bifuncionales, con dos sitios electrofílicos (carbono α y carbono carbonílico). En una manifestación de esta dualidad, son precursoras de heterociclos. Los tiazoles surgen de la reacción de cloroacetona con tioamidas. Los 2-aminotiazoles se producen de manera similar por reacción de 2-clorocetonas con tioureas . [5] [6] Los pirroles pueden sintetizarse por reacción de halocetonas con dicarbonilos y amoníaco en la síntesis de pirrol de Hantzsch .