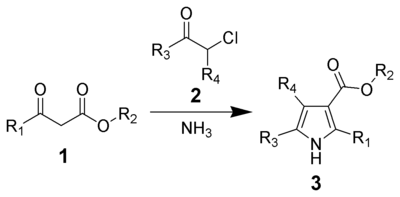
La síntesis de pirrol de Hantzsch , llamada así por Arthur Rudolf Hantzsch , es la reacción química de β-cetoésteres ( 1 ) con amoníaco (o aminas primarias ) y α-halocetonas ( 2 ) para dar pirroles sustituidos ( 3 ). [1] [2] Los pirroles se encuentran en una variedad de productos naturales con actividad biológica, por lo que la síntesis de pirroles sustituidos tiene importantes aplicaciones en la química medicinal. [3] [4] Existen métodos alternativos para sintetizar pirroles, como la síntesis de pirroles de Knorr y la síntesis de Paal-Knorr .
A continuación se muestra un mecanismo publicado para la reacción: [5]
El mecanismo comienza cuando la amina ( 1 ) ataca el carbono β de los β-cetoésteres ( 2 ) y, finalmente, forma una enamina ( 3 ). Luego, la enamina ataca el carbono carbonilo de la α-halocetona ( 4 ). A esto le sigue la pérdida de H2O , dando lugar a una imina ( 5 ). Este intermedio sufre un ataque nucleofílico intramolecular, formando un anillo de 5 miembros ( 6 ). Finalmente, se elimina el hidrógeno y los enlaces pi se reordenan en el anillo, produciendo el producto final ( 7 ).
Se ha propuesto un mecanismo alternativo en el que la enamina ( 3 ) ataca el carbono α de la α-halocetona ( 4 ) como parte de una sustitución nucleofílica, en lugar de atacar el carbono carbonilo. [6]
Estevez et al. desarrollaron una generalización de la síntesis del pirrol de Hantzsch. [7] En esta reacción se pueden sintetizar pirroles altamente sustituidos en una reacción en un solo recipiente, con rendimientos relativamente altos (60% - 97%). Esta reacción implica la molienda por vibración de alta velocidad (HSVM) de cetonas con N -yodosuccinimida (NIS) y ácido p -toluenosulfónico , para formar una α-yodocetona in situ . A esto le sigue la adición de una amina primaria, un compuesto β-dicarbonilo, nitrato de amonio y cerio (IV) (CAN) y nitrato de plata , como se muestra en el siguiente esquema:
Los pirroles 2,3-dicarbonilados se pueden sintetizar mediante una versión de la síntesis de pirroles de Hantzsch. [8] Estos pirroles son particularmente útiles para la síntesis total porque los grupos carbonilo se pueden convertir en una variedad de otros grupos funcionales.
La reacción también puede ocurrir entre una enamina y una α-halocetona para sintetizar indoles sustituidos , que también tienen importancia biológica. [6] [9]

Se puede producir rápidamente una biblioteca de análogos de pirrol sustituidos utilizando química de flujo continuo (tiempos de reacción de aproximadamente 8 min). [10] La ventaja de utilizar este método, a diferencia de la síntesis en matraz, es que éste no requiere el procesamiento y la purificación de varios intermedios y, por lo tanto, podría conducir a un mayor porcentaje de rendimiento.