La vinblastina ( VBL ), que se vende bajo la marca Velban , entre otras, es un medicamento de quimioterapia que se usa normalmente con otros medicamentos para tratar varios tipos de cáncer . [1] Esto incluye el linfoma de Hodgkin , el cáncer de pulmón de células no pequeñas , el cáncer de vejiga , el cáncer de cerebro , el melanoma y el cáncer testicular . [1] Se administra mediante inyección en una vena . [1]
La mayoría de las personas experimentan algunos efectos secundarios. [1] Comúnmente causa un cambio en la sensibilidad, estreñimiento , debilidad, pérdida de apetito y dolores de cabeza . [1] Los efectos secundarios graves incluyen recuentos bajos de células sanguíneas y dificultad para respirar . [1] No debe administrarse a personas que tengan una infección bacteriana actual . [1] El uso durante el embarazo probablemente dañará al bebé. [1] La vinblastina actúa bloqueando la división celular . [1]
La vinblastina fue aislada en 1958. [2] La vinblastina , un ejemplo de remedio herbal natural que desde entonces se ha convertido en una medicina convencional, se obtuvo originalmente de la vincapervinca de Madagascar . [3] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [4]
La vinblastina es un componente de varios regímenes de quimioterapia , incluido ABVD para el linfoma de Hodgkin y, junto con el metotrexato, en el tratamiento de la fibromatosis agresiva (tumor desmoide). [5] [6] También se utiliza para tratar la histiocitosis de acuerdo con los protocolos establecidos por la Asociación de Histiocitosis.
Los efectos adversos de la vinblastina incluyen pérdida de cabello, pérdida de glóbulos blancos y plaquetas, problemas gastrointestinales, presión arterial alta, sudoración excesiva, depresión, calambres musculares, vértigo y dolores de cabeza. [7] [1] Como vesicante , la vinblastina puede causar daño tisular extenso y ampollas si se escapa de la vena debido a una administración inadecuada. [8]
La vinblastina es un alcaloide de la vinca [9] [2] [10] y un análogo químico de la vincristina [11] [12] Se une a la tubulina , inhibiendo así el ensamblaje de los microtúbulos [13] El tratamiento con vinblastina provoca una detención del ciclo celular específica de la fase M al interrumpir el ensamblaje de los microtúbulos y la formación adecuada del huso mitótico y el cinetocoro , cada uno de los cuales es necesario para la separación de los cromosomas durante la anafase de la mitosis. Las toxicidades incluyen supresión de la médula ósea (que es limitante de la dosis), toxicidad gastrointestinal , potente actividad vesicante (que forma ampollas) y lesión por extravasación (forma úlceras profundas). Los paracristales de vinblastina pueden estar compuestos de tubulina o microtúbulos no polimerizados muy compactados [14]
Se informa que la vinblastina es un componente eficaz de ciertos regímenes de quimioterapia, en particular cuando se utiliza con bleomicina y metotrexato en la quimioterapia VBM para linfomas de Hodgkin en estadio IA o IIA. La inclusión de vinblastina permite dosis más bajas de bleomicina y una toxicidad general reducida con períodos de descanso más largos entre los ciclos de quimioterapia. [15]
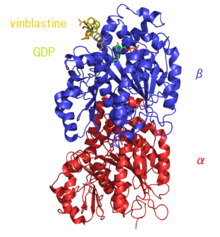
Se ha informado que los fármacos que alteran los microtúbulos, como la vinblastina, la colcemid y el nocodazol , actúan mediante dos mecanismos. [16] En concentraciones muy bajas, suprimen la dinámica de los microtúbulos y, en concentraciones más altas, reducen la masa del polímero de los microtúbulos. Hallazgos recientes indican que también producen fragmentos de microtúbulos al estimular el desprendimiento del extremo negativo de los microtúbulos de sus centros organizadores. Los estudios de dosis-respuesta indican además que el desprendimiento mejorado de los microtúbulos de los polos del huso se correlaciona mejor con la citotoxicidad. [17] Pero la investigación sobre el mecanismo aún está en curso, ya que estudios recientes también muestran que la vinblastina induce apoptosis que es independiente de la fase en ciertas leucemias. [18]
La vinblastina parece ser un fármaco selectivo a nivel periférico debido a su limitada absorción cerebral causada por la unión a la glicoproteína P. [19] [20]
La vinblastina se puede aislar de la vincapervinca de Madagascar ( Catharanthus roseus ), su único productor biológico conocido, [21] junto con varios de sus precursores, la catarantina y la vindolina . La extracción es costosa y los rendimientos de vinblastina y sus precursores son bajos, aunque se han desarrollado procedimientos para un aislamiento rápido con rendimientos mejorados evitando la autooxidación. La síntesis enantioselectiva ha sido de considerable interés en los últimos años, ya que la mezcla natural de isómeros no es una fuente económica para la estereoquímica C16'S, C14'R requerida de la vinblastina biológicamente activa. Inicialmente, el enfoque depende de una epoxidación de Sharpless enantioselectiva , que establece la estereoquímica en C20. La configuración deseada alrededor de C16 y C14 se puede fijar durante los pasos siguientes. En esta vía, la vinblastina se construye mediante una serie de reacciones de ciclización y acoplamiento que crean la estereoquímica requerida. El rendimiento total puede ser tan grande como 22%, lo que hace que este enfoque sintético sea más atractivo que la extracción de fuentes naturales, cuyo rendimiento total es de alrededor del 10%. [22] La estereoquímica se controla a través de una mezcla de agentes quirales (catalizadores Sharpless) y condiciones de reacción (temperatura y materiales de partida enantiopuros seleccionados). [23] Debido a la dificultad de las restricciones estereoquímicas en los procesos sintéticos totales, se siguen desarrollando otros métodos semisintéticos a partir de precursores, catarantina y vindolina . [24]
La vinblastina fue aislada por primera vez por Robert Noble y Charles Thomas Beer en la Universidad de Western Ontario a partir de la planta vincapervinca de Madagascar . La utilidad de la vinblastina como agente quimioterapéutico fue sugerida por primera vez por su efecto sobre el cuerpo cuando se inyectó un extracto de la planta en conejos para estudiar el supuesto efecto antidiabético de la planta. (Un té hecho con la planta era un remedio popular para la diabetes). Los conejos murieron de una infección bacteriana, debido a una disminución en el número de glóbulos blancos , por lo que se planteó la hipótesis de que la vinblastina podría ser eficaz contra los cánceres de los glóbulos blancos , como el linfoma . [25] Fue aprobado por la FDA en 1965. [13]